猪传染性胃肠炎病毒M蛋白的表达与抗体制备
任晓峰,邹昊,孙雪娇
(东北农业大学动物医学学院,哈尔滨 150030)
猪传染性胃肠炎病毒M蛋白的表达与抗体制备
任晓峰,邹昊,孙雪娇
(东北农业大学动物医学学院,哈尔滨 150030)
文章表达猪传染性胃肠炎病毒TGEV M基因,制备抗M蛋白多克隆抗体。扩增的M基因经Bam H I和Eco R I双酶切后克隆到原核表达载体PGEX-6P-1上,构建重组表达质粒PGEX-6P-1-TGEV-M,经IPTG诱导,获得以包含体形式表达的重组蛋白。将重组蛋白作为免疫原免疫大白兔制备兔抗TGEV-M抗体,进行效价测定及生物活性检测。结果表明,多抗效价达1:262 144;间接ELISA和间接免疫荧光试验说明,此多抗可与TGEV-M重组蛋白及TGEV发生抗原抗体反应。此多抗可作为鉴别诊断试剂将TGEV从众多猪源病毒中区分出来。
猪传染性胃肠炎病毒;原核表达;抗体制备;鉴别诊断
猪传染性胃肠炎(Porcine transmissible gastro⁃enteritis)是一种猪高度接触性传染性疾病,可导致哺乳仔猪100%致死率[1]。临床症状包括急性腹泻、呕吐和脱水[2]。虽然不同年龄和不同品种猪对本病都易感,但猪5周龄以上很少死亡,多成僵猪,饲料报酬低[3]。病毒包含四个结构蛋白:刺突蛋白(S)、小囊膜蛋白(SM/E)、膜蛋白(M)、和核衣壳蛋白(N)[4]。其中S蛋白是一种大的贯穿细胞膜表面糖蛋白,对诱导病毒中和抗体起重要作用。N蛋白与基因组RNA一起形成病毒核衣壳。SM蛋白调节病毒粒子的组装和释放[5]。M蛋白是冠状病毒中含量最丰富的成分[6],在病毒颗粒构建中起重要作用,在病毒装配期间将核衣壳连接到囊膜上,影响病毒变异。M蛋白在诱导先天性免疫以及产生干扰素方面起到关键性作用[7]。国内外专家已对TGEV的M蛋白做过较多研究,乔薪瑗等制备过M蛋白单抗[8],可成功应用在TGEV鉴别诊断试验中。张小波等也针对TGEV M蛋白制备过多克隆抗体[9]。但由于本试验所用毒株是已分离成功毒株,对M基因测序后,发现其与已发表的基因序列有一定差异,因此研究此M蛋白制备的多抗免疫反应及识别特性。文章将已有的PGEX-6P-1-TGEV-M阳性质粒诱导表达成蛋白,质粒中M片段来自之前分离的毒株,将蛋白作为抗原免疫大白兔,制备抗TGEV-M多克隆抗体,并将此多克隆抗体作为鉴别诊断试剂,将TGEV从七种猪源病毒中区分出来。
1 材料与方法
1.1 材料
猪传染性胃肠炎病毒(TGEV)(PUR46-MAD毒株),猪睾丸细胞(ST),东北农业大学分子病原学与公共卫生实验室保存PGEX-6p-1-TGEV-M阳性质粒,其中M基因大小从52~789 bp,E.coli rossta感受态细胞,IPTG诱导剂,山羊抗兔HRP-IgG,购自Solarbio公司;新西兰大白兔,体重2 kg,雌性,购自中国农业科学院哈尔滨兽医研究所动物实验中心。
1.2 重组TGEV-M蛋白表达与纯化
将PGEX-6P-1-TGEV-M转化E.coli rossta感受态细胞,并涂抹于LB板上,待形成菌落后,挑取单克隆菌落进行活化,加入终浓度为0.5 mmol·mL-1IPTG在37℃条件下诱导表达。每隔1 h取1 mL诱导菌液,共6 h。将收集的菌液在4℃、12 000 r·min-1条件下离心5 min收集沉淀。沉淀用30 μL PBS悬起后加入等量的2×SDS凝胶上样缓冲液,煮沸10 min,用于SDS-PAGE电泳分析。将诱导表达5 h的菌液超声破碎处理后对包涵体形式表达的重组蛋白进行切胶纯化。以NANODROP 2000仪器测定蛋白含量。对纯化的蛋白进行复性,复性过程采用透析方法进行,具体操作步骤参照文献[8]。
1.3 重组蛋白Western Blot鉴定分析
将诱导5 h的重组TGEV-M蛋白和未诱导的蛋白以及PGEX-6P-1空载体进行SDS-PAGE电泳,转印至硝酸纤维素膜上,用5%脱脂乳37℃封闭3 h,以兔抗TGEV全病毒多抗(1∶300稀释)为一抗,室温孵育1 h,以HRP标记的山羊抗兔IgG(1∶1 000稀释)为二抗,室温孵育50 min,DAB避光显色。
1.4 兔抗重组TGEV-M蛋白多克隆抗体的制备
取复性后的重组TGEV-M蛋白作为免疫原,调整蛋白浓度为2 mg·mL-1[9]。取1 mL蛋白与等量弗氏完全佐剂充分乳化,对大白兔背部皮下进行多点注射免疫。2周后,调整蛋白浓度为1 mg·mL-1,取1 mL蛋白与等量弗氏不完全佐剂充分乳化经皮下多点注射进行加强免疫,以后每隔7 d加强免疫一次,共4次[10-12]。最后一次免疫后5 d,颈动脉无菌取血,血液置于37℃温箱放置2 h后,置于4℃过夜,次日无菌收集血清,分装保存。
1.5 ELISA试验测定多抗效价
将纯化重组TGEV-M蛋白作为抗原包被ELISA板,5%脱脂乳封闭后加入2倍倍比稀释的兔抗血清,洗涤后加入HRP标记的山羊抗兔IgG,同时设有阴性血清对照组,OPD显色,测定OD490nm处读数。
1.6 间接免疫荧光试验和Western Blot试验检测多抗特异性
将ST细胞接种于24孔细胞培养板中,试验组孵育100 TCID50的TGEV 37℃48 h,同时设定细胞对照组。加入1∶300待检多抗孵育1 h,洗涤后再加入1∶500 FITC标记的山羊抗兔二抗孵育50 min,在荧光显微镜下观察。
将纯化后M蛋白与空载体标签蛋白进行SDS-PAGE电泳,转印至硝酸纤维素膜上,进行Western Blot,方法同1.3。
1.7 多克隆抗体鉴别诊断试验
将猪传染性胃肠炎病毒[TGEV(1)、TGEV(2)]、其中TGEV(1)的M基因序列与已发表的序列同源性很高、而TGEV(2)的M基因序列与已发表的序列有一定差异性。猪流行性腹泻病毒(PEDV)、猪呼吸与繁殖障碍综合征病毒(PRRSV)、猪细小病毒(PPV)、猪圆环病毒(PCV)、猪轮状病毒(PRV)和猪伪狂犬病病毒(PrV)作为抗原包被ELSIA板子,每孔5 μg,4℃过夜,弃去上清后用5%脱脂乳封闭37℃封闭2 h,清洗过后孵育1∶300稀释的多克隆抗体,37℃1 h,清洗后孵育1∶1 000稀释的HRP山羊抗兔二抗,37℃50 min,OD490nm显色。同时用兔阴性血清作为阴性对照组。
2 结果与分析
2.1 重组质粒诱导表达
将重组的PGEX-6P-1-TGEV-M菌液在37℃条件下经0.5 mmol·mL-1的IPTG诱导,每小时取1 mL菌液作为样本,结果显示在诱导5 h时,蛋白表达量达到最大,所以将诱导5 h的菌液进行超生破碎,离心后取沉淀,用PBS悬起后加入等量的2× SDS混合后煮沸。经SDS-PAGE分析证明重组TGEV-M蛋白获得表达,表达产物大小为55 ku(见图1~2),与预期的目的蛋白大小一致。Western Blot证实该蛋白可与抗TGEV全病毒多抗血清发生特异性反应(见图3)。
2.2 测定多抗血清效价及特异性鉴定
用重组TGEV-M蛋白检测多抗血清效价,以健康未进行任何免疫的大白兔血清为阴性对照。以阳性值/阴性值>2作为判断标准,ELISA数据(OD490nm)显示,抗体效价达1∶262 144(见图4)。表明重组TGEV-M蛋白具有良好的免疫学活性。间接免疫荧光试验和Western Blot试验证明此多抗能够特异性结合TGEV而与细胞对照无反应(见图5~6)。

图1 原核表达TGEV-M蛋白SDS-PAGE的结果Fig.1 Result of prokaryotic expression of TGEV-M protein

图2 蛋白纯化前后的SDS-PAGEFig.2 Result of M protein before and after purification
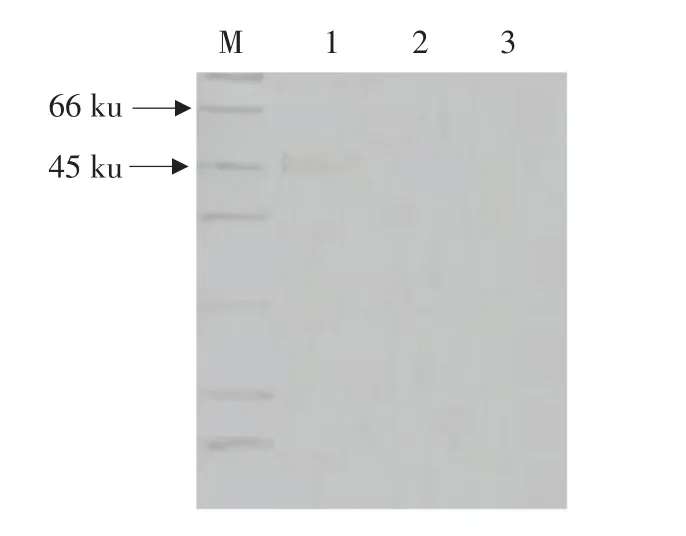
图3 Western-Blot检测重组蛋白与TGEV全病毒多抗的特异性反应Fig.3 Western-Blot analysis the specific reaction between rTGEV-M protein and whole virus antibody

图4 抗TGEV-M蛋白抗体效价分析Fig.4 Antibody titer of antibody against rTGEV-M

图5 间接免疫荧光试验检测多抗对病毒的特异性Fig.5 Indirect immunofluorescence assay detect specific interactions between polyclonal antibody and virus
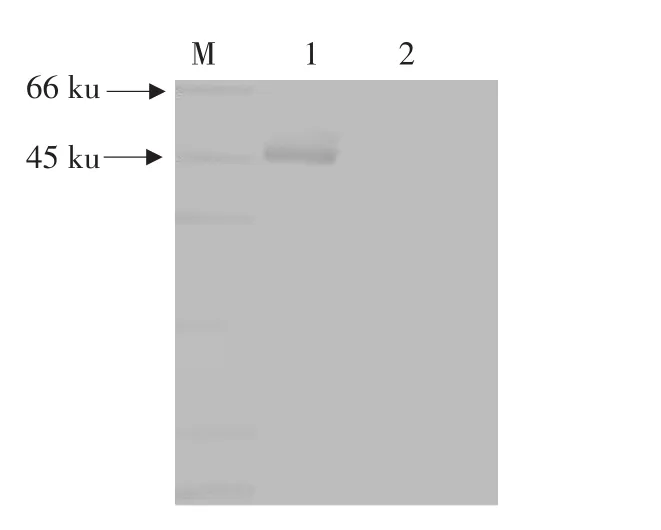
图6 Western Blot检测抗体的特异性Fig.6 Detecting the specificity of the antibody by Western Blot
2.3 多抗的鉴别诊断结果
1∶300的TGEV M多抗可以与TGEV(1)和TGEV(2)特异性结合,而与其他猪源病毒没有结合活性,以阳性值/阴性值大于2作为判断标准。结果见图7。
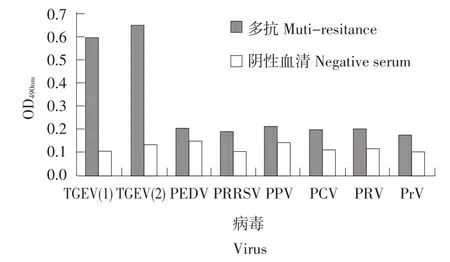
图7 多抗的鉴别诊断结果Fig.7 Result of differential diagnosis of polyclonal antibody
3 讨论与结论
TGEV属于冠状病毒科冠状病毒属,基因组为不分节段的单股正链RNA,大小为28.6 kb,5′有帽子结构,3′有poly A结构[5]。M蛋白的分子质量为28~31 ku,M基因全长789 bp,约含262个氨基酸,其羧基端暴露在病毒粒子的表面,是病毒的免疫显性区,针对此区域的抗体可中和TGEV和介导TGEV感染的细胞发生补体溶解反应[13]。M蛋白的氨基端6~22残基区存在一干扰素基因决定簇,可在体内外诱导α-干扰素的产生[14]。由于M基因上非常保守,为M基因作为猪传染性胃肠炎病毒分子生物学诊断侯选基因提供理论依据。本试验所用的M基因虽然与已发表基因序列有一定差异,但并未影响M蛋白免疫反应性,而且制备多抗仍具有鉴别诊断能力,能够将同源性有差异TGEV从众多猪源病毒中区分出来。由于大肠埃希氏菌表达系统具有生长周期短、外源蛋白表达量高、价格低廉等特点[15],本文采用pGEX-6P-1实现TGEV M蛋白基因的高效表达。PGEX-6P-1为大肠埃希氏菌融合表达载体,带有强tac启动子,是表达谷胱苷肽巯基转移酶(GST)高效表达载体,GST有助于表达蛋白正确立体构象,有助于可溶性蛋白表达,TGEV的M基因连接在GST下游,目的蛋白得到高效表达,表达量占菌体总蛋白21.6%[16]。原核表达系统没有翻译后的糖基化修饰过程,TGEV M蛋白是糖基化的膜蛋白,为验证M蛋白未糖基化是否影响其生物学活性,进行Western Blot分析。结果表明,表达融合蛋白能与TGEV全病毒多抗发生特异性反应,TGEV的M蛋白未糖基化不影响其免疫原性,表达融合蛋白具有与天然M蛋白一样的生物学活性。
本试验利用基因重组技术,通过PGEX-6P-1原核表达载体,在大肠杆菌表达系统建立高效表达重组TGEV-M蛋白原核表达体系,获得大量重组TGEV-M蛋白,为TGEV功能研究提供重要试验材料。将经过变性,纯化,复性的重组TGEV-M蛋白作为免疫原,皮下多点注射免疫新西兰大白兔,成功制备兔抗重组TGEV-M抗体血清。检测抗体效价可达1:262 144。Western Blot显示原核表达重组蛋白能与TGEV全病毒多抗血清发生特异性反应。说明重组蛋白具有较好生物活性。间接免疫荧光试验证明,此多抗能够与TGEV有较强特异性反应。经初步验证其效价高,特异性好,可为建立新的TGEV检测方法及深入研究M蛋白功能奠定基础。
[1]Laude H,Reeth K V,Pensaert M.Porcine respiratory coronavi⁃rus:molecular features and virus-host interactions[J].Vet Res,1993,24:125-150.
[2]Pensaert M B,Debouck P.A new coronavirus-like particle asso⁃ciated with diarrhea in swine[J].Arch Virol,1978,58(3):243-247.
[3]Sirinarumitr T,Kluge J P,Paul P S.Porcine transmissible gastro⁃enteritis virus induced apoptosis in swine testes cell cultures[J].Archives of Virology,1998,143(12):2471-2485.
[4]李建强,柳纪省,程杰,等.猪源冠状病毒TGEV中国分离株纤突蛋白生物信息学分析[J].生物技术通报,2009(4):95-98.
[5]南文金,娄高明.猪传染性胃肠炎病毒分子结构、检测和疫苗研究进展[J].畜牧与兽医,2010(12):111-114.
[6]Spaan W,Cavanagh D,Horzinek M C.Coronaviruses:structure and genome expression[J].J Gen Virol,1988,69:2939-2959.
[7]Arndt A L,Larson B J,Hogue B G.A conserved domain in the coronavirus membrane protein tail is important for virus assembly [J].J Virol,2010,84:11418-11428.
[8]乔薪瑗,李桂伟,张冠群,等.猪传染性胃肠炎M蛋白单克隆抗体制备及部分特性鉴定[J].中国预防兽医学报,2007,29(11): 874-877.
[9]张小波,左玉柱,刘媛,等.猪传染性胃肠炎病毒M蛋白的克隆及其在大肠杆菌中的表达[C].北京:中国畜牧兽医学会家畜传染病学分会第七届全国会员代表大会暨第十三次学术研讨会论文集(下册),2009.
[10]党双锁,王宏仓,贾晓黎,等.幽门螺杆菌VacA基因重组表达的包涵体复性及ELISA方法的建立[J].世界华人消化杂志,2005,13(20):2501.
[11]钱刚,冯力,刘胜旺,等.猪传染性胃肠炎病毒纤突蛋白基因的修饰及原核表达的究[J].东北农业大学学报,2005,36(5): 611-614.
[12]杨巍,李广兴,孟凡丹,等.猪流行性腹泻病毒N基因的克隆及原核表达[J].东北农业大学学报,2011,42(6):81-85.
[13]洪琴,任晓峰,李广兴.鸡痘DNA疫苗Pvax-env的构建及其体内表达[J].东北农业大学学报,2011,42(6):105-108.
[14]石娜,李广兴,任晓峰,等.猪IL-15与PRRS病毒GP5基因核酸疫苗免疫效力[J].东北农业大学学报,2010,41(1):97-102.
[15]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997: 681-688.
[16]Escors D,Laude H,Enjuanes L.The membrane M protein car⁃boxy terminus binds to transmissible gastroenteritis coronavirus core and contributes to core stability[J].J Virol,2001,75(3): 1312-1324.
[17]卢晟晔,王丽颖.大肠杆菌中外源蛋白高效表达的影响因素及策略研究的新进展[J].中国实验诊断学,2006(9):1100-1103.
[18]吴凌,李一经,武心镇.猪传染性胃肠炎病毒TH-98株M蛋白基因的克隆及原核表达[J].中国兽医科技,2005,35(11):869-874.
Expression and polyclonal antibodies preparation of porcine transmis⁃sible gastroenteritis virus M protein
REN Xiaofeng,ZOU Hao,SUN Xuejiao
(School of Veterinary Medicine,NortheastAgricultural University,Harbin 150030,China)
The aim of this study was to expressMgene of porcine transmissible gastroenteritis virus (TGEV)as well as preparation of its specific polyclonal antibodies.The amplifiedMgene was inserted into theBamH I-EcoR I site of a prokaryotic expression vector PGEX-6P-1,resulting in a recombinant plasmid PGEX-6P-1-TGEV-M followed by expression inE.colirossta.The recombinant protein was expressed in the form of inclusion bodies,which was purified and used as immunogen to generate rabbit anti-M polyclonal antibody.Indirect ELISA analysis showed that the titer of the polyclonal antibody was approximately 1∶262 144.Indect immunofluorescence showed that the polyclonal antibody could specifically bind to TGEV.The antibody could be used as a differential diadnosis reagents,distinguished TGEV from many other pig source virus.
TGEV;prokaryotic expression;antibody perparation;differential diagnosis
S853
A
1005-9369(2014)04-0083-05
2013-03-08
教育部新世纪优秀人才基金资助项目(NCET-10-0144);教育部科技研究重点项目(212038);黑龙江省普通高等学校长江学者后备支持计划;教育部高等学校博士学科点专项科研基金(博导类)(20122325110019);哈尔滨市科技创新人才研究专项资金项目(RC2012XK002003)
任晓峰(1974-),男,教授,博士,博士生导师,研究方向为预防兽医学与分子病毒学。E-mail:rxfemail@yahoo.com.cn
时间2014-4-21 13:25:02[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140421.1325.030.html
任晓峰,邹昊,孙雪娇.猪传染性胃肠炎病毒M蛋白的表达与抗体制备[J].东北农业大学学报,2014,45(4)∶83-87.
Ren Xiaofeng,Zou Hao,Sun Xuejiao.Expression and polyclonal antibodies preparation of porcine transmissible gastroenteritis virus M protein[J].Journal of Northeast Agricultural University,2014,45(4)∶83-87.(in Chinese with English abstract)

