柠檬酸处理鲜切猕猴桃在贮藏过程中抗氧化活性的变化
刘程惠,刘易伟,胡文忠*,姜爱丽,郭雯倩
(大连民族学院生命科学学院,辽宁 大连 116600)
柠檬酸处理鲜切猕猴桃在贮藏过程中抗氧化活性的变化
刘程惠,刘易伟,胡文忠*,姜爱丽,郭雯倩
(大连民族学院生命科学学院,辽宁 大连 116600)
研究0.1、0.2、0.3 g/100 mL柠檬酸处理的鲜切猕猴桃在10 ℃贮藏10 d内抗氧化活性的变化。结果表明:鲜切猕猴桃在贮藏期间抗氧化能力呈现下降的趋势,前期变化缓慢,后期下降趋势明显;同时,通过样品抗氧化能力指标的测定可知,经过柠檬酸处理的鲜切猕猴桃抗氧化能力变化比未经过处理的鲜切猕猴桃抗氧化能力变化缓慢,说明柠檬酸处理在贮藏过程中能更好的维持鲜切猕猴桃的抗氧化活性。
鲜切猕猴桃;柠檬酸;抗氧化活性
猕猴桃果实多汁,果肉质地细嫩,气味清香,风味独特,猕猴桃以其含有丰富的抗氧化活性物质,特别是在水果中名列前茅的VC含量,成为颇受关注的抗氧化水果之一[1-3]。鲜切猕猴桃经过去皮、切分等加工后,原有的保护层被破坏,在贮藏期间果实内抗氧化物质的含量和活性会受到影响,因此常利用低温贮藏[4-5]、保鲜剂处理[6-8]鲜切果蔬,以达到维持鲜切果蔬的品质和营养活性物质的目的。目前,关于鲜切猕猴桃在贮藏期间抗氧化活性物质及自身抗氧化能力变化的相关研究,仍未见报道。本实验针对这一问题以陕西猕猴桃为原料,研究在贮藏期间,鲜切猕猴桃中几种与抗氧化有关的活性物质及其抗氧化能力的变化,为鲜切猕猴桃的加工、保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
猕猴桃,产地陕西,以成熟可食用但还未变软的新鲜猕猴桃作为样品。
95%乙醇、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)、二硫苏糖醇(dithiothreitol,DTT)均为国产分析纯;愈创木酚、乙二酸四乙酸(ethylene diamine tetraacetic acid,EDTA)均为国产优级纯;抗坏血酸(分析纯) 美国Sigma公司。
1.2 仪器与设备
UV-2100型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;T25基本型高剪切分散匀浆机 德国IKA工业设备公司;TDL-60B离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 原料处理
原料清洗去皮并切成厚7 mm片状,用0(空白对照)、0.1、0.2、0.3 g/100 mL柠檬酸浸泡5 min,沥干后用保鲜盒包装,放入10 ℃冷藏备用。对相关指标进行测定,每个样品重复3次,求平均值,并进行差异显著分析。
1.3.2 DPPH自由基清除率的测定
根据Saxena等[9]和Alothman等[10]的方法并作修改。称取5 g猕猴桃,加入15 mL去离子水,在冰浴条件下匀浆完全后,于4 ℃、10 000×g离心30 min,收集上清液作为测试样液。2 mL样液和2 mL 0.1 mmol/L的DPPH于517 nm波长处测定各管的吸光度(A),用2 mL去离子水代替样液作为空白。对DPPH自由基的清除率用下式表示:
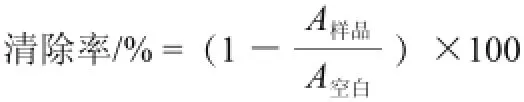
1.3.3 总酚的测定方法
根据王艳颖等[11]的方法并作修改。称取2 g猕猴桃,加入10 mL经预冷的1%(V/V) HCl-甲醇溶液,在冰浴条件下匀浆后,转入20.0 mL刻度试管中,用1%(V/V)HCl-甲醇溶液定容至刻度,混匀,于4 ℃ 避光提取20 min,期间摇动数次,然后过滤,收集滤液待用。以1%(V/V)HCl-甲醇溶液作空白参比调零,取滤液于280 nm波长处测定其吸光度,酚类含量以A280/g表示。
1.3.4 过氧化氢酶(catalase,CAT)活性的测定方法
根据Meng Xiangyong等[12]和Zhang Xiaona等[13]的方法并作修改。称取5 g猕猴桃样品,置于匀浆管中,加入10 mL提取缓冲液,在冰浴条件下匀浆完全,于4 ℃、10 000×g离心30 min,收集上清液,即为粗酶提取液,低温保存备用。酶促反应体系由2.9 mL 20 mmol/L H2O2溶液和0.1 mL酶液组成。以蒸馏水为参比空白,在反应体系混合时开始记录反应体系在240 nm波长处吸光度,作为初始值,然后每隔30s记录一次,连续测定,至少获取6个点的数据。以鲜质量每克样品的酶活性表示0.01ΔA240/(min·g)。
1.3.5 羟自由基清除率的测定方法
根据谢海玉等[14]的方法并作修改。精确称取5 g猕猴桃,加入5 mL去离子水,在冰浴条件下匀浆完全后,于4 ℃、10 000×g离心20 min,收集上清液,即为测定提取液,低温保存备用。测定组为1 mL 0.075 mol/L邻二氮菲、2 mL磷酸缓冲液(pH 7.4)、1 mL去离子水,摇匀后分别加入酶液、0.75 mol/L硫酸盐铁、0.01 g/100 mL H2O2溶液各1 mL,于536 nm波长处分别测定其他各管的吸光度。用磷酸缓冲液代替酶液作为调零管,代替H2O2溶液作为对照管。
1.3.6 抗坏血酸过氧化物酶(ascobate peroxidase,APX)活性的测定方法
根据An Jianshen等[15]和Luo Haibo等[16]的方法并作修改。称取5 g猕猴桃,加入10 mL经4 ℃预冷的提取缓冲液,在冰浴条件下匀浆完全后,于4 ℃、10 000×g离心30 min,收集上清液,即为酶液,低温保存备用。向试管中依次加入2.6 mL反应缓冲液和0.1 mL酶提取液,最后加入0.3 mL 2 mmol/L H2O2溶液启动酶促反应,立即混匀,并开始计时。从启动后开始记录反应体系在290 nm波长处的吸光度,每隔30 s记录一次,连续测定,至少获取6个点的数据。以蒸馏水为参比对分光光度计进行调零。以鲜质量每克样品的酶活性表示为0.01ΔA290nm/(min·g)。
1.3.7 VC含量的测定方法
按照张宪政等[17]的方法测定。
1.3.8 还原力的测定方法
参照Soong等[18]的方法并做改进。称取5 g猕猴桃,加入10 mL去离子水,在冰浴条件下匀浆完全后,于4 ℃、10 000×g离心20 min,收集上清液,即为酶液,低温保存备用。0.5 mL样液中分别加入2.5 mL 0.2 mol/L、pH 6.6磷酸缓冲液、2.5 mL 1 g/100 mL铁氰化钾溶液,混匀后50 ℃水浴平衡20 min,加入2.5 mL 10 g/100 mL三氯乙酸溶液,振荡摇匀,离心(4 ℃,4 000×g)10 min,取2.5 mL上清液加入2.5 mL去离子水和0.5 mL 0.1 g/100 mL氯化铁溶液,静置10 min后,于700 nm波长处分测定吸光度。
1.3.9 超氧化物歧化酶(superoxide dismutase,SOD)活性的测定方法
根据Yang Zhenfeng等[19]和Luo Haibo等[16]的方法并作修改。精确称取5 g猕猴桃,加入5 mL提取缓冲液,在冰浴条件下匀浆,离心(4 ℃、10 000×g)30 min,收集上清液,即为酶提取液,低温保存备用。在试管中分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、130 mmol/L甲硫氨酸、750 μmol/L NBT、100 μmol/L EDTA-Na2各0.3 mL。摇匀后分别加入0.3 mL 20 μmol/L核黄素,样品测定加入0.1 mL酶液。用磷酸缓冲液代替酶液的作为调零管。混匀后,取1支对照管置于暗处,其他各管置于阳光下反应30 min后立即置于暗处终止反应。以不照光管做空白参比调零,于560 nm波长处分别测定其他各管的吸光度。以鲜质量每克样品的酶活性表示为0.5ΔA560/(min·g)。
2 结果与分析
2.1 鲜切猕猴桃在贮藏过程中DPPH自由基清除率的变化
DPPH自由基在有机溶剂中是一种稳定的自由基,具有强氧化性,可损害机体的组织和细胞。DPPH自由基与鲜切果蔬的抗氧化活性关系紧密,其在鲜切果蔬贮藏过程中的变化,能在一定程度上反应出鲜切果蔬总抗氧化能力的变化[20]。如图1所示,在整个贮藏期间,3种质量浓度柠檬酸处理的鲜切猕猴桃清除DPPH自由基的能力在前4 d均下降较小,后6 d变化不大,对DPPH自由基的清除率效果相差不大,0.1 g/100 mL处理的鲜切猕猴桃DPPH自由基清除率基本保持较高水平,较优于其他处理组,说明0.1 g/100 mL柠檬酸处理的鲜切猕猴桃能较好的保持DPPH自由基的清除能力。
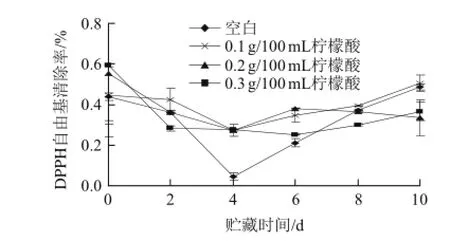
图1 不同质量浓度柠檬酸处理对鲜切猕猴桃DPPH自由基清除速率的影响Fig.1 Effect of treatments with different concentrations of citric acid on the DPPH radical scavenging capacity of fresh-cut kiwifruit
2.2 鲜切猕猴桃在贮藏过程中总酚含量变化
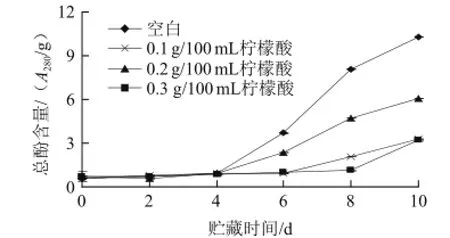
图2 不同质量浓度柠檬酸处理对鲜切猕猴桃总酚含量的影响Fig.2 Effect of treatments with different concentrations of citric acid on the total phenolic content in fresh-cut kiwifruit
如图2所示,4种样品的总酚含量在前4 d基本没有变化,4 d空白样品和0.2 g/100 mL柠檬酸处理的样品总酚含量开始增加,6 d时,0.1、0.2 g/100 mL柠檬酸处理的样品总酚含量开始增加,而到了8 d,0.3 g/100 mL柠檬酸处理的样品总酚含量才开始增加。酚类不仅导致果蔬的褐变,还与果蔬的成熟衰老有关,果蔬受到切割等伤害后,在酚类的代谢途径中,刺激了更多酚类物质的合成,从而导致了总酚的增加。第6天后,空白组与0.1、0.3 g/100 mL柠檬酸处理样品间的差异均达到显著差异(P<0.05)。可见,柠檬酸处理有利于鲜切猕猴桃减缓总酚含量的增加,能有效减缓鲜切猕猴桃的衰老,其中0.3 g/100 mL柠檬酸的抑制总酚增加的效果最佳。
2.3 鲜切猕猴桃在贮藏过程中CAT活性的变化
CAT属于血红蛋白酶,它能催化植物体内积累的过氧化氢分解为水和分子氧,从而减少H2O2对果蔬组织可能造成的氧化伤害。如图3所示,鲜切猕猴桃中CAT的活性在2~4 d骤降,4~10 d期间基本没变化,4组样品总体变化趋势基本相同,说明柠檬酸处理对延缓鲜切猕猴桃的CAT活性的下降无明显作用。

图3 不同质量 浓度柠檬酸处理对鲜切猕猴桃CAT活性的影响Fig.3 Effect of treatments with different concentrations of citric acid on the CAT activity in fresh-cut kiwifruit
2.4 鲜切猕猴桃在贮藏过程中羟自由基清除率的变化

图4 不同质量浓度柠檬酸处理对鲜切猕猴桃羟自由基清除率的影响Fig.4 Effect of treatments with different concentrations of citric acid on the hydroxyl radical scavenging capacity of fresh-cut kiwifruit
如图4所示,在贮藏期间4组鲜切猕猴桃的羟自由基清除率相近,整体呈下降趋势,但变化趋势并不明显。可见,柠檬酸作为保鲜剂对羟自由基清除率几乎没有影响。羟自由基主要由H2O2产生,CAT等酶是主要清除该类羟自由基的酶类,可能由于空白和各处理组CAT活性的变化不明显(图3),导致了各组样品的羟自由基的清除率没有太大的区别。
2.5 鲜切猕猴桃在贮藏过程中APX活性的变化

图5 不同质量浓度柠檬酸处理对鲜切猕猴桃APX活性变化的影响Fig.5 Effect of treatments with different concentrations of citric acid on the APX activity in fresh-cut kiwifruit
APX是催化抗坏血酸与过氧化氢发生氧化-还原反应系统的关键酶,利用抗坏血酸作为电子供体也过氧化物反应,用以清除过氧化氢。在鲜切猕猴桃的贮藏期间,猕猴桃受到切割等伤害,激发了自身的保护机制,增强了清除过氧化氢的作用,造成APX活性的增加,并且在清除过氧化氢的过程中,利用了抗坏血酸,从而可能会导致抗坏血酸含量的减少[21]。由图5可知,4种处理鲜切猕猴桃样品APX的活性随时间的延长总体呈现上升趋势。空白样品在第6天开始迅速上升,0.2 g/100 mL柠檬酸处理的样品APX活性上升最为缓慢,效果最佳。说明柠檬酸的处理有益于延长鲜切猕猴桃抗氧化能力,减缓APX活性的暴发。
2.6 鲜切猕猴桃在贮藏过程中VC含量的变化

图6 不同质量浓度柠檬酸处理对鲜切猕猴桃VC含量变化的影响Fig.6 Effect of treatments with different concentrations of citric acid on the VC content in fresh-cut kiwifruit
测定并计算得标准曲线公式:y=0.000 7 x+0.000 4,R2=0.999 8。通过标准曲线可得样品VC含量的变化,如图6所示,在贮藏期间VC含量变化总体呈下降趋势,VC是果蔬中重要的具有抗氧化活性的物质[22],随着果蔬的衰老,抗坏血酸过氧化物酶含量增加,抗坏血酸的含量会逐渐降低,但经过柠檬酸处理的样品的VC含量变化较为缓慢,其原因也可能是因为柠檬酸能较好地抑制APX的活性(图5),减缓了VC含量的降低,与APX的活性变化一致。由图6可见,鲜切猕猴桃经0.2 g/100 mL柠檬酸处理,能更有效的减缓VC含量的下降。
2.7 鲜切猕猴桃在贮藏过程中还原力的变化

图7 不同质量浓度柠檬酸处理对鲜切猕猴桃还原力变化的影响Fig.7 Effect of treatments with different concentrations of citric acid on the reducing power of fresh-cut kiwifruit
如图7所示,鲜切猕猴桃在贮藏前期还原力整体呈先上升趋势,在第6天达到最大值,然后开始下降,第6天时,空白组明显高于处理组,且空白组与0.1 g/100 mL柠檬酸处理达显著差异(P<0.05),可见0.1 g/100 mL柠檬酸处理的样品还原力能更好的维持鲜切猕猴桃的还原力下降趋势。由VC含量的降低(图6)可知,还原力的变化不仅与VC有关,还可能与其他的抗氧化物质的活性有关。经过柠檬酸处理的鲜切猕猴桃对还原能力维持更有效,且经过0.1 g/100 mL柠檬酸处理的鲜切猕猴桃还原能力变化最小。
2.8 鲜切猕猴桃在贮藏过程中SOD活性的变化

图8 不同质量浓度柠檬酸处理对鲜切猕猴桃SOD活性变化的影响Fig.8 Effect of treatments with different concentrations of citric acid on the SOD activity in kiwifruit
SOD能够与CAT等酶共同作用有效清除超氧阴离子等自由基,从而清除果蔬中的活性氧对细胞膜系统的伤害,减少了自由基对有机体的伤害。SOD是一种抗性酶,在果蔬受到切割伤害后,会随着机体受到刺激而上升。如图8所示,在贮藏期间,空白样品和0.2 g/100 mL柠檬酸处理的样品开始都有上升的趋势,第6天后,所有样品的SOD的活性都开始下降,空白组的SOD活性相对处理组反而能够较好的保持,其中0.2、0.3 g/100 mL柠檬酸处理组与空白组达到显著差异(P<0.05),说明柠檬酸处理可能并不能有效的保持鲜切猕猴桃的SOD活性。
3 讨论与结论
果蔬经过了去皮、切割等处理,使果蔬中活性氧的暴发,加速了膜脂的过氧化,从而导致了果蔬的氧化伤害,同时果蔬的抗氧化能力的下降,自由基清除率的下降,加速了果蔬衰老。经过柠檬酸的处理,可以有效的减轻和抑制鲜切果蔬的抗氧化活性的变化,能够较好的保持鲜切果蔬的品质。由实验结果可看出,鲜切猕猴桃在贮藏期间的抗氧化能力受到多种酶的共同作用,柠檬酸处理能对很多抗性酶起到保护作用,能有效延缓果蔬的衰老;同时,经过柠檬酸处理的鲜切猕猴桃抗氧化能力变化比未经过处理的鲜切猕猴桃抗氧化能力变化缓慢,自由基的清除能力更强,特别是对APX、VC和总酚等活性物质维持效果显著,不同质量浓度的柠檬酸处理效果相比,低质量浓度0.1、0.2 g/100 mL柠檬酸处理效果更好。所以柠檬酸处理后有利于维持鲜切猕猴桃抗氧化物质的活性和品质,更能有效地延长鲜切猕猴桃的货架期。
[1] 杨丹, 曾凯芳. 猕猴桃果实抗氧化活性物质及其在贮藏中的变化[J].食品工业科技, 2010, 31(8): 393-395.
[2] PARK Y S, IM M H, HAM K S, et al. Nutritional and pharmaceutical properties of bioactive compounds in organic and conventional growing kiwifruit[J]. Plant Foods for Human Nutrition, 2013, 68: 57-64.
[3] PARK Y S, JUNG S T, KANG S G, et al. Effect of ethylene treatment on kiwifruit bioactivity[J]. Plant Foods for Human Nutrition, 2006, 61(3): 151-156.
[4] ARTÉS-HERNÁNDEZ F, RIVERA-CABRERA F, KADER A A. Quality retention and potential shelf-life of fresh-cut lemons as affected by cut type and temperature[J]. Postharvest Biology and Technology, 2007, 43(2): 245-254.
[5] KECHINSKI C P, MONTERO C R S, GUIMARÃES P V R, et al. Effects of ozonized water and heat treatment on the papaya fruit epidermis[J]. Food and Bioproducts Processing, 2012, 90(2): 118-122.
[6] HU W, JIANG A, TIAN M, et al. Effect of ethanol treatment on physiological and quality attributes of fresh-cut eggplant[J]. Journal of the Science of Food and Agriculture, 2010, 90(8): 1323-1326.
[7] ALANDES L, PÉREZ-MUNUERA I, LLORCA E, et al. Use of calcium lactate to improve structure of “Flor de Invierno” fresh-cut pears[J]. Postharvest Biology and Technology, 2009, 53(3): 145-151.
[8] 胡文忠, 姜爱丽, 杨宏, 等. 茉莉酸甲酯对鲜切苹果生理生化变化的影响 [J]. 食品工业科技, 2012, 33(16): 338-346.
[9] SAXENA A, BAWA A S, RAJU P S. Phytochemical changes in fresh-cut jackfruit (Artocarpus heterophyllus) bulbs during modified atmosphere storage[J]. Food Chemistry, 2009, 115(4): 1443-1449.
[10] ALOTHMAN M, KAUR B, FAZILAH A, et al. Ozone-induced changes of antioxidant capacity of fresh-cut tropical fruits[J]. Innovative Food Science & Emerging Technologies, 2010, 11(4): 666-671.
[11] 王艳颖, 胡文忠, 刘程惠. 间歇升温对采后香蕉李贮藏中酶促褐变的影响[J]. 食品科学, 2010, 31(2): 245-249.
[12] MENG X, ZHANG M, ADHIKARI B. Extending shelf-life of freshcut green peppers using pressurized argon treatment[J]. Postharvest Biology and Technology, 2012, 71: 13-20.
[13] ZHANG X, ZHANG Z, WANG L, et al. Impact of ozone on quality of strawberry during cold storage[J]. Frontiers of Agriculture in China, 2011, 5(3): 356-360.
[14] 谢海玉, 纪银莉, 高维东, 等. 邻二氮菲-Fe2+法测定牦牛乳酪蛋白酶解产物的抗氧化性[J]. 食品与发酵工业, 2012, 38(11): 175-178.
[15] AN Jianshen, ZHANG Min, LU Qirui. Changes in some quality indexes in fresh-cut green asparagus pretreated with aqueous ozone and subsequent modified atmosphere packaging[J]. Journal of Food Engineering, 2007, 78(1): 340-344.
[16] LUO Haibo, JIANG Li, ZHANG Li, et al. Quality changes of whole and fresh-cut Zizania latifolia during refrigerated (1 ℃) storage[J]. Food and Bioprocess Technology, 2012, 5(4): 1411-1415.
[17] 张宪政. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社, 1994: 161-163.
[18] SOONG Y Y, BARLOW P J. Antioxidant activity and phenolic content of selected fruit seeds[J]. Food Chemistry, 2004, 88(3): 411-417.
[19] YANG Zhenfeng, ZHENG Yonghua, CAO Shifeng. Effect of high oxygen atmosphere storage on quality, antioxidant enzymes, and DPPH-radical scavenging activity of Chinese bayberry fruit[J]. Journal of Agricultural and Food Chemistry, 2008, 57(1): 176-181.
[20] KANG H M, SALTVEIT M E. Antioxidant capacity of lettuce leaf tissue increases after wounding[J]. Journal of Agricultural and Food Chemistry, 2002, 50(26): 7536-7541.
[21] LIM S, KIM Y H, KIM S H, et al. Enhanced tolerance of transgenic sweet potato plants that express both CuZnSOD and APX in chloroplasts to methyl viologen-mediated oxidative stress and chilling[J]. Molecular Breeding, 2007, 19(3): 227-239.
[22] CHUNG H S, MOON K D. Browning characteristics of fresh-cut‘Tsugaru’ apples as affected by pre-slicing storage atmospheres[J]. Food Chemistry, 2009, 114(4): 1433-1437.
Changes in Antioxidant Properties and Antioxidant Compounds of Fresh-Cut Kiwifruit Treated with Citric Acid during Storage
LIU Cheng-hui, LIU Yi-wei, HU Wen-zhong*, JIANG Ai-li, GUO Wen-qian
(College of Life Science, Dalian Nationalities University, Dalian 116600, China)
The objective of this study was to investigate the changes in antioxidant activity and bioactive compounds in fresh-cut kiwifruit slices treated with 0.1, 0.2 or 0.3 g/100 mL citric acid in water during 10 days of storage at 10 ℃. Results showed that during the storage period, antioxidant capacity of fresh-cut kiwi fruit displayed a declining trend, slowly initially and then rapidly. At the same time, citric acid-treated kiwifruit slices exhibited a slow change in antioxidant properties than untreated samples. This study suggests that the antioxidant activity of fresh-cut kiwifruit can be well maintained during storage by citric acid pretreatment.
fresh-cut kiwi fruit; citric acid; antioxidant activity
TS255.36
A
1002-6630(2014)02-0292-05
10.7506/spkx1002-6630-201402057
2013-05-06
“十二五”国家科技支撑计划项目(2012BAD38B05);国家自然科学基金面上项目(30972038);中央高校基本科研业务费专项(DC12010302)
刘程惠(1979—),女,工程师,博士研究生,研究方向为食品科学。E-mail:liuchenghui@dlnu.edu.cn
*通信作者:胡文忠(1959—),男,教授,博士,研究方向为食品科学。E-mail:hwz@dlnu.edu.cn

