雷尼酸锶联合强骨胶囊对大鼠骨质疏松性骨折骨愈合影响的实验研究*
黄圣良 程玉兰 马翰斐
雷尼酸锶联合强骨胶囊对大鼠骨质疏松性骨折骨愈合影响的实验研究*
黄圣良①程玉兰①马翰斐①
目的:通过观察雷尼酸锶联合强骨胶囊对骨质疏松性骨折愈合的影响,以探讨中西医结合治疗骨质疏松性骨折的意义。方法:30只SD大鼠给予维甲酸灌胃,制造骨质疏松性骨折模型成功后,按随机数字表分为实验组和对照组,每组15只。实验组给予雷尼酸锶联合强骨胶囊灌胃,对照组给予生理盐水灌胃,于2周、4周和6周处死实验鼠,进行骨痂大小的测量及组织学研究。结果:2周时两组骨痂大小比较差异无统计学意义(P>0.05);4周时实验组骨痂大小较对照组小,差异有统计学意义(P<0.05);6周时实验组骨痂大小明显小于对照组,差异有统计学意义(P<0.01)。2周时组织学检测发现,实验组成骨细胞数目较对照组无明显增多;4周及6周时则明显增多。结论:雷尼酸锶联合强骨胶囊治疗维甲酸所致大鼠骨质疏松性骨折疗效显著。
骨质疏松; 大鼠; 骨折愈合; 雷尼酸锶; 强骨胶囊
骨质疏松症(osteoporosis)是一种以单位体积内骨量减少、骨小梁数目减少、骨皮质变薄、骨组织微细结构破坏、骨髓腔增宽、骨脆性增加及骨折危险几率增加为特征的骨骼综合性疾病。骨折是骨质疏松症最严重后果,且发生骨折后相较正常愈合缓慢。强骨胶囊和雷尼酸锶是临床治疗骨质疏松的常用中药和西药,两药合用能否更促进骨质疏松性骨折愈合,国内外少有报道。本研究通过建立SD大鼠骨质疏松性骨折的模型,观察雷尼酸锶联合强骨胶囊对骨质疏松性骨折愈合的影响,探讨中西药结合治疗骨质疏松性骨折的意义。
1 材料与方法
1.1 实验动物 选择5个月龄雌性SD大鼠30只,体质量215~235 g。
1.2 方法
1.2.1 骨质疏松模型的制作 对30只未交配过的健康成年雌性SD大鼠进行造模,给予维甲酸80 mg/(kg·d)灌胃,共15 d。将30只骨质疏松造型成功的SD大鼠按随机数字表法分为实验组和对照组,每组各15只。
1.2.2 SD大鼠骨质疏松性骨折模型的建立 确定骨质疏松SD大鼠模型建立成功后,两组SD大鼠用同样的方法进行腹腔注射麻醉,麻醉效果满意后,在无菌条件下,随机选一侧股骨,暴露股骨干,在股骨中段行横行截骨,制作横行骨折模型,然后通过成人掌指骨微型接骨板内固定,固定效果良好后,逐层缝合包扎伤口。术后给予腹腔内注射抗生素,预防感染,然后将SD大鼠放回饲养笼中,自由活动,常规饲养。
1.2.3 给药方法和剂量 自骨质疏松性骨折后第1天开始,实验组每只SD大鼠按雷尼酸锶400 mg/(kg·d)+强骨胶囊90 mg/(kg·d)灌胃;对照组给予同体积生理盐水灌胃,共6周。
1.2.4 骨痂大小测量 通过PACS采集系统对骨痂大小进行测量,对患侧股骨骨痂最宽处及相应健侧股骨同一水平骨干宽度进行测量。用患侧宽度数据除以健侧宽度数据,得到相对数。用宽度的相对数进行统计学分析。
1.2.5 病理组织学检查 分别于2、4、6周对实验SD大鼠用腹腔内注射水合氯醛8 mL/kg的方法处死,解剖分离出股骨,立即用甲醛溶液(pH=7.4)浸泡并固定;24 h后取出用10%EDTA(pH=7.4)脱钙液浸泡并持续脱钙3~5周;10%EDTA(pH=7.4)脱钙液每5~7天进行更换,用针刺检测脱钙效果满意后,乙醇梯度脱水,石蜡包埋,连续切5 μm片,HE常规染色,Nikon E700型显微镜下观察。
1.3 统计学处理 采用SAS 9.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用t检验方法,以P<0.05为差异有统计学意义。
2 结果
2.1 两组骨质疏松模型BMC值比较 对照组BMC平均值为(0.1286±0.0034)g/cm2,实验组为(0.1194±0.0040)g/cm2,差异有统计学意义(P=0.026),维甲酸SD大鼠骨质疏松制造模型成功。
2.2 两组影像学分析 根据X线片观察可见实验组相比对照组骨痂形成较小,4周时未发现骨折线,骨痂开始塑形,骨髓腔已经开始贯通;6周时骨折愈合,骨折端骨髓腔完全贯通,骨痂塑形已经接近完成。对照组在4、6周时,骨折端仍清晰可见;且4周时,对照组骨折线较实验组清晰,骨痂较实验组肥大,见图1~4。

图1 对照组X线片(4周)

图2 实验组X线片(4周)
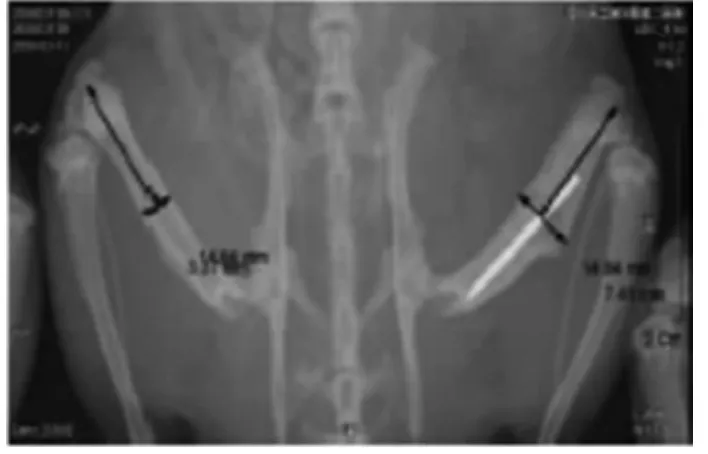
图3 对照组X线片(6周)
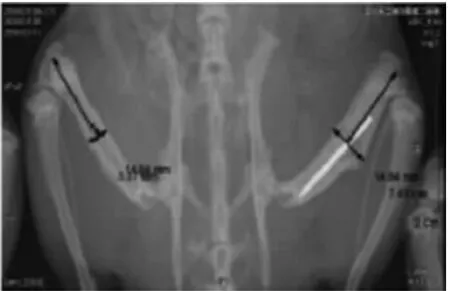
图4 实验组X线片(6周)
2.3 两组骨痂大小相对数的比较 2周时两组骨痂大小相对数比较差异无统计学意义(P>0.05);4周时实验组骨痂大小相对数较对照组小,差异有统计学意义(P<0.05);6周实验组骨痂大小相对数明显小于对照组,差异有统计学意义(P<0.01),见表1。
表1 两组骨痂大小相对数的比较(±s)

表1 两组骨痂大小相对数的比较(±s)
组别 2周 4周 6周实验组(n=15) 2.31±0.12 2.65±0.27 2.12±0.11对照组(n=15) 2.32±0.14 2.98±0.31 2.65±0.22
2.4 病理组织学检查 2周时组织学检测发现,实验组成骨细胞数目较对照组无明显增多;4周及6周时实验组成骨细胞数目较对照组明显增多,见图5~6。
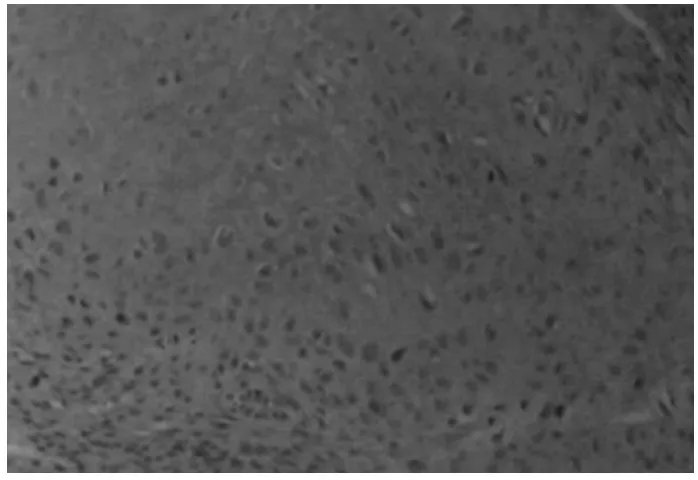
图5 对照组病理组织学图像(4周)
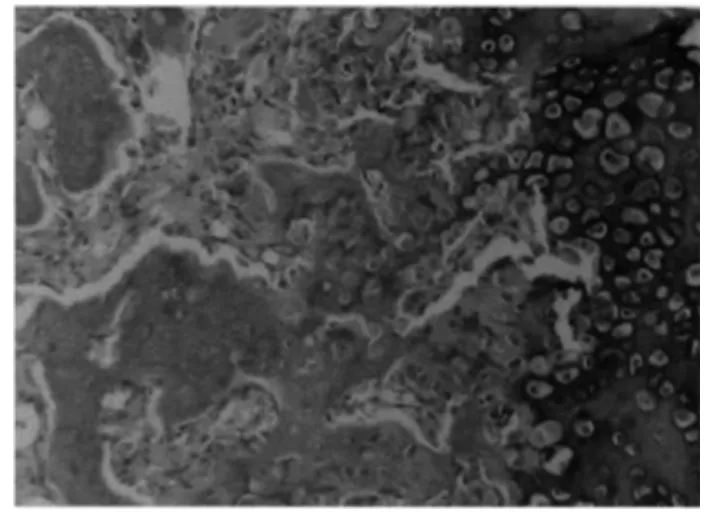
图6 实验组病理组织学图像(4周)
3 讨论
骨折愈合是破骨细胞和成骨细胞联合作用的结果,早期破骨细胞可以清除死骨,中晚期破骨细胞使骨痂上形成陷窝,成骨细胞附着在陷窝上,随后成骨细胞可产生新的骨单位,如此完成骨痂塑形过程。
雷尼酸锶是具有双重作用的新型的抗骨质疏松药。与其他药物不同,雷尼酸锶可诱导骨重建及解偶联,具有刺激骨形成、抑制骨吸收的双重作用,能增加骨的密度及强度,但对骨基质的矿化无影响,不改变骨的晶体结构,从而有效降低骨折风险。雷尼酸锶调控骨量的机制还不是很清楚,但可能是通过钙敏感受体发挥作用,一方面,雷尼酸锶通过钙敏感受体,促进I型胶原的合成和加速骨基质矿化,促进前成骨细胞增殖及向成骨细胞分化;另一方面,通过钙敏感受体抑制破骨前体细胞分化、成熟及促进破骨细胞凋亡,从而降低破骨细胞活性,降低骨骼的吸收。在体外,雷尼酸锶可通过增加OPG/RANK比值浓度的依赖性,上调成骨细胞的表达,从而达到抑制骨吸收和促进骨形成的双重效果[1]。有研究发现钙敏感受体敲出可以使雷尼酸锶对OPG和RANK的效应消失,故考虑在雷尼酸锶对OPG/RANK/RANKL系统影响中,钙敏感受体起介导作用[2]。锶可通过钙敏感受体介导,激活磷脂酶c和核转录因子KB,促进成熟破骨细胞的凋亡,与钙有所不同的是锶诱导破骨细胞凋亡与PKCβⅡ的活化相关,不依赖于三磷酸肌醇[3]。由于锶和钙发挥作用的细胞内信号通道不完全相同,两者联合使用可共同促进成熟破骨细胞凋亡。此外,雷尼酸锶可增加钙敏感受体基因敲除小鼠成骨细胞数量,小鼠的成骨细胞可能含有不同于钙敏感受体的其他阳离子感应受体,提示雷尼酸锶通过不仅仅通过钙敏感受体起作用,而是可以通过不同的信号通路影响破骨细胞、成骨细胞发挥不同功能[4]。有研究发现锶可减少原代培养的成骨细胞硬骨素表达,从而通过影响wnt信号通路促进骨形成,还可以抑制氧化应激从而发挥抗骨质疏松的作用[5-6]。有研究发现,用雷尼酸锶处理从小鼠颅骨细胞分离出原代成骨细胞可使骨钙化结节浓度增加,能促进从骨祖细胞到成熟骨细胞等不同阶段的成骨细胞分化成熟,表现为ALP、骨钙素和骨唾液酸蛋白等成骨细胞标志物表达增加[7]。锶还可增加骨形态发生蛋白-7(BMP-7)的表达,诱导骨髓间充质干细胞向成骨细胞分化。除成骨细胞作用外,雷尼酸锶可使破骨细胞数量减少和Trap活性降低,促进破骨细胞凋亡,抑制破骨细胞分化。有研究证实雷尼酸锶在预防脊柱骨折和非脊柱骨折(包括髋部骨折)方面均有效[8]。
强骨胶囊主要有效成分为骨碎补(Drynariae rhizoma),骨碎补是骨伤科最常用中药,具有续伤、止痛、补肾强骨等作用,临床上常用于治疗各种骨关节炎和骨质疏松症等[9]。骨碎补含有总黄酮和柚皮苷物质,总黄酮可明显减轻骨质疏松症导致的骨密度下降,柚皮苷物质可改善动物脂质代谢。体外骨细胞培养发现,骨碎补总黄酮能促进成骨细胞的增殖和活性,提高骨密度,增加骨形成,维持骨超微结构的完整[10]。有研究发现,强骨胶囊可以明显缓解骨质疏松症患者的骨痛症状,应用强骨胶囊治疗两个疗程后提高骨密度平均值6.2%,血清碱性磷酸酶、钙水平也明显增加[11-13]。此外,骨碎补总黄酮具有抑制炎症反应的作用,可抑制巨噬细胞分泌各种细胞因子。含骨碎补总黄酮血清在肿瘤坏死因子ɑ介导的炎症环境下可减少成骨细胞凋亡及诱导成骨细胞增殖[14]。韩国Jeong等[15-16]研究也证实,骨碎补具有抑制破骨细胞功能的作用,以及促进成骨前体细胞增殖、分化及成熟的作用。
本实验从影像学分析发现,4周时实验组骨痂小于对照组(P<0.05),骨折线模糊,6周时实验组骨痂明显小于对照组(P<0.05),表明雷尼酸锶联合强骨胶囊治疗大鼠骨质疏松性骨折的愈合情况明显好于对照组。组织学检测也显示雷尼酸锶联合强骨胶囊组成骨细胞较多,破骨细胞数量较少,有利于骨折愈合。
综上所述,笔者认为骨质疏松性骨折早期可使用雷尼酸锶联合强骨胶囊以促进骨折愈合,方法简单实用,值得临床应用。
[1] Atkins G J,Welldon K J,Halbout P.et a1.Strontium ranelate treatment of human primary osteoblasts promotes an osteocyte-like phenotype while eliciting an osteoprotegerin response[J].Osteoporos Int,2009,20(4):653-664.
[2] Brennan T C,Rybchyn M S,Green W,et a1.Osteoblasts play key roles in the mechanisms of action of strontium ranelate[J].Br J Pharmacol,2009,157(7):1291-1300.
[3] Saidak Z,Hay E,Marty C,et a1.Strontium ranelate rebalances bone marrow adipogenesis and osteoblastogenesis in senescent osteopenic mice through NFATc/Maf and wnt signaling[J].Aging Cell,2012,11(3):467-474.
[4] Liu C,WaIter T S,Huang P,et al.Structural and functional insights of RANKL—RANK interaction and signaling[J].J Immunol,2010,184(12):6910-6919.
[5] Rybchyn M S,Slater M,Conigrave A D,et a1.An Ak-dependent increase in canonical Wnt signaling and a decrease in sclerostin protein levels are involved in strontium ranelate-induced osteogenic effects in human osteoblasts[J].J Biol Chem,2011,286(27):2377l-23779.
[6] Yalin S,Sagir O,Comelekoglu U,et al.Strontium ranelate treatment improves oxidative damage in osteoporotic rat model [J].Phamacol Rep,2012,64(2):396-402.
[7] BonneIye E,Chabadel A,SaItel F,et al.Dual effect of strontium ranelate:stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro[J].Bone,2008,42(1):129-138.
[8] Choudhary S,Halhout P,Alander C,et a1.Strontium ranelate promotm osteoblastic differentiation and mineralization of routine bone marrow sternal cells:involvement of prosta andins[J].J Bone Miner Res,2007,22(7):1002-1010.
[9]沈丕安,中药药理与临床运用[M].北京:人民卫生出版社,2006:189-190.
[10]谢雁鸣,秦林林,邓文龙,等.骨碎补总黄酮对成骨细胞体外培养作用的机制研究[J].中华中医药杂志,2005,20(3):161-162.
[11]何正国.强骨胶囊治疗I型原发性骨质疏松症临床研究[J].中华临床医药杂志,2003,4(21):16-17.
[12] Chang C L,Lin C S,Lai G H.Phytochemical characteristics, free radical scavenging activities, and neuroprotection of five medicinal plant extracts[J].Evid Based Complement Alternat Med,2012,20(12):984295.
[13] Whiteside L A.Surgical technique: transfer of the anterior portion of the gluteus maximus muscle for abductor deficiency of the hip[J].Clin Orthop Relat Res,2012,470(2):503-510.
[14]黄志明,欧阳桂林,肖涟波,等.骨碎补总黄酮在肿瘤坏死因子α介导下对成骨细胞凋亡的影响[J].中西医结合学报,2011,9(2):173-178.
[15] Jeong J C,Kang S K,Youn C H,et al.Inhibition of drynariae rhizome extracts on bone resorption mediated by processing of cathepsin kin cultured mouse osteoclasts[J].Int Immunopharmacol,2003,3(12):1685-1697.
[16] Jeong J C,Lee J W,Yoon C H,et al.Stimulative effects of drynariaerhizoma extracts on the proliferation and differentiation of osteoblastic mc3t3-e1 cells[J].J Ethnopharmacol,2005,96(3):489-495.
Effect of Strontium Ranelate Combined with Qianggu Capsule on Fracture Healing in Rats Osteoporotic Model
HUANG Sheng-liang,CHENG Yu-lan,MA Han-fei.
The Longhua New District People’s Hospital of Shenzhen City,Shenzhen 518109,China
Objective: To explore the significance of treatment of combining traditional Chinese and western medicine on osteoporotic fracture, and to observe the effect of Strontium ranelate combined with Qianggu capsule on osteoporotic fracture healing. Method: 30 spragne-dawley rats were given with the retinoie acid intragastrically to induce osteoporosis.All rats with osteoporosis were randomly divided into the experimental group and the control group, each group had 15 rats, the experimental group and the control group were respectively given Strontium ranelate combined with Qianggu capsule and normal saline. The rats in each group were sacrificed at the second,fourth and sixth week respectively. Size of bony callus was measured and histopathologic features were analyzed.Result: There was no significant difference of the size of bony callus between two groups at the second week(P>0.05). At the fourth week, the experimental group’s bony callus was smaller than the control group and there was significant difference between two groups(P<0.05). At the sixth week, the experimental group’s bony callus was obviously smaller than the control group and there was significant difference between two groups (P<0.01). At the second week, histological inspection found that compared with the control group, there was no significant increased of osteoblast number in the experimental group, but at the fourth week and the sixth week, there was significant increased. Conclusion:Strontium ranelate combined with Qianggu capsule has obviously curative effect on osteoporotic fracture rats caused by retinoie acid.
Osteoporosis; Rats; Fracture healing; Strontium ranelate; Qianggu capsule
Medical Innovation of China,2014,11(15):033-037
广东省深圳市宝安区2011年科技计划项目(20110689)
①广东省深圳市龙华新区人民医院 广东 深圳 518109
黄圣良
10.3969/j.issn.1674-4985.2014.15.012
2014-03-10) (本文编辑:蔡元元)

