PreIQ及其突变体载体构建表达纯化和活性鉴定
孙威,封瑞,2,郭凤,2,赵金生,2,赵美眯,2,高青华,2,王红梅 ,毛楠,郝丽英,2
(中国医科大学1.药学院药物毒理学教研室;2.心血管研究所,沈阳 110001)
PreIQ及其突变体载体构建表达纯化和活性鉴定
孙威1,封瑞1,2,郭凤1,2,赵金生1,2,赵美眯1,2,高青华1,2,王红梅1,毛楠1,郝丽英1,2
(中国医科大学1.药学院药物毒理学教研室;2.心血管研究所,沈阳 110001)
目的构建心肌L型钙通道片段PreIQ及其突变体与谷胱甘肽转移酶(GST)重组的融合蛋白原核表达载体并进行表达纯化和活性鉴定。方法 将PreIQ及其突变体的cDNA插入pGEX⁃6p⁃1质粒载体后,转化大肠杆菌BL21感受态细胞,大量培养并利用异丙基硫代⁃β⁃D半乳糖苷(IPTG)诱导PreIQ及其突变体的GST融合蛋白表达,GS⁃4Bbeads进行分离纯化。采用SDS⁃PAGE鉴定目的蛋白分子质量和相对纯度。采用Bradford方法测定纯化后蛋白浓度。采用pull⁃down法检测纯化后蛋白的活性。结果 PreIQ及其突变体融合蛋白得到了大量表达;纯化的PreIQ及其突变体具有较高的纯度;纯化后蛋白能与钙调蛋白(CaM)结合,具有生物活性。结论 本研究成功构建了PreIQ及其突变体融合蛋白原核表达载体,获得具有生物活性的PreIQ及其突变体融合蛋白,为深入研究PreIQ的生能学功能奠定基础。
融合蛋白;PreIQ;突变体;pull⁃down
钙离子参与多种生理过程,如钙稳态调节、肌肉兴奋收缩[1]、神经递质释放、细胞生长增值、心脏传导、基因表达和激素分泌等。钙通道广泛存在于机体的各种类型细胞中,并且在不同的组织细胞,或同一组织细胞不同部位其钙通道的类型也各不相同。根据钙通道开闭的因素,将钙通道分为5类,其中一大类为电压依赖型钙通道(voltage⁃depen⁃dent calcium channel,VDCC)。按照激活阈值的高低又分为高电压激活钙通道(high⁃voltage activated Ca2+channel,HVACa2+通道)和低电压激活钙通道(low⁃voltage activated Ca2+channel,LVACa2+通道),其中高电压激活钙通道包括L、N、P/Q及R型钙通道。其膜电位低,激活前膜需要去极化。本文构建的preIQ及其突变体融合蛋白即属于L型高电压激活钙通道。
钙通道是由α1亚单位和α2/δ、β、γ几个辅助亚单位构成的复合体[2],由多基因编码。不同类型钙通道α1亚单位的编码基因多有不同,其中,L型钙通道结构为α1C、α1D和α1S。α1亚单位在细胞膜上形成4个跨膜区域(Ⅰ,Ⅱ,Ⅲ,Ⅳ)。每个跨膜区域有6个螺旋肽段(S1~S6)及其间的连接肽链组成。α1C的羧基末端在细胞膜内侧,自动调节Cav1.2的转录[3]。本文中合成的PreIQ融合蛋白正是L型钙通道α1C亚基羧基末端的的一段蛋白,氨基酸序列为1599⁃1639,见图1。

图1 Cavl.2的结构示意图以及PrelQ及其突变体的氨基酸序列Fig.1 Schematic illustrations of the peptides of Cavl.2and Sequences of PrelQand its mutant
近年来人们发现当细胞受到某种刺激后,L型钙通道开放,增加的钙离子对L型钙通道能产生两个互为相反的自身反馈调节,即钙依赖性失活和激活。钙调蛋白(calmodulin,CaM)作为一种钙离子敏感器,能与L型钙通道上的PreIQ结合,在上述过程中发挥重要作用。为了更好的研究细胞内因子CaM是如何与PreIQ作用的,影响二者作用的因素有哪些,我们急需构建PreIQ及其突变体的融合蛋白,提纯这种蛋白单体用到后续的实验当中。故本文主要讲述如何构建L型钙通道上PreIQ及其突变体融合蛋白质粒,如何表达纯化这种蛋白单体,并用实验证明提纯后蛋白单体具有生物学活性。
1 材料与方法
1.1 材料
pGEX⁃6p⁃1/PreIQ和pGEX⁃6p⁃1/PreIQ突变体(图1)质粒由上海生工生物工程股份有限公司合成;异丙基硫代⁃β⁃D半乳糖苷(isopropyl thiogalacto⁃side,IPTG)、溶菌酶(lysozyme,LYS)、二硫苏糖醇(dithiothreitol,DTT)、N⁃十二烷基肌氨酸钠(N⁃lauryl sarcosine,N⁃Lau)、氨苄西林(ampicillin,Amp)均购自Sigma公司;PreScission Protease和GS⁃4Bbeads购自GEHealthcare公司;胰蛋白胨、酵母提取物购自OXOID公司;其他试剂均购自BIOSHARP公司。
1.2 质粒DNA转化和提取
1.2.1 BL21感受态细胞的转化
应用42℃精确热激法进行感受态细胞的转化。精确量取pGEX⁃6p⁃1/PreIQ质粒10ng,加入E.coliBL21100μL,2mL离心管中轻轻混匀,冰浴30min,42℃水浴60s,快速转移至冰浴中,冷却2min。加入无菌SOC培养基1mL(胰蛋白胨20g/L,酵母提取物5g/L,NaCl 8.5mmol/L,KCl 2.5mmol/L,MgCl210mmol/L,葡萄糖20mmol/L),混匀置37℃水浴振荡器中培养1h,转速为120r/min。4000r/min离心2min,去除部分上清,悬浮沉淀的菌体约200μL加在含Amp 0.1g/L的LB固体琼脂培养板上,无菌条件下涂抹均匀。待培养板将悬浮菌液吸收后,转移至电热恒温培养箱中,倒置培养12~16h。1.2.2 质粒提取
经含AMP0.1g/L的琼脂平板筛选后,取单克隆菌种接种于装有含AMP0.1g/L的LB培养液3mL离心管中,37℃、120r/min培养12~16h。取菌液1mL(其余的菌液按菌液:50%甘油比例为4∶1冻存于-80℃冰箱中),15000r/min,4℃离心10min,弃上清;加冰预冷的碱裂解液Ⅰ250μL,剧烈涡旋使分散均匀;加新配制的碱裂解液Ⅱ250μL混匀;加冰预冷的碱裂解液Ⅲ350μL混匀,冰浴3~5min;4℃,15000r/min离心10min,转移上清置另一离心管中;加等体积的酚⁃氯仿(1∶1),振荡混合,室温放置2min;4℃,15000r/min离心10min,弃上清,加70%乙醇1mL,反复混匀,4℃,15000r/min离心2min,室温放置10~15min直至乙醇完全挥发;用去离子水重新溶解核酸,温和振荡数秒,-80℃保存。取部分再次用去离子水稀释,测质粒的吸光度值,直至稀释到500ng/μL。
1.3 PreIQ及其突变体质粒的DNA鉴定
1.3.1 质粒DNA的酶切鉴定
该质粒具有BamHⅠ和XhoⅠ两个限制性酶切位点。质粒DNA经双酶切后,琼脂糖电泳进行鉴定。
1.3.2 质粒的DNA测序
将-80℃保存的1mL菌液送到公司进行DNA测序。
1.4 融合蛋白的表达及纯化
1.4.1 融合蛋白表达:取400μL菌种加入到装有400mLLB培养液的锥形瓶中,37℃、100r/min振摇培养12~16h。当A600在0.8左右时,加入IPTG至1mmol/L,37℃,120r/min振摇培养4h,诱导融合蛋白大量表达。
1.4.2 融合蛋白的纯化:以下操作均在冰上进行,离心均采用4℃离心机。菌液4000r/min离心8min,弃上清,用磷酸盐缓冲液(phosphate bufer,PBS)20mL重悬沉淀菌体,加入20mg/mL的LYS和1mol/L的DTT各100μL、15%的N⁃Lau 2mL,混匀冰上放置30min,用超声波细胞粉碎机超3s停7s,4℃共5min。后加入30%TritonX⁃100666.67μL,冰上放置30min,14000r/min离心8min,弃沉淀。每10mL上清与250μLGS⁃4Bbeads 4℃结合过夜(beads用PBS洗3遍,600r/min,离心3min)。第2天用PBS温柔清洗beads,每次5mL,600r/min离心3min洗3次,4℃保存。待测蛋白浓度。
1.5 纯化后蛋白纯度和浓度测定
1.5.1 PreIQ及其突变体的纯度测定:15%SDS⁃PAGE电泳检测纯化的PreIQ及其突变体的相对分子量和纯度。
1.5.2 PreIQ及其突变体的浓度测定:参照Bradford蛋白浓度测定试剂盒说明测定PreIQ及其突变体的浓度。
1.6 PreIQ及其突变体的活性鉴定
用Pull⁃down的方法检测纯化后的PreIQ及其突变体的活性。具体方法为40μL的PreIQ及其突变体分别和30μL的CaM在300μL的Internal solution(aspartic acid 120mmol/L,KOH120mmol/L,KCl 24mmol/L,MgCl23.5mmol/L,HEPES10mmol/L,Na2ATP3mmol/L,EGTA1mmol/L,CaCl20.58mmol/L)中结合,旋转培养器4℃结合4h;用PBS温柔清洗beads,每次600μL,600r/min离心3min洗2次;弃上清得beads;15%SDS⁃PAGE电泳检测PreIQ及其突变体与CaM结合的情况,以了解纯化后的蛋白是否具有生物活性。
2 结果
2.1 重组质粒的酶切鉴定
鉴定插入PreIQ或PreIQ突变体的pGEX⁃6p⁃1载体的质粒。质粒pGEX⁃6p⁃1经BmaxHⅠ和XhoⅠ双酶切插入PreIQ或PreIQ突变体。质粒pGEX⁃6p⁃1约为4900bp,BmaxHⅠ和XhoⅠ之间的碱基全长为24bp,PreIQ或其突变体约为120bp,故PreIQ及其突变体的重组质粒全长约为4900-24+120=4996bp。重组质粒后经BmaxHⅠ和XhoⅠ双酶切应该得到一个大分子量约为4876bp的DNA片段和一个小分子量约为120bp的DNA片段。琼脂糖电泳结果发现不管是PeIQ还是其突变体的酶切图谱上,在约4876bp和120bp处都有一明显条带(图2),结果与预计相符,说明PreIQ及其突变体融合蛋白质粒均构建成功。
2.2 PreIQ及其突变体的DNA测序结果

图2 PrelQ及其突变体质粒的酶切鉴定琼脂糖电泳图Fig.2 Agarose electrodhoresis of PrelQand its mutnat plasmid digested by restriction endonucIease
DNA测序结果显示PreIQ重组质粒是含有120bp的DNA片段,基因同一性比较为100%,氨基酸同一性比较为100%,且插入方向正确,读码框架正确,无移码突变,见图3,进一步证明本文构建重组质粒获得成功。

图3 PrelQ及其突变体重组质粒的DNA测序结果Fig.3 The DNAsequence identification of GST⁃PreIQand its mutant
2.3 纯化后蛋白的纯度和浓度测定
GST蛋白的表观分子质量约为26kDa,PreIQ及其突变体的序列都含有40个氨基酸,表观分子质量约为4kDa。PreIQ及其突变体融合蛋白表观分子质量约为30kDa。结果显示,在表观分子质量约30kDa处出现一条粗蛋白条带,纯度高,表达量大,此条带即为PreIQ及其突变体的融合蛋白条带,与预期结果一致;在表观分子质量约26kDa处出现一条细蛋白条带,表达量小,此条带认为是GST蛋白条带,见图4。初步认定提纯获得PreIQ及其突变体的GST融合蛋白。

图4 纯化后GST⁃PrelQ及其突变体蛋白SDS⁃PAGE图Fig.4 SDS⁃PAGEof purification GST⁃PreIQand its mutant
采用Bradford蛋白浓度测定试剂盒方法测定提纯后的蛋白浓度,结果发现PreIQ重组蛋白和PreIQ突变体重组蛋白的浓度分别为2.24和2.05mg/mL。
2.4 PreIQ及其突变体融合蛋白的活性鉴定
应用pull⁃down微量蛋白结合法,得到结果,见图5,当提纯后的PreIQ与CaM结合时,在表观分子量18kDa出现一条蛋白条带,说明本实验提纯后得到的PreIQ能与CaM结合,这一结果与某些国外的报道一致[4,5];当提纯后的PreIQ突变体与CaM结合时,结合量很少,可以忽略不计,在表观分子量18kDa处只出现一条很弱的条带,说明本实验提纯后的PreIQ突变体不能与CaM结合[2]。以上的结果说明本实验提纯后得到的PreIQ及其突变体的GST融合蛋白都具有生物活性。
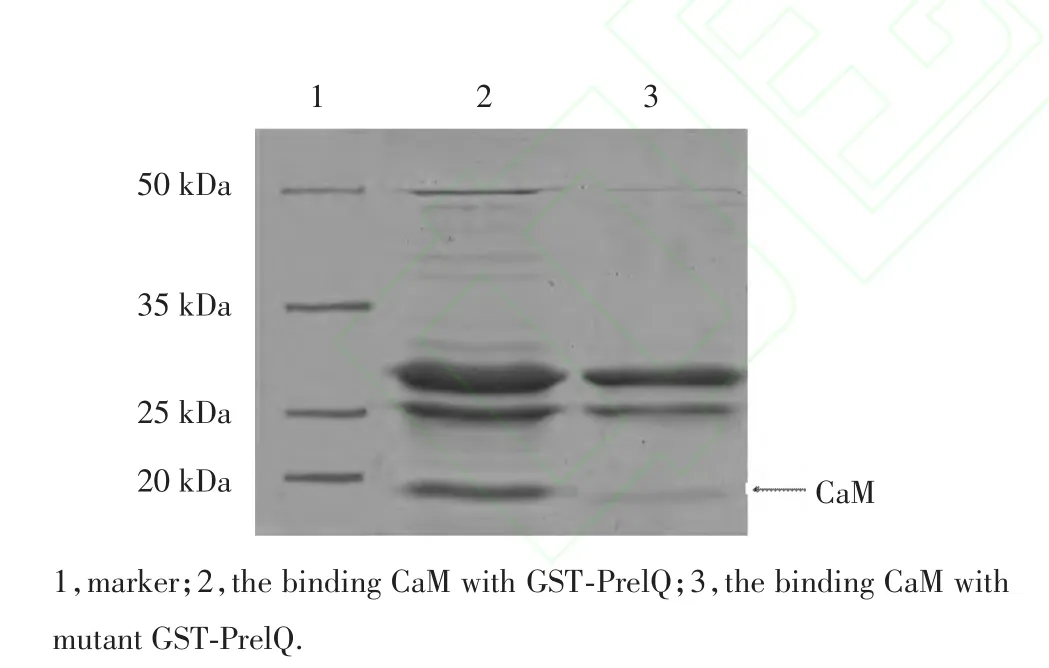
图5 GST⁃PreIQ及其突变体与钙调蛋白(CaM)结合的SDS⁃PAGE图Fig.5 SDS⁃PAGEof CaMbinding with GST⁃PrelQand mutant GST⁃PrelQ
3 讨论
近期研究发现钙离子结合蛋白1(caldendrin,CaBP1)的一种突变体,能与PreIQ结合介导钙离子的负反馈调节,即钙依赖性失活(Ca2+dependent in⁃activation,CDI)[6]。Ca2+/CaM有两个臂(C⁃lobe和N⁃lobe),C⁃lobe也能与PreIQ结合[7]。与IQ基序相比,CaM与通道PreIQ的亲和力较弱[2]。也有报道称Cav1.2上EF和IQ基序间标签肽C、CB和PreIQ都能与CaM结合介导CDI。近年来人们在研究通道结合蛋白的作用机制中,经常应用到Cav1.2的PreIQ及其突变体的融合蛋白片段,本实验室构建了PreIQ及其突变体的GST融合蛋白的质粒,将其转化到大肠杆菌中,诱导蛋白大量表达,为Cav1.2α1C亚单位上PreIQ及其突变体融合蛋白的纯化提供方法。
原核表达系统发展完善、流程简单快速、成本低、产量高,尤其适宜于表达原核来源的以及不需要翻译后修饰的真核蛋白。但在表达具体某种蛋白时,我们需要对表达条件进行相应的优化,以获得高纯度,高表达量的融合蛋白。本实验应用双酶切和DNA测序这两种方法完成了PreIQ及其突变体融合蛋白质粒的鉴定;并用SDS⁃PAGE电泳法确定纯化后蛋白的纯度,证明本方法获得的蛋白纯度高;使用Bradford法测定了纯化后蛋白的浓度,结果发现本方法提纯后的蛋白浓度高,为后续的实验顺利进行提供了可能性;应用Pull⁃down法发现提纯后的融合蛋白也具有生物活性。综上所述,采用本方法可稳定获得高纯度高浓度并具有生物活性的Pre⁃IQ及其突变体蛋白,为后续深入研究Cav1.2上Pre⁃IQ基序的生物学功能奠定了基础。
[1]Hulme JT,Yarov⁃Yarovoy V,Lin TW,et al.Autoinhibitory control of the CaV1.2channel by its proteolytically processed distal C⁃ter⁃minal domain[J].JPhysiol,2006,576(Pt 1):87-102.
[2]Asmara H,Minobe E,Saud ZA,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2Ca2+channels[J].JPhar⁃macol Sci,2010,112(4):397-404.
[3]Schroder E,Byse M,Satin J.L⁃type calcium channel Cterminus au⁃toregulates transcription[J].Circ Res,2009,104(12):1373-1381.
[4]Minobe E,Asmara H,Saud ZA,et al.Calpastatin domain Lis a par⁃tial agonist of the calmodulin⁃binding site for channel activation in Cav1.2Ca2+channels[J].JBiol Chem,2011,286(45):39013-39022.
[5]Kim EY,Rumpf CH,Van Petegem F,et al.Multiple C⁃terminal tail Ca(2+)/CaMs regulate Ca(V)1.2function but do not mediate chan⁃nel dimerization[J].EMBOJ,2010,29(23):3924-3938.
[6]Tippens AL,Lee A.Caldendrin,a neuron⁃specific modulator of Cav/1.2(L⁃type)Ca2+channels[J].JBiol Chem,2007,282(11):8464-8473.
[7]Findeisen F,Tolia A,Arant R,et al.Calmodulin overexpression does not alter Cav1.2function or oligomerization state[J].Chan⁃nels,2011,5(4):320-324.
(编辑 裘孝琦)
Vector Construction,Expression,Purificationand Identificationof PreI QandIts Mutant
SUNWei1,FENGRui1,2,GUOFeng1,2,ZHAOJin⁃sheng1,2,ZHAOMei⁃mi1,2,GAOQing⁃hua1,2,WANGHong⁃mei1,MAONan1,HAOLi⁃ying1,2
(1.Department of Pharmaceutical Toxicology,School of Pharmacy,China Medical University,Shenyang 110001,China;2.Cardiovascular Institute of China Medical University,Shenyang110001,China)
ObjectiveTo develop prokaryotic expression vectors for PreIQand its mutant GSTfusion protein expressions,purification and activity identification.MethodscDNAs of PreIQand its mutant were cloned into pGEX⁃6p⁃1plasmid vector,and then transformed to theEscherichia coliBL21component cells.The transformed BL21cells were stimulated with IPTGfor the expression of GSTfusion proteins with PreIQand its mutant.The fusion proteins were purified with Glutathione⁃Sepharose 4Bbeads.SDS⁃PAGEwas used to detect the purity and relative molecular weight.Bradford method was used to determine the concentration of purified PreIQand its mutant.The protein activity was examined by pull⁃down method.ResultsSDS⁃PAGEshowedhighpurityofPreIQanditsmutantwiththeconcentrationaround2mg/mL,whichwasenoughformolecularbiological and electrophysiological studies.The purified PreIQand its mutant in this study successfully bind to CaM.ConclusionProkaryotic expression vec⁃tors of PreIQand its mutant fusion proteins were successfully constructed,and bioactive fusion proteins were obtained.These results provided a basis forfurtherbiologicalfunctionstudiesofPreIQ.
fusion protein;PreIQ;mutant;pull⁃down
R966
A
0258-4646(2014)03-0293-04
http://www.cnki.net/kcms/detail/21.1227.R.20140429.1439.004.html
国家自然科学基金(31071004;81001429;81100108)
孙威(1985-),女,博士研究生.
郝丽英,E-mail:lyhao@mail.cmu.edu.cn
2013-12-03
网络出版时间:2014-04-2914:39
·论著·

