阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞中Wnt信号通路及相关因子表达的影响
李艳伟,于晓玲,申玉超(1.辽宁医学院附属第一医院老年病科高级医疗服务中心,辽宁锦州 11001;.沧州市中心医院重症医学科,河北沧州 061001)
阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞中Wnt信号通路及相关因子表达的影响
李艳伟1*,于晓玲1#,申玉超2(1.辽宁医学院附属第一医院老年病科高级医疗服务中心,辽宁锦州 121001;2.沧州市中心医院重症医学科,河北沧州 061001)
目的:研究阿托伐他汀对氧化型低密度脂蛋白(ox-LDL)诱导的人脐静脉内皮细胞(HUVECs)中Wnt信号通路及相关因子Wnt1、β-连环蛋白(β-catenin)及蓬乱蛋白1(dvl-1)表达的影响。方法:将体外培养的HUVECs分为空白对照组、ox-LDL(50mg/ L)组和低、高剂量(ox-LDL 50mg/L+阿托伐他汀0.5、10µmol/L)组,分别加入相应药物培养24 h后,用硝酸还原酶法测定各组细胞中一氧化氮(NO)含量,用免疫组化法和蛋白质印迹法检测各组细胞中Wnt1、β-catenin及dvl-1蛋白的表达。结果:与空白对照组比较,其他3组细胞中NO含量明显减少(P<0.01),Wnt1、β-catenin、dvl-1蛋白表达均明显增强(P<0.01);与ox-LDL组比较,低、高剂量组细胞中NO含量均明显增加(P<0.01),Wnt1、β-catenin、dvl-1蛋白表达均明显减弱(P<0.01)。结论:阿托伐他汀能抑制ox-LDL诱导的HUVECs中Wnt信号通路及相关因子表达,其可能是阿托伐他汀抗动脉粥样硬化的机制之一。
阿托伐他汀;人脐静脉内皮细胞;Wnt信号通路;氧化型低密度脂蛋白
*医师。研究方向:动脉粥样硬化与心血管疾病。电话:0416-4197632。E-mail:wenze2004222@126.com
#通信作者:主任医师,教授,硕士研究生导师。研究方向:动脉粥样硬化与心血管疾病。电话:0416-4197632。E-mail:gtxiaolingyu@ 163.com
动脉粥样硬化(Atherosclerosis,AS)是具有较长一段无症状阶段的慢性进展性炎症疾病,疾病进展最终可致不稳定型心绞痛、心肌梗死、心源性猝死等急性心血管事件。近年来,内皮功能不全被多数学者认为是AS发生机制中的始动环节,因此对内皮细胞损伤进行药物干预治疗,也成为心血管疾病领域研究的一个新的趋势[1]。有研究证实,在高胆固醇血症所致的兔腹主动脉粥样斑块中β-连环蛋白(β-catenin)的mRNA和蛋白表达明显升高,提示β-catenin参与了AS的形成[2],因此推断Wnt/β-catenin信号通路可能与AS的发生机制有关。本文拟通过研究阿托伐他汀对氧化型低密度脂蛋白(ox-LDL)诱导人脐静脉内皮细胞(HUVECs)Wnt信号通路及相关因子Wnt1、β-catenin、蓬乱蛋白1(dvl-1)表达,探讨AS与Wnt/β-catenin信号通路的关系及阿托伐他汀抗AS的可能机制。
1 材料
1.1 仪器
CO2培养箱(美国Thermo forma公司);倒置显微镜(日本Olympus公司);超速离心机(美国Sigma公司)。
1.2 药品与试剂
阿托伐他汀原料药(美国Sigma公司,批号:PZ0001,纯度:>98%);胎牛血清、1640培养基、胰蛋白酶购自北京海克隆生物有限公司;ox-LDL(广州奕源生物科技有限公司,批号:YB-002,规格:2.0mg/m l);兔抗人Wnt1抗体(巴傲得生物科技有限公司);鼠抗人β-catenin抗体(北京中杉金桥生物技术有限公司);兔抗人dvl-1抗体(北京博奥森生物技术有限公司);一氧化氮(NO)试剂盒(南京建成生物工程研究所)。
1.3 细胞
HUVECs购自美国ATCC公司。
2 方法
2.1 细胞培养与分组
取HUVECs置于含10%胎牛血清的1640细胞培养液中,5%CO2细胞培养箱中培养,1~2 d换液1次,以0.25%胰蛋白酶消化及传代,并在倒置显微镜下观察细胞形态,选择生长良好的4~6代细胞用于试验。将细胞分4组,分别为(1)空白对照组,只有培养液,不加任何干预;(2)ox-LDL组:在培养液中加入终浓度为50mg/L的ox-LDL;(3)低剂量组:在培养液中加入终浓度为50mg/L的ox-LDL和0.5µmol/L的阿托伐他汀;(4)高剂量组:在培养液中加入终浓度为50 mg/L的ox-LDL和10µmol/L的阿托伐他汀。各组细胞加药培养24 h。
2.2 细胞形态学观察
用倒置显微镜观察各组细胞加药培养24 h后的形态学变化。
2.3 NO含量的检查
用硝酸还原酶法[3],特异性将NO3-还原成NO2-,通过显色深浅测定各组细胞中NO的含量。
2.4 免疫组织化学法检测蛋白的表达
将第4代细胞接种在有盖玻片(经多聚赖氨酸处理)的6孔板中,进行细胞爬片,4℃10%福尔马林固定30m in,30% H2O2-纯甲醇(1∶9)室温浸泡15m in,封闭液37℃孵育30min,加兔抗人Wnt1、鼠抗人β-catenin、兔抗人dvl-1抗体(1∶600)于4℃过夜;加二抗A液37℃孵育30min,加二抗B液37℃孵育30m in,显色、复染。以上每步之间用PBS冲洗3次,每次4 min,显色、复染,脱水、封片。镜下观察各组细胞中相应蛋白的表达。
2.5 蛋白质印迹(Western blot)法检测蛋白表达
收集各组细胞,超声裂解细胞,4℃1 000×g离心2min,取上清液,用考马斯亮蓝法对蛋白进行定量。取20µl蛋白样品行聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉封闭2 h,分别滴加兔抗人Wnt1、鼠抗人β-catenin、兔抗人dvl-1抗体(1∶400),4℃孵育过夜,相应碱性磷酸酶标记的二抗室温孵育2 h,碱性磷酸酶法显色。于扫描仪上成像,并用GENEGENIUS软件对条带进行灰度值半定量进行分析。以β-肌动蛋白(β-actin,分子质量为43 kDa)为内参,Wnt1(分子质量为40 kDa)、β-catenin(分子质量为92 kDa)及dvl-1(分子质量为76 kDa)与β-actin条带灰度值的比值代表各蛋白表达的相对量。
2.6 统计学方法
3 结果
3.1 细胞形态学变化
镜下,空白对照组细胞呈单层铺路石状镶嵌排列,互不重叠,细胞边界清晰,呈多角形;ox-LDL组细胞收缩变圆,细胞间隙增宽,边界不清,部分细胞脱落;高、低剂量组细胞间隙较ox-LDL组窄,细胞形态趋于对照组,且高剂量组较低剂量组细胞形态更趋于对照组。各组细胞的倒置显微镜图见图1。
3.2 细胞中NO含量比较
与空白对照组比较,ox-LDL组和高、低剂量组细胞中NO含量均明显减少(P<0.01);与ox-LDL组比较,高、低剂量组细胞中NO含量均明显增加(P<0.01),且高剂量组比低剂量组增加更明显(P<0.01),具体结果见表1。

图1 各组细胞的倒置显微镜图A.空白对照组;B.ox-LDL组;C.低剂量组;D.高剂量组Fig 1 Inverted m icrograph of cellsA.blank controlgroup;B.ox-LDL group;C.low-dose group;D.highdosegroup
表1 各组细胞中NO含量和W nt1、β-catenin、dvl-1蛋白的表达(±s,n=6)Tab 1 The protein expressionsofW nt1,β-catenin and dvl-1(±s,n=6)
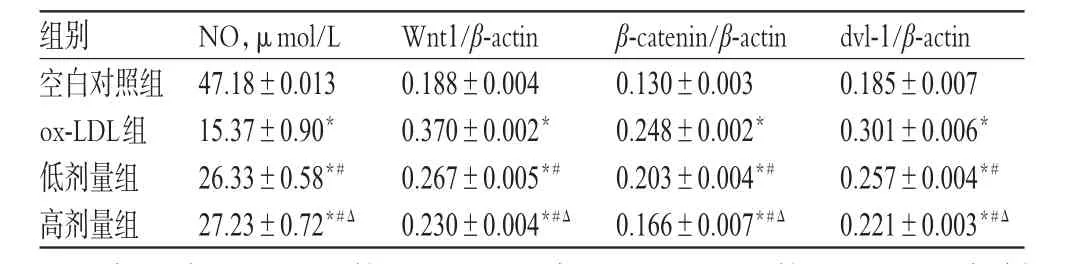
表1 各组细胞中NO含量和W nt1、β-catenin、dvl-1蛋白的表达(±s,n=6)Tab 1 The protein expressionsofW nt1,β-catenin and dvl-1(±s,n=6)
与空白对照组比较:*P<0.01;与ox-LDL组比较:#P<0.01;与低剂量组比较:ΔP<0.01vs.blank control group:*P<0.01;vs.ox-LDL group:#P<0.01;vs.low-dosegroup:ΔP<0.01
组别空白对照组ox-LDL组低剂量组高剂量组0.185±0.007 0.301±0.006*0.257±0.004*# 0.221±0.003*#Δ 47.18±0.013 15.37±0.90*26.33±0.58*# 27.23±0.72*#Δ 0.188±0.004 0.370±0.002*0.267±0.005*# 0.230±0.004*#Δ 0.130±0.003 0.248±0.002*0.203±0.004*# 0.166±0.007*#Δ dvl-1/β-actin NO,μmol/L Wnt1/β-actin β-catenin/β-actin
3.3 细胞中W nt1、β-catenin、dvl-1蛋白的表达
空白对照组细胞质内均出现了Wnt1、β-catenin、dvl-1蛋白的棕黄色淡染颗粒。与空白对照组比较,ox-LDL组细胞质内出现大量棕色颗粒聚集、浓染。高、低剂量组较空白对照组细胞质内出现较多棕黄色颗粒,但较ox-LDL组细胞棕黄色颗粒明显减少,且高剂量组较低剂量组细胞质内棕黄色颗粒减少。各组细胞中Wnt1、β-catenin、dvl-1蛋白表达的光镜图见图2。
利用Western blot法,与空白对照组比较,ox-LDL组和高、低剂量组细胞中Wnt1、β-catenin、dvl-1蛋白定量明显升高(P<0.01);与ox-LDL组比较,高、低剂量组细胞中Wnt1、β-catenin、dvl-1蛋白定量明显降低(P<0.01),且高剂量组较低剂量组降低更明显(P<0.01)。各组细胞中Wnt1、β-catenin、dvl-1蛋白的表达见表1。
4 讨论
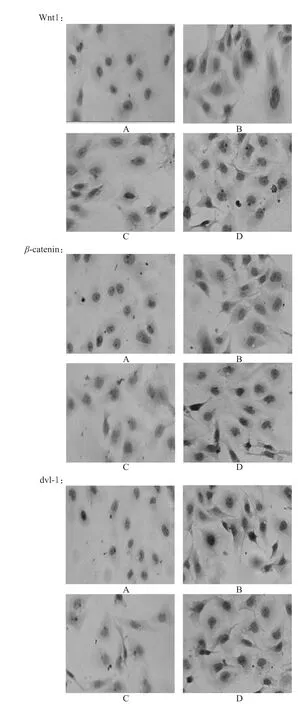
图2 各组细胞中W nt1、β-catenin、dvl-1蛋白表达的光镜图A.空白对照组;B.ox-LDL组;C.低剂量组;D.高剂量组Fig 2 Lightm icrograph of W nt1,β-catenin and dvl-1 protein expressionsA.blank control group;B.ox-LDL group;C.low-dose group;D.highdosegroup
血管内皮受损是AS发病的始动环节,尤其是对ox-LDL的摄取是AS起始和进展中的关键。Ross R[4]认为,AS的发生是由于血管内皮细胞和平滑肌细胞受各种危险因素,尤其是ox-LDL的损伤,使血管局部产生的一种过度的慢性炎症增生反应。已有大量研究证实,ox-LDL通过其特异性受体氧化型低密度脂蛋白受体1(LOX-1)的介导激活多条炎症信号通路,在AS的形成及进展中对血管内皮造成炎性刺激损伤[5-7]。Wnt信号通路高度保守,与基因的表达、细胞的极性及细胞的黏附有关,它分为经典的Wnt信号通路(即Wnt/β-catenin信号通路)和非经典Wnt信号通路(包括非经典Wnt/Ca2+和Wnt/ JNK通路)[8]。本研究主要探讨Wnt/β-catenin信号通路。Wnt/β-catenin信号通路活化时,Wnt与Frizzeld受体结合激活细胞内的dvl,磷酸化的dvl将信号传至细胞内,抑制β-catenin等组成的复合物激酶的活性,引起β-catenin在细胞内的积累,并进入细胞核与T细胞因子(TCF)、淋巴细胞增强因子家族的转录因子形成复合物[9],它可与钙联蛋白(Calnexin)启动子区结合,从而下调calnexin的表达[10]。calnexin表达减少,calnexin/catenin复合体减少,使内皮细胞间黏附功能下降,细胞间缝隙形成、通透性增加,从而导致炎症细胞易侵入血管内皮下而导致AS的形成。综上推断,Wnt/β-catenin信号通路激活与AS的形成有关。
阿托伐他汀通过抑制3-羟基-3-甲基戊二酰辅酶A(HUG-CoA)还原酶,阻碍l-甲羟戊酸的生成达到降低胆固醇的目的。研究表明,他汀类药物在抑制炎症反应、修复受损血管、恢复血管内皮完整性、稳定斑块等方面发挥着关键作用[11-12],从而预防心血管事件的发生。在实验中发现,他汀类药物能抑制肿瘤坏死因子α(TNF-α)诱导的人脐静脉内皮细胞细胞间黏附分子1(ICAM-1)的表达[13];阿托伐他汀钙能够上调内皮型一氧化氮合酶(eNOS)的表达,增加eNOSmRNA的稳定性,减少ox-LDL对eNOS的负向调节;阿托伐他汀钙可以选择性地维持NO介导的内皮依赖性动脉松弛[14]。
本研究显示,被ox-LDL诱导的HUVECs分泌的NO明显减少,同时Wnt1、β-catenin、dvl-1蛋白表达明显升高,由此推测ox-LDL有可能激活Wnt/β-catenin信号通路。在ox-LDL诱导HUVECs的同时加入阿托伐他汀,发现内皮细胞分泌的NO明显增加,同时Wnt1、β-catenin、dvl-1蛋白表达明显降低,因此推测被ox-LDL激活的Wnt/β-catenin信号通路被阿托伐他汀抑制;并且阿托伐他汀高剂量组较低剂量组内皮细胞分泌的NO明显增加,同时Wnt1、β-catenin、dvl-1蛋白表达明显降低,因此推测阿托伐他汀呈剂量依赖性抑制ox-LDL诱导的HUVECs的wnt信号通路及相关因子表达。本研究结果提示,Wnt/β-catenin信号通路激活可能与AS的形成有关,而阿托伐他汀抗AS可能与其抑制Wnt/β-catenin信号通路及相关因子表达有关,并且这一作用随剂量增加而更加明显。
[1]Schwartz BG,Econom ides C,Mayeda GS,etal.The endothelial cell in health and disease:its function,dysfunction,measurementand therapy[J].Int J Impot Res,2010,22(2):77.
[2] 王育林,江淼,赵欣,等.β-钙联蛋白在兔腹主动脉粥样硬化斑块中的表达[J].中华实验外科学杂志,2006,23(9):1 110.
[3] 张秀梅,于晓玲,申玉超,等.阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞缝隙链接的影响[J].中国药房,2013,24(5):412.
[4] Ross R.Atherosclerosis:an inflammatory disease[J].NEngl JMed,1999,340(2):115.
[5] Murphy JE,Vohra RS,Dunn S,etal.Oxidised LDL internalisation by the LOX-1 scavenger receptor is dependenton a novel cytoplasmicmotif and is regulated by dynam in-2[J].JCell Sci,2008,121(Pt13):2 136.
[6] Frangogiannis NG.Chemokines in ischemia and reperfusion[J].Thromb Haemost,2007,97(5):738.
[7] Sawamura T,Kume N,Aoyama T,etal.An endothelial receptor for oxidized low-density lipoprotein[J].Nature,1997,386(6 620):73.
[8]Xing Y,ClementsWK,Kimelman D,etal.Crystal structure of a beta-catenin/axin complex suggests amechanism for the beta-catenin destruction complex[J].Genes Dev,2003,17(22):2 753.
[9] Giles RH,van Es JH,Clevers H.Caughtup in aWnt storm:Wnt signaling in caner[J].Biochim Biophys Acta, 2003,1 653(1):1.
[10] Birchmeier W.Cell adhesion and signal transduction in cancer:conference on cadherins,catenins and cancer[C]. EMBO Rep,2005,6(5):413.
[11] Kaneyuki U,Ueda S,Yamagishi S,et al.Pitavastatin inhibits lysophosphatidie acid-induced proliferation and monoeyte chemoattractant protein-1 expression in aortic smooth muscle cells by suppressing rac-1-mediated reactive oxygen soecies generation[J].Vascul Pharmacol,2007,46(4):286.
[12]Krum H,Bailey M,MeyerW,etal.Impactof statin therapy on clinical outcomes in chronic heart failure patients according to beta-blocker use:results of CIBISⅡ[J].Cardiology,2007,108(1):28.
[13]LeungWH,Lau CP,Wong CK,etal.Beneficialeffectsof cholesterol-lowering therapy on coronary endothelium-dependent relaxation in hypercholesterolaemic patients[J].Lancet,1993,41(8 859):1 496.
[14]Wassmann S,Laufs U,Baumer AT,et al.HMG-CoA reductase inhibitors improve indothelial dysfunction in romocholesterolemic hypertension via reduced production of reactive oxygen species[J].Hypertension,2001,37(6):1 450.
Effects of Atorvastatin on W nt Signaling Pathway and the Exp ression of Related Factors in ox-LDL Induced Human Umbilical Vein Endothelial Cells
LI Yan-wei1,YU Xiao-ling1,SHEN Yu-chao2(1.Senior Medical Center for Senile Disease,The First A ffiliated Hospital of Liaoning Medical University,Liaoning Jinzhou 121001,China;2.ICU,Cangzhou Central Hospital,Hebei Cangzhou 061001,China)
OBJECTIVE:To study the effects of atorvastatin on Wnt signaling pathway and the expression of related factors Wnt1,β-catenin and dvl-1 in oxidized low density lipoprotein(ox-LDL)induced human umbilical vein endothelial cells(HUVECs).METHODS:HUVECs culturedin vitrowere divided into blank control group,ox-LDL group(50 mg/L),low-dose and high-dose groups(ox-LDL 50 mg/L+atrovastatin 0.5,10µmol/L).They were cultured w ith relevant drugs for 24 h;nitrate reductase method was adopted to determ ine the content of NO;and Wnt1,β-catenin and dvl-1 protein expressions were determ ined by immunohistochem ical method and Western blotting assay.RESULTS:Compared w ith blank control group,the content of NO decreased significantly in other 3 groups(P<0.01),whileWnt1,β-catenin and dvl-1 protein expressions increased significantly(P<0.01);compared w ith ox-LDL group,the content of NO in ox-LDL low-dose and high-dose groups increased significantly(P<0.01),while Wnt1,β-catenin and dvl-1 protein expressions decreased significantly(P<0.01).CONCLUSIONS:Atorvastatin can inhibitWnt signaling pathway and the expression of related factors in ox-LDL induced HUVECs,whichmay be one of anti-atherosclerosismechanisms of atorvastatin.
Atorvastatin;Human umbilical vein endothelial cells;Wnt signaling pathways;Oxidized low density lipoprotein
R965
A
1001-0408(2014)17-1574-04
DOI 10.6039/j.issn.1001-0408.2014.17.12
2013-12-18
2014-01-31)

