不同方法建立多重耐药铜绿假单胞菌肠道感染动物模型的比较和评价
韩华中,杨俊
(上海交通大学附属上海第六人民医院普外科,上海 200233)
近年来倍受临床重视的条件致病菌-铜绿假单胞菌(Pseudomonas aeruginosa,PA),俗称绿脓杆菌,为革兰阴性杆菌,在正常人皮肤、呼吸道、肠道及环境广泛存在[1],与烧伤感染、败血症、下呼吸道感染、肠道感染、外科创伤及术后感染等的关系极为密切[2,3],在革兰阴性菌引起的院内感染中,铜绿假单胞菌所占比例一直处于前列[4-6]。由于铜绿假单胞菌固有的特性,表现出对β-内酰胺类、氨基糖苷类、氯霉素类、喹诺酮类、四环素类和磺胺类等多种抗菌药物存在天然或获得性多重耐药(multidrug resistance),使得治疗铜绿假单胞菌感染十分困难,目前尚缺乏控制其感染的确切手段,人们试图通过多种方法来解决这一问题。本研究通过不同处理方法建立肠道多重耐药铜绿假单胞菌感染动物模型,为研究和治疗因耐药菌引起的感染提供良好的实验模型奠定基础。
1 材料和方法
1.1 实验菌株
多重耐药铜绿假单胞菌(multidrug-resistant Pseudomonas aeruginosa,MDR-PA )为上海市第六人民医院临床微生物检验中心分离的临床菌株,标准为对青霉素类、头孢菌素类、碳氢酶系及β-内酰胺酶抑制剂等均耐药,经过药敏实验和全自动微生物分析系统鉴定。MDR-PA 菌株于5%羊琼脂培养基中培养35℃普通恒温箱培养12 h,菌体悬于无菌Ringer 缓冲液中,利用分光光度法配制成1.0 × 109CFU /mL 浓度的MDR-PA 悬液。
1.2 试剂和仪器
培养皿;M-H 琼脂平板,5%羊血琼脂培养基;心脑浸出液培养基,药敏卡:美罗培南(MEM 10 μg)、头孢哌酮/舒巴坦(SCF 105 pg )、头孢吡肟(FEP 30 μg )、哌拉西林/他唑巴坦(TZP110 )、环丙沙星(CIP 5 μg )均购自英国Oxoid 公司;肿瘤坏死因子-α (tumor necrosis factor alpha,TNF-α )和干扰素-γ(interferon-γ,INF-γ )检测试剂盒,BD Pharmingen,Oxford,UK;高效冷冻离心机;紫外分光光度计;Microscan Autoscan-4 细菌鉴定系统和RAID 板;Ultra-Turrax 匀浆仪;DNP-9028 恒温培养箱;Espec BNA-311 二氧化碳培养箱等。
1.3 实验动物、分组及处理
6 周龄SPF 级雄性BALB / c 小鼠24 只,平均体重(17.53 ±1.35 )g,购于上海交通大学医学院动物实验室,由上海西普尔-必凯实验动物公司提供【SCXK(沪)2008-0016】。实验在上海市第六人民医院进行【SYXK(沪)2011-0128】。分成①正常对照组;②多重耐药铜绿假单胞菌(MDR-PA )组;③MDR-PA + 抗生素组;④MDR-PA + 禁食组,6 只/组。正常对照组每日给予0.5 mL 生理盐水灌胃,连续7日;MDR-PA 组每日给予1.0 × 109CFU/mL,0.5 mL 的PA 悬液灌胃,连续7日;MDR-PA + 抗生素组:以头孢曲松钠终浓度每日8g /(bw·kg )的剂量[7],自由饮水(14.4 mg/mL ),每天更换一次饮水,连续3d 后,每日给予1.0 ×109CFU/mL,0.5 mL 的PA 悬液灌胃7d;MDR-PA + 禁食组小鼠禁食1d 后,每日给予1.0 × 109CFU/mL,0.5 mL 的PA 悬液灌胃,连续7日。实验过程中每天同一时间段对各组小鼠精神状态、粪便情况观察并记录;用电子称称小鼠体重。于第11 天结束实验,颈椎脱臼法处死小鼠,取回盲部内容物经细菌培养及鉴定 +药敏实验,留取结肠组织标本备用。
1.4 细菌培养及鉴定、药敏实验
实验结束后,无菌收集回盲部内容物,称重(约0.1 ~0.2 g ),置于2.5 mL Ringer 缓冲液,匀浆系列10 倍稀释(10-1、10-2,10-3、10-4、10-5)。取100 μL稀释液种植于5%羊血琼脂培养基培养24 h 后,分离铜绿假单胞菌,经Microscan Autoscan-4 细菌鉴定系统鉴定后,对鉴定出的铜绿假单胞菌接种M-H 琼脂平板上法国梅里埃VITEK2 AST-GN09 药敏卡进行K-B 纸片扩散法药物敏感实验。
1.5 结肠组织病理学观察和炎症评分
将新鲜收集的小鼠结肠组织标本迅速置于4%甲醛中,经常规处理后6 μm 切片,HE 染色,光学显微镜观察,并依据修改后的Berg 等[7]评分标准进行评分。
1.6 促炎细胞因子TNF-α 和IFN-γ的ELISA 检测
预先配置含有PBS、2% (v/v )小牛血清和0.5% (w/v )十六烷基三甲基溴的匀浆缓冲液,将小鼠结肠组织解冻、切割、称重后置于800 μL 上述缓冲液中进行匀浆,组织匀浆后4 ℃离心15 min (3000 r/min ),收集上清液置于-80℃冰箱中冻存备用。按照ELISA 试剂盒检测结肠组织中TNF-α 及IFN-γ 水平。每个结肠提取物中的蛋白含量通过BCA 法进行定量。TNF-α 及IFN-γ 水平表达为pg/mg 结肠组织。
1.7 统计学分析
采用GraphPad Prism 5.0 进行统计分析,实验数据均以mean ±sD 表示,两组间比较采用Student’s t 检验。P <0.05 表示差异具有统计学意义。P <0.01 表示差异具有显著统计学意义。
2 结果
2.1 小鼠精神状态、粪便和体重变化
正常对照组,小鼠粪便正常,精神状态好,体重逐渐上升;MDR-PA 组、MDR-PA + 抗生素组和MDR-PA+禁食组小鼠粪便呈脓稀便或脓便,精神萎靡,体重逐渐减轻,较对照组体重差异有显著性(P <0.01 );MDR-PA + 抗生素组小鼠粪便呈脓便,精神萎靡,体重明显减轻较MDR-PA 组和MDRPA + 禁食组差异有显著性(P <0.05)(图1)。
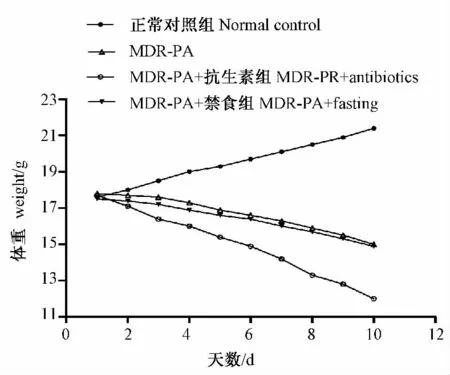
图1 各组小鼠每天体重变化情况Fig.1 Changes of body weight of the mice
2.2 细菌培养及鉴定、药敏实验结果
正常对照组细菌培养未见铜绿假单胞菌生长,其余三组细菌培养均见铜绿假单胞菌生长,鉴定及药敏实验结果均同灌胃细菌无差别(图2,彩插7)。
2.3 结肠组织HE 染色镜下观察结果
正常对照组:基本无炎症病变表现;MDR-PA 组和MDR-PA + 禁食组病变累及黏膜大部,炎症中度,黏膜下层充满单核细胞和中性粒细胞;MDR-PA+ 抗生素组重度炎症,炎症细胞为单核细胞和中性粒细胞的混合组成,有时可透壁,上皮增生明显,可见上皮细胞拥挤在长腺体内。含黏液的细胞几乎不可见,隐窝脓肿和溃疡可见,此组病变程度较MDRPA 组和MDR-PA + 禁食组严重(图3,彩插7)。
2.4 结肠炎症评分结果
三个实验组较正常对照组炎症评分明显升高,差异有显著性(P <0.01 );MDR-PA + 抗生素组炎症评分较MDR-PA + 禁食组、MDR-PA 组差异有显著性(P <0.05 );MDR-PA + 禁食组与MDRPA 组的炎症评分无明显差别(图4 )。
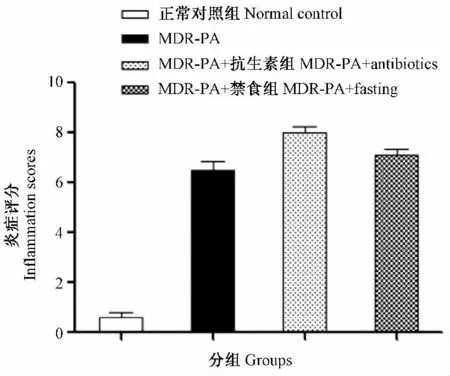
图4 各组的炎症评分结果Fig.4 Inflammation scores of the mouse groups
2.5 炎症因子TNF-α 和INF-γ 浓度检测结果
各实验组结肠炎症因子TNF-α 和INF-γ 浓度较对照组均增加,差异有显著性(P <0.01 );MDRPA + 抗生素组炎症因子浓度较MDR-PA + 禁食组、MDR-PA 组差异有显著性(P <0.05 );MDR-PA+ 禁食组与MDR-PA 组的炎症因子浓度无明显差别(图5 )。
3 讨论
随着各种侵入性操作和器官移植的推广,尤其是抗菌素的广泛应用和病原菌的变迁,革兰阴性杆菌感染率高,尤其是铜绿假单胞菌感染日益严重,且病情危重,死亡率高,治疗困难[8]。长期以来,铜绿假单胞菌感染尚缺乏有效的解决策略。虽然已有建立有关铜绿假单胞菌感染的动物模型,但或者针对其他部位的感染,如建立大鼠[9]、小鼠[10,11]、兔[12]等铜绿假单胞菌肺部感染模型;或者是秀丽隐杆线虫[13]、果蝇[14,15]肠道耐药铜绿假单胞菌感染模型。以及Alverdy 等[16]研究铜绿假单胞菌在小鼠肠道定植致病与其凝集黏附素的关系,证实铜绿假单胞菌对肠道上皮的黏附性和破坏肠上皮屏障是引起肠道感染致死机制之一。近来,Zaborina 等[17]利用临床株多重耐药铜绿假单胞菌扰乱培养人类肠上皮细胞(Caco-2 )的完整性,研究其相关的毒性表型如黏附性、能动性、生物膜形成和细胞毒性。Long 等[18]研究经过30%肝切除和短期禁食后的小鼠肠道粘液磷酸盐显著降低,在此基础上并给予肠道接种铜绿假单胞菌,实验证实小鼠肠道铜绿假单胞菌感染不仅与肠道低磷酸盐环境有关,而且与铜绿假单胞菌破坏肠道上皮屏障有密切关系。

图5 各组炎症因子TNF-α(A)、TNF-γ(B)的比较Fig.5 A:Comparison of TNF-α of the 4 groups.B:Comparison of TNF-γ of the 4 groups
然而小鼠肠道多重耐药铜绿假单胞菌感染的研究比较少见,本实验运用临床分离的多重耐药铜绿假单胞菌,通过三种不同处理方法建立小鼠肠道铜绿假单胞菌感染模型。第一种方法是采用直接给小鼠菌液灌胃7d,小鼠表现出脓稀便,精神萎靡,体重减轻明显,结肠组织病理示病变累及黏膜大部,炎症中度,黏膜下层充满炎症细胞,肠道炎症因子增高,在短期内,肠道致病菌的数量迅速增长,益生菌菌群生长受到抑制,导致小鼠肠道相对稳定的生态屏障被破坏,诱发肠道感染,为研究临床急性肠道感染提供一种参考模型。由于临床上广泛应用的抗生素,在杀灭病原微生物的同时也抑制了正常菌群中的有益微生物,使机体内相对稳定的生态屏障被破坏,导致肠道菌群紊乱[7]。第二种方法是先用广谱抗生素三代头孢菌素-头孢曲松钠干预小鼠3d 后,使小鼠肠道菌群失调症状(小鼠粪便呈软便或稀便),再给予菌液灌胃7d,这样所灌细菌更加容易引起肠道感染,此方法较第一种方法引起的肠道炎症更加严重,且于实验第10 天,由于肠道感染严重,有黄脓便,小鼠体重明显减轻,有一只小鼠死亡。不过此方法可以模拟临床长期应用广谱抗生素的患者出现肠道感染的现象,为抗生素相关性肠道感染提供一个合适的研究模型。第三种方法是采用给小鼠禁食1d 后,再给予菌液灌胃7d,小鼠表现出脓稀便,精神萎靡,体重减轻明显,结肠组织病理示病变累及黏膜大部,炎症中度,黏膜下层充满炎症细胞,肠道炎症因子增高。禁食造成的肠道黏膜萎缩[19],使致病菌更易定植于肠道,诱发肠道感染。此方法可以模拟临床常见的因长时间禁食造成的细菌定植、易位而引发的肠道感染。
本实验中MDR-PA + 抗生素组小鼠粪便呈脓便,精神萎靡,体重明显减轻较MDR-PA 组和MDRPA + 禁食组有差异;经过处理的三组小鼠较对照组均出现炎症因子的明显升高和光镜下炎症病变,但MDR-PA + 抗生素组的小鼠的炎症因子和炎症评分较另外两组升高明显;镜下观察MDR-PA + 抗生素组的炎症病变较其余两组严重;细菌培养鉴定及药敏结果均显示与所灌胃时的细菌相一致,确定肠道多重耐药菌感染的稳定性,为研究临床肠道感染提供可用的动物模型。
综上所述,第一种方法建立模型简便,直接灌菌液即可,但是引起的肠道感染症状较轻,若需要更严重的肠道感染模型,则要延长灌胃天数,这样将会延长实验进程;第二种方法先用抗生素干扰,引起肠道菌群失调后,再给予菌液灌胃,这样短期内可以引起肠道重度感染模型,但是增加了实验程序,可能会导致小鼠死亡。第三种方法相对较简便,禁食后给予菌液灌胃,引起的肠道感染症状较第一种方法严重,但炎症程度仍较轻,以后可以考虑同时禁食水或延长禁食时间,这样引起的肠道感染症状可能会加重。
总之,本实验三种方法均可成功建立肠道多重耐药细菌感染动物模型,可根据不同实验目的选择不同的建立模型方法。
(本文图2,3 见彩插7。)
[1]赵羽,夏梦岩,牛菊茹,等.156 株铜绿假单胞菌感染分布及耐药性分析[J].解放军医药杂志,2011,23(2):39 -41.
[2]张春平,俞华,刘华,等.铜绿假单胞菌感染分布及耐药性动态变迁[J].中华医院感染学杂志,2008,18(1):121 -123.
[3]沈黎,严晓敏,李春红,等.1998 -2007年医院感染铜绿假单胞菌及耐药性分析[J].中华医院感染学杂志,2010,20(4):570 -572.
[4]张敏,申明凤,廖卫.新乡市1731 株铜绿假单胞菌的耐药性变迁[J].国际检验医学杂志,2010,31(2):133 -136.
[5]李秀文,张毅华,刘毅.2006 与2007年ICU 病房铜绿假单胞菌耐药性分析[J].国际检验医学杂志,2009,30(5):439-441.
[6]梅同华.2002 ~2004年我院院内获得性肺炎致病菌及药敏分析[J].重庆医科大学学报,2007,32(2):166 -175.
[7]刘洋,杜德明,李晓芳,唐立等.小鼠肠道菌群失衡模型建立[J].中国微生态学杂志,2010,22(4):293 -295.
[8]Sun H,Fujitani S,Quintiliani R,et al.Pneumonia due to Pseudomonas aeruginosa:part II:antimicrobial resistance,pharmacodynamic concepts,and antibiotic therapy [J].Chest,2011,139(5):1172 -1185.
[9]王炜芳,方向群,刘又宁.大鼠肺部铜绿假单胞菌慢性感染模型的建立与评价[J],解放军医学杂志,2007,32(5):470-472.
[10]于柏峰,谷海瀛,袁素,等.铜绿假单胞菌肺感染动物模型的建立及相关炎症反应分析[J].中华微生物学和免疫学杂志,2010,30(8):717 -721.
[11]朱松雷,丁凤鸣,沈策.小鼠铜绿假单胞菌慢性肺部感染树突状细胞的功能变化[J].中国医药导报,2011,8(26):16-18.
[12]李斌,冬青,刘士远,等.铜绿假单胞菌家兔肺部感染模型的建立与评价[J].现代生物医学进展.2012,12(12):2231-2234.
[13]周雨朦,陈代杰,朱春宝,等.秀丽隐杆线虫-耐药铜绿假单胞菌感染模型的建立[J].中国抗生素杂志,2011,36(7):511 -514.
[14]Apidianakis Y,Rahme LG.Drosophila melanogaster as a model host for studying Pseudomonas aeruginosa infection[J].Nature Protocols,2009,4(9):1285 -1294.
[15]Limmer,S,Haller S,Drenkard E,et al.Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model[J].Proc Natl Acad Sci USA,2011,108(42):17378 -17383.
[16]Alverdy J,Holbrook C,Rocha F,et al.Gut-derived sepsis occurs when the right pathogen with the right virulence genes meets the right host:evidence for in vivo virulence expression in Pseudomonas aeruginosa[J].Ann Surg,2000,232(4):480 -489.
[17]Zaborina Z,Kohler JE,Alverdy JC,et al.Identification of multi-drug resistant Pseudomonas aeruginosa clinical isolates that are highly disruptive to the intestinal epithelial barrier[J].Annals Clin Microbiol Antimicrob,2006,5:14.
[18]Long J,Zaborina O,Holbrook C,et al.Depletion of intestinal phosphate after operative injury activates the virulence of P.aeruginosa causing lethal gut-derived sepsis[J].Surgery,2008,144(2):189 -197.
[19]张果,伦明辉,邹原,等.禁食降低肠黏膜屏障的形态学观察及对肠道细菌易位的影响[J].大连医科大学学报,2003,25 (1):25 -27.

