晚期胆管癌立体定向放疗的临床分析
赵向飞 康静波 路泽军 方恒虎 朱 奇 房 娟 吴珊珊
晚期胆管癌立体定向放疗的临床分析
赵向飞① 康静波① 路泽军① 方恒虎① 朱 奇① 房 娟① 吴珊珊①

目的:总结分析晚期胆管癌患者临床病理因素,观察立体定向放射治疗晚期胆管癌的近期疗效及生存时间,探讨立体定向放疗在晚期胆管癌治疗中的作用。方法:选择在海军总医院接受体部伽玛刀治疗的58例晚期胆管癌患者,对其临床资料进行回顾性分析。结果:随访率为100%,全组患者近期疗效评估:完全缓解(CR)8例,部分缓解(PR)30例,病情稳定(SD)15例,临床获益率(CBR)为91.4%。有11例患者发生Ⅰ~Ⅱ级胃肠道反应,主要表现为食欲下降、恶心及呕吐,发生率为19.0%,13例出现腹痛,发生率为22.4%;4例患者发生发热,发生率为6.8%。结论:体部伽玛刀是治疗晚期胆管癌的有效方式,不良反应可耐受。
胆管细胞癌;立体定向放疗;体部伽玛刀
[First-author’s address]Navy General Hospital Radio-oncology Department, Beijing 100048, China.
肝脏恶性肿瘤包括肝细胞癌(hepatocellular carcinoma)和胆管细胞癌(cholangiocarcinomas),而胆管细胞癌约占胃肠道肿瘤的3%,只有≤30%的患者能够接受手术治疗,仅给予内科治疗的患者总生存期约3~4个月,即便接受手术切除,总生存期约12~22个月[1-2]。
近年来,放射治疗技术在飞速发展,出现了立体定向放射治疗(射波刀、伽玛刀)、三维适形放射治疗和调强放疗。立体定向放射治疗联合灌注化疗治疗晚期胆管癌,患者可以达到13.3个月的中位生存期[3]。本研究对58例晚期胆管癌患者资料进行回顾性分析,就体部伽玛刀立体定向放疗(stereotactic body radiation therapy,SBRT)治疗晚期胆管癌的疗效进行探讨。
1 资料与方法
1.1 临床资料
选取2006年1月至2012年12月在海军总医院接受SBRT治疗的58例晚期胆管癌患者临床资料,其中男性35例,女性23例;年龄为36~77岁,中位年龄为60岁。其中经病理诊断34例,经临床及影像学诊断24例;29例治疗前存在黄疸,血清总胆红素32.4~372.1 mol/L(正常参考值0~23.5 mol/L),平均157.4 mol/L,23例SBRT治疗前行ERCP或PTCD引流胆汁(见表1)。
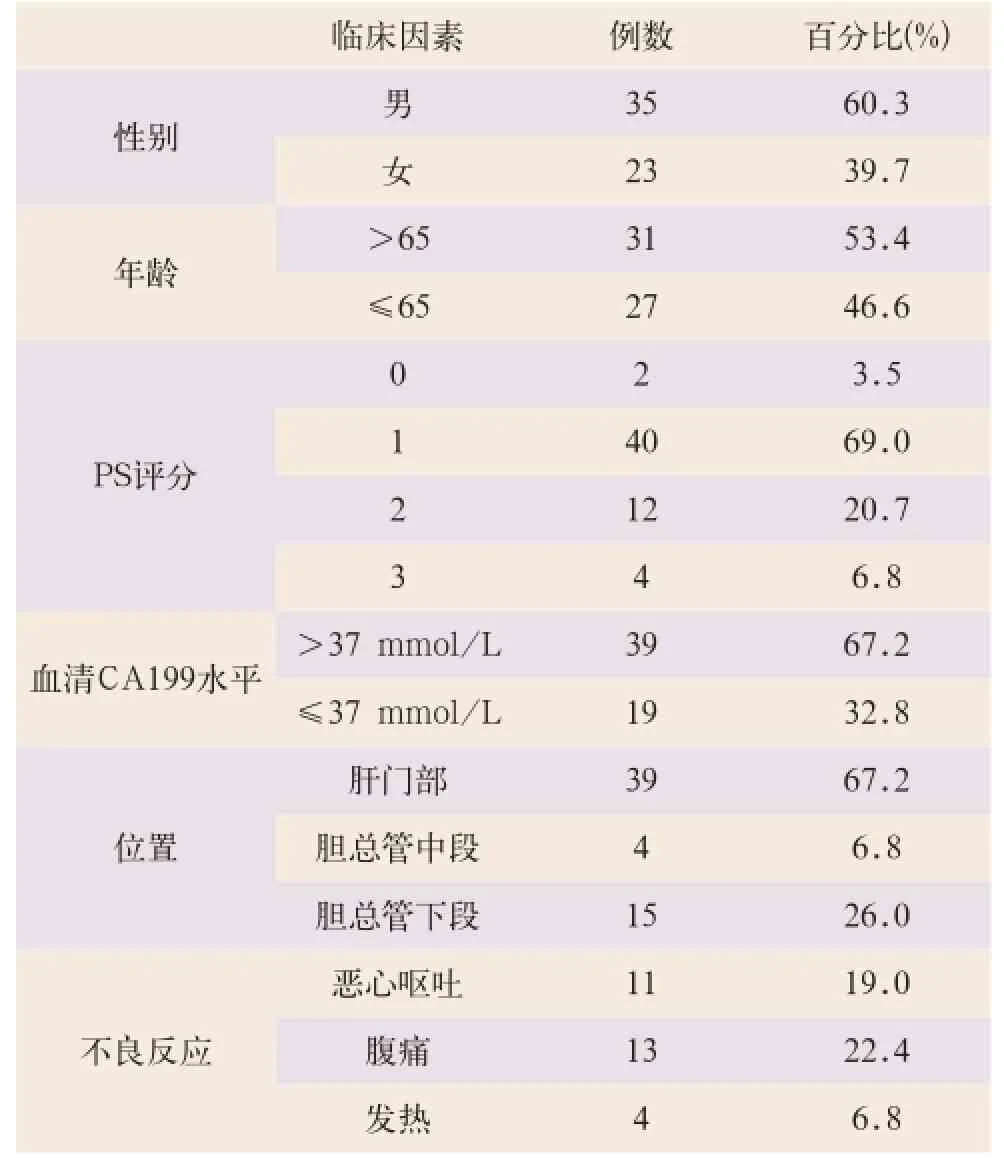
表1 58例晚期胆管癌患者临床病理因素
1.2 治疗方法
患者双手抱头仰卧于真空负压袋体部定位框架内,以腹带加压限制呼吸运动,CT以3~5 mm层距扫描病灶,记录N型尺值、重复定位尺值及患者体表标记点的X、Y、Z坐标参数,仔细核准后,将获得的图像资料和相关数据输入治疗计划系统进行三维重建,勾画肿瘤靶区及计划靶区,用50%~70%等剂量曲线包绕计划靶区,分割剂量2.8~4.5 Gy/次,治疗次数为10~11次,总剂量(DT)30.8~49.5 Gy,每日或隔日治疗(见表2)。

表2 体部伽玛刀治疗参数
1.3 疗效评价
治疗后4周和治疗前比较,按影像学上肿瘤大小变化评价SBRT治疗的近期疗效。①完全缓解(CR):肿瘤在CT或MRI片上完全消失;②部分缓解(PR):肿瘤较治疗前缩小>50%,但未消失;③稳定(SD):肿瘤较治疗前<50%以下,或>25%以下;④进展(PD):肿瘤较治疗前>25%以上。以CR+PR+SD计算临床获益率(CBR)。
2 结果
2.1 随访情况
全部患者均完成治疗,每3个月随访1次,随访截止时间为2012年12月31日,随访时间4~82个月,中位随访时间13个月,随访率为100%。
2.2 肿瘤近期疗效
CR8例,PR30例,SD15例,临床获益率为91.4%。
2.3 不良反应
本组患者有11例发生Ⅰ~Ⅱ级胃肠道反应,主要表现为食欲下降、恶心及呕吐,发生率为19.0%;13例出现腹痛,发生率为22.4%;4例发热,发生率为6.8%。
2.4 生存状况
58例患者12个月的生存率为62.1%,中位生存期(median survival time,MST)为13.9个月,如图1所示。
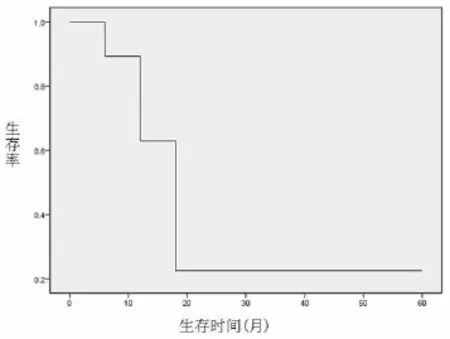
图1 58例晚期胆管癌生存曲线
3 讨论
胆管癌发病率在肝脏原发肿瘤中排名第2,发病率为1/10万~2/10万[4]。胆管癌的确切病因学是未知的,明确的危险因素,包括原发性硬化性胆管炎、肝吸虫感染、先天性肝脏多囊性病及肝内胆管结石[5]。
近年来的研究表明,肝炎病毒感染与胆管癌发病关系密切,丙型肝炎病毒是胆管癌的危险因素,尤其是与肝内胆管癌发病有关[6]。东方人群中乙型肝炎病毒是肝内胆管癌的危险因素[7]。胆管癌最常发生在肝门部,其中肝门部胆管癌约占50%,胆总管下段约占40%,胆总管中段≤10%[8]。
本研究中肝门部胆管癌39例,占67.2%;胆总管下段15例,占26%;胆总管中段4例,占6.8%,同国外的研究相一致,肝门部胆管癌最为常见。胆管癌的病理类型包括腺癌、鳞癌、印戒细胞癌及未分化癌,腺癌是最常见的组织学类型,其特点是管状和乳头状结构及多种纤维间质[9]。胆管癌目前尚无特异性的肿瘤学指标,常用的CA199特异性和敏感性分别为62%和63%,但不可切除的患者CA199水平显著高于可切除患者[10]。
本研究中CA199水平偏高者39例,占67.2%,对胆管癌的诊断具有参考价值。近期的研究表明,血清中基质金属蛋白酶-7和M2-PK14较CA199对于区别良恶性胆管占位具有更好的敏感性[11-12]。
放疗是胆管癌的重要治疗手段之一,包括外放疗和立体定向放疗,Gwak等[13]对照了切缘阳性胆管癌患者术后放疗和单纯手术治疗的无病生存期,发现术后放疗优于单纯手术治疗,迄今为止尚无前瞻性随机研究表明外放疗有益于晚期胆管癌患者,患者经外放疗后1年的生存率为36.1%~73%[14]。Ghafoori等[15]观察了21例不能切除的胆管下段癌的外照射放疗疗效,其总生存率和局部控制率在1年及2年,分别为59%和90%以及22%和71%。Shinohara等[16]回顾分析总结了来自SEER数据库、流行病学调查及患者随访来源的3839例患者,辅助放疗和根治性放疗能够延长生存时间,但治愈率仍然较低。
近年来,立体定向放射治疗在国内外得到了迅速发展,立体定向放疗已经成为晚期不可切除肝癌及肺癌的有效治疗方式[17]。立体定向放疗治疗晚期胆管癌也取得了显著的疗效,人们对不同的分割方式进行了探索,Herfarth等[18]使用立体定向放疗治疗37例肝癌患者,其中包括3例胆管癌患者,1次给予剂量14~26 Gy,采用80%等剂量曲线覆盖肿瘤靶区,肿瘤直径≤6 mm,1年生存率为71%。Tse等[19]观察了立体定向放射治疗10例晚期胆管癌患者疗效,放疗总剂量32.5 Gy,分割次数6次,1年生存率为65%,中位生存期15个月。Barney等[20]观察10例不能切除胆管癌患者,给予立体定向放疗中位处方剂量DT 55 Gy(45~60 Gy/3~5 f),6个月和12个月的总生存率分别为83%和73%。
体部伽玛刀是国内主要立体定向放疗方式之一,其剂量聚集效率高,空间三维聚焦照射方式效率高,由于靶区内外剂量差异,靶区内高剂量,靶区外低剂量,靶区外剂量下降陡峭,低剂量范围小,和其他放疗技术相比,放射毒副作用更小。本研究采用50%~70%等剂量曲线包绕计划靶区,分割剂量2.8~4.5 Gy/次, 治疗次数为10~11次,12个月的生存率为62.1%,中位生存期为13.9个月,与国外研究类似。
近年来,人们采用同步放化疗治疗晚期胆管癌在一定程度上延长了生存期,Crane等[21]在一项Ⅱ期临床试验中,观察了128例肝脏恶性肿瘤患者,其中包括46例胆管癌患者,采用氟尿嘧啶动脉灌注化疗联合放疗,中位生存期为15.8个月。Park等[22]将S-1作为放疗增敏剂,联合SBRT(DT 45 Gy/5f)治疗1例73岁进展期胆管癌患者,随访8个月无肿瘤进展。Polistina等[23]采用SBRT联合吉西他滨治疗10例晚期胆管癌,总剂量DT 30 Gy,分割次数3次,患者中位进展时间为30个月,2年和4年生存率为80%和30%。
治疗过程中恶心、呕吐是常见的急性不良反应,Kopek等[24]观察了26例立体定向放射(DT 45 Gy/3 f)治疗的晚期胆管癌患者,其中11%的患者出现急性不良反应,25%出现迟发不良反应,包括十二指肠溃疡和狭窄,中位无进展生存期和总生存期分别为6.7个月和10.6个月。本研究中主要不良反应为消化道反应,表现为腹痛、恶心及呕吐,腹痛考虑与放疗引起的局部水肿有关。放射性肝损伤是另外一个需要考虑的不良反应,临床正常组织效应定量分析(QUANTEC)推荐立体定向放疗分割次数为3次时,肝脏平均受量应<13 Gy,放疗分割次数为6次时,肝脏平均受量应<18 Gy[25]。
4 结语
体部伽马刀是中国具有自主知识产权的立体定向放射治疗设备,本研究使用体部伽玛刀治疗晚期胆管癌取得了与国外研究相似的生存时间,不良反应可耐受,是治疗晚期胆管癌的有效方式,但合并化疗能否进一步延长生存时间尚需探索。
[1]Daines WP,Rajagopalan V,Grossbard ML,et al.Gallbladder and biliary tract carcinoma:A comprehensive update,Part 2[J].Oncology(Williston Park),2004,18(8):1049-1059.
[2]Endo I,Gonen M,Yopp A C,et al.Intrahepaticcholangiocarcinoma:rising fequency,improved survival,and determinants of outcome after resection[J].Ann Surg,2008,248(1):84-96.
[3]Ben-Josef E,Normolle D,Ensminger WD,et al.Phase II trial of high-dose conformal radiation therapy with concurrent hepatic artery floxuridine for unresectable intrahepatic malignancies[J].J Clin Oncol,2005,23(34):8739-8747.
[4]Anderson CD,Pinson CW,Berlin J,et al.Diagnosis and treatment of cholangiocarcinoma[J]. Oncologist,2004,9(1):43-57.
[5]Khan SA,Toledano MB,Taylor-Robinson SD.Epidemiology,risk factors,and pathogenesis of cholangiocarcinoma[J].HPB(Oxford),2008,10(2):77-82.
[6]El-Serag HB,Engels EA,Landgren O,et al.Risk of hepatobiliary and pancreatic cancers after hepatitis C virus infection:A population-based study of U.S.veterans[J].Hepatology,2009,49(1):116-123.
[7]Lee TY,Lee SS,Jung SW,et al.Hepatitis B virus infection and intrahepatic cholangiocarcinoma in Korea:a case-control study[J].Am J Gastroe nterol,2008,103(7):1716-1720.
[8]DeOliveira ML,Cunningham SC,Cameron JL,et al.Cholangiocarcinoma:thirty-oneyear experience with 564 patients at a single institution[J].Ann Surg,2007,245(5):755-762.
[9]Nakanuma Y,Xu J,Harada K,et al.Pathological spectrum of intrahepatic cholangiocarcinoma arising in non-biliary chronic advanced liver diseases[J].Pathol Int,2011,61(5):298-305.
[10]Patel AH,Harnois DM,Klee GG,et al.The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis[J]. Am J Gastroenterol,2000,95(1):204-207.
[11]Leelawat K,Sakchinabut S,Narong S,et al.Detection of serum MMP-7 and MMP-9 in cholangiocarcinoma patients:evaluation of diagnostic accuracy[J].BMC Gastroenterol,2009,30(9):30.
[12]Li YG,Zhang N.Clinical significance of serum tumour M2-PK and CA19-9 detection in the diagnosis of cholangiocarcinoma[J].Dig Liver Dis,2009,41(8):605-608.
[13]Gwak HK,Kim WC,Kim HJ,et al.Extrahepatic bile duct cancers: surgery alone versus surgery plus postoperative radiation therapy[J].Int J Radiat Oncol Biol Phys,2010,78(1):194-198.
[14]Chen YX,Zeng ZC,Tang ZY,et al.Determining the role of external beam radiotherapy in unresectable intrahepatic cholangiocarcinoma:a retrospective analysis of 84 patients[J].BMC Cancer,2010,14(10):492.
[15]Ghafoori AP,Nelson JW,Willett CG,et al.Radiotherapy in the treatment of patients with unresectable extrahepatic cholangiocarcinoma[J].Int J Radiat Oncol Biol Phys,2011,81(3):654-659.
[16]Shinohara ET,Mitra N,Guo M,et al.Radiation therapy is associated with improved survival in the adjuvant and definitive treatment of intrahepatic cholangiocarcinoma[J].Int J Radiat Oncol Biol Phys,2008,72(5):1495-1501.
[17]Chang BK,Timmerman RD.Stereotactic body radiation therapy:a comprehensive review[J]. Am J Clin Oncol,2007,30(6):637-644.
[18]Herfarth KK,Debus J,Lohr F,et al.Stereotactic single-dose radiation therapy of liver tumors:results of a phase I/II trial[J].J Clin Oncol,2001,19(1):164-170.
[19]Tse RV,Hawkins M,Lockwood G,et al.Phase I study of individualized stereotactic body radiotherapy for hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J].J Clin Oncol,2008,26(4):657-664.
[20]Barney BM,Olivier KR,Miller RC,et al.Clinical outcomes and toxicity using stereotactic body radiotherapy(SBRT)for advanced cholangiocarcinoma[J].Radiat Oncol,2012,3(7):67.
[21]Crane CH,Macdonald KO,Vauthey JN,et al.Limitations of conventional doses of chemoradiation for unresectable biliary cancer[J].Int J Radiat Oncol Biol Phys,2002,53(4):969-974.
[22]Park JS,Lee DH,Jeong S,et al.Concurrent chemoradiation in a patient with unresectable cholangiocarcinoma[J].Gut Liver,2010,4(1):103-105.
[23]Polistina FA,Guglielmi R,Baiocchi C,et al.Chemoradiation treatment with gemcitabine plus stereotactic body radiotherapy for unresectable,non-metastatic,locally advanced hilar cholangiocarcinoma.Results of a five year experience[J].Radiother Oncol,2011,99(2):120-123.
[24]Kopek N,Holt MI,Hansen AT,et al.Stereotactic body radiotherapy for unresectable cholangiocarcinoma[J]. Radiother Oncol,2010,94(1):47-52.
[25]Pan CC,Kavanagh BD,Dawson LA,et al.Radiation-associated liver injury[J].Int J Radiat Oncol Biol Phys,2010,76(3 Suppl):S94-S100.
Analysis of clinical characteristics of SBRT treatment for 58 cases with cholangiocarcinoma/
ZHAO Xiang-fei, KANG Jing-bo, LU Ze-jun, et al// China Medical Equipment,2014, 11(6):118-121.
Objective:We analyze the clinical and pathological factors in patients with advanced cholangiocarcinoma, summarize the efficacy and survival time of stereotactic radiotherapy for advanced cholangiocarcinoma and explore the efficacy of stereotactic radiotherapy.Methods:From January 2006 -2012,total 58 patients in our hospital were treated by body gamma knife, all patients were given body gamma knife governance.Results:The follow-up rate was 100%, the efficacy of whole group of patients were assessed,with CR 8 cases, PR 30 cases, SD 15 cases, clinical benefit rate was 91.4%, Adverse reactions included gastrointestinal reactions of 11 cases ,mainly as appetite, nausea, vomiting, by incidence rate of 19.0%, abdominal pain of 13 cases, by the incidence of 22.4%, fever occurred in 4 patients, the rate was 6.8%.Conclusion:Body gamma knife is an effective treatment for advanced cholangiocarcinoma,and adverse reactions can be tolerated.
Cholangiocarcinoma; Stereotactic radiotherapy; Gamma knife
10.3969/J.ISSN.1672-8270.2014.06.042
1672-8270(2014)06-0118-04
R735.8
A
2014-01-20
①海军总医院放疗科 北京 100048
赵向飞,男,(1977- ),硕士,主治医师。海军总医院放疗科,研究方向:消化道肿瘤的综合治疗。