散发性结直肠癌组织p33ING1b启动子甲基化情况及其意义
张磊昌,何纯钢,曹云飞,钟 武,钟世彪,龙军先,黄永红,陈利生
结直肠癌是消化系统常见的恶性肿瘤,其发病率位居全球恶性肿瘤的第三位[1],且其发病率从1992年以来每年以1.2%的速度升高[2]。原卫生部统计数据显示,我国结直肠癌病死率位居恶性肿瘤第五位,发病率亦呈逐年上升趋势[3]。结直肠癌的发生、发展是一个多步骤的、涉及遗传和表观遗传变化积累的复杂过程[4]。甲基化是表观遗传学多种作用机制中研究得最为广泛和深入的一种,其与基因的表达抑制和功能丧失有关[5],在结直肠癌的发生、发展过程中发挥着重要作用[6]。既往研究表明,散发性结直肠癌组织p33ING1b启动子存在高甲基化现象[7]。p33ING1b是抑癌基因ING1编码的4种蛋白之一,近年来已成为研究热点[8]。本研究通过检测散发性结直肠癌组织p33ING1b启动子甲基化情况,分析其与患者临床病理特征及p33ING1b mRNA表达水平的关系,并进行5-氮-2-脱氧胞苷(5-aza-dC)干预实验,旨在探讨p33ING1b在散发性结直肠癌中转录抑制的可能机制,为结直肠癌的诊断和治疗提供新的靶点。
1 材料与方法
1.1 实验材料
1.1.1 标本来源 选择2008年10月—2012年3月在广西医科大学第一附属医院结直肠肛门外科住院的散发性结直肠癌患者63例,均行结直肠癌根治术并经病理检查证实,取其癌组织及相应癌旁组织切除标本。63例患者中男36例,女27例;年龄24~81岁,中位年龄58岁;结肠癌28例,直肠癌35例;Dukes分期:A/B期24例,C/D期39例;分化程度:高、中分化腺癌37例,低分化腺癌26例;26例有淋巴结转移,7例有远处转移。同时选择在我院行吻合器痔上黏膜环切术(PPH)患者13例,收集其术后痔上黏膜组织,均经结肠镜检查证实结直肠黏膜无异常。所有样本获取过程获得患者本人同意及本院伦理委员会批准。
1.1.2 细胞株 人结直肠癌细胞株DLD-1、Caco-2均购自中国科学院上海生命科学研究院细胞资源中心。
1.1.3 主要仪器和试剂 5-aza-dC购自Sigma公司,亚硫酸氢钠(NaHSO3)购自S9000 Sigma公司,细胞培养基(高糖DMEM,1640)购自Hyclone公司,TRIzol购自Invitrogen公司,Long Taq DNA聚合酶购自北京天根生物公司,反转录试剂盒购自MBI Fermentas公司;多通道PCR仪(PTC-220)购自MJ Research公司,凝胶电泳图像分析系统(Gel Doc 2000型)购自Bio-Rad公司,紫外分光光度计购自Pharmacia公司。
1.2 实验方法
1.2.1 p33ING1b启动子甲基化检测 采用巢式-甲基化特异性PCR(nMSP法):(1)蛋白酶K消化、酚/氯仿抽提、乙醇沉淀,提取癌组织、癌旁组织、痔上黏膜组织DNA,计算DNA浓度及OD260/OD280比值,检测DNA纯度;(2)严格按照Methyl Detector Bisulfite Modification Kit说明书步骤对DNA进行NaHSO3修饰及纯化;(3)参照文献[9]并采用Primer软件设计引物,由上海生物工程技术有限公司合成引物序列(见表1);(4)PCR反应:第一轮采用修饰的琼脂糖珠DNA作为模板,使用巢式引物进行PCR,循环参数:预变性94 ℃ 4 min,94 ℃变性30 s、53 ℃退火30 s、72 ℃延伸30 s共35个循环,72 ℃延伸5 min,第二轮模板为第一轮PCR产物,选用甲基化/非甲基化引物进行PCR,循环参数:预变性94 ℃ 4 min,94 ℃变性30 s、62.5 ℃退火30 s、72 ℃延伸25 s共35个循环,72 ℃延伸5 min;(5)PCR产物分析:将第二轮PCR产物在2.5%琼脂糖凝胶上进行电泳分离,采用凝胶电泳图像分析系统进行观察并照相。
表1 p33ING1b启动子巢式-甲基化特异性PCR和RT-PCR引物序列
Table1 Primer sequence of p33ING1b for nested methylation PCR and RT-PCR

引物名称引物序列引物长度(bp)巢式-甲基化特异性PCR引物(上游)5′-AGATAAGGTTTAGGGAAGGYGTT-3′441巢式-甲基化特异性PCR引物(下游)5′-AACAACCRCAATAACCAATCTACT-3′甲基化引物(上游)5′-CGGATGGCGTAGGCGCGGGAGTC-3′151甲基化引物(下游)5′-CCGAACACGAACGAAAATAACGACGC-3′非甲基化引物(上游)5′-TGGATGGTGTAGGTGTGGGAGTT-3′151非甲基化引物(下游)5′-CCAAACACAAACAAAAATAACAACACA-3′RT-PCR引物(上游)5′-CTCGTAGCACTCGTCTAGCTCCTT-3′103RT-PCR引物(下游)5′-GAGTCCCTGCCTTTCGACTTG-3′β-actinRT-PCR引物(上游)5′-CACAGAGCCTCGCCTTTGCC-3′106β-actinRT-PCR引物(下游)5′-CACATGCCGGAGCCGTTGTC-3′
1.2.2 癌组织p33ING1b mRNA表达水平 以TRIzol一步法抽提癌组织细胞总RNA,取总RNA 3 μg,采用RT-PCR反转录试剂盒,再以反转录反应液2 μl作为模板,对p33ING1b mRNA表达水平进行半定量PCR检测,以β-actin为内参基因(引物序列见表1),取PCR扩增产物4 μl在2.0%琼脂糖凝胶上进行电泳。
1.2.3 5-aza-dC干预实验 取对数生长期人结直肠癌细胞株DLD-1、Caco-2,采用0.02% EDTA+0.25%胰酶消化,反复吹打制成单细胞悬液,以每孔2×105个接种于6孔板中,次日更换为含10 μM 5-aza-dC的DMEM培养基,每24 h更换含10 μM 5-aza-dC培养液,以未用10 μM 5-aza-dC处理的细胞作为对照组,96 h后提取细胞总RNA。人结直肠癌细胞株DLD-1、Caco-2的p33ING1b启动子甲基化检测和mRNA表达水平检测方法同上。

2 结果
2.1 p33ING1b启动子甲基化情况 采用nMSP法成功扩增出癌组织、癌旁组织、痔上黏膜组织甲基化及非甲基化条带,对PCR产物进行测序证实所扩增片段为目的片段(见图1)。癌组织p33ING1b启动子甲基化阳性率为82.5%(52/63),癌旁组织为34.2%(27/63),均为不完全甲基化;痔上黏膜组织未检测出p33ING1b启动子甲基化(见图2)。癌组织、癌旁组织、痔上黏膜组织p33ING1b启动子甲基化阳性率比较,差异有统计学意义(χ2=39.1,P<0.001);且癌组织p33ING1b启动子甲基化阳性率高于癌旁组织和痔上黏膜组织,差异均有统计学意义(χ2=21.21,P<0.001;χ2=33.98,P<0.001)。
2.2 p33ING1b启动子甲基化与患者临床病理特征的关系 不同性别、年龄、肿瘤位置、分化程度及有无淋巴结转移、远处转移患者癌组织p33ING1b启动子甲基化阳性率比较,差异均无统计学意义(P>0.05);不同Dukes分期患者癌组织p33ING1b启动子甲基化阳性率比较,差异有统计学意义(P<0.05,见表2)。
2.3 p33ING1b启动子甲基化与癌组织p33ING1b mRNA表达水平的关系 p33ING1b启动子甲基化癌组织p33ING1b mRNA相对表达量为(0.62±0.15),低于p33ING1b启动子非甲基化癌组织的(0.75±0.17),差异有统计学意义(t=2.553,P<0.05)。
2.4 5-aza-dC干预结果 5-aza-dC干预后,人结直肠癌细胞株DLD-1、Caco-2的p33ING1b启动子甲基化均被逆转(见图3),两者p33ING1b mRNA相对表达量较干预前升高,差异均有统计学意义(P<0.05,见表3)。
表2 p33ING1b启动子甲基化与患者临床病理特征的关系〔n(%)〕
Table2 Correlation between promoter methylation of p33ING1b and clinical pathology characteristics
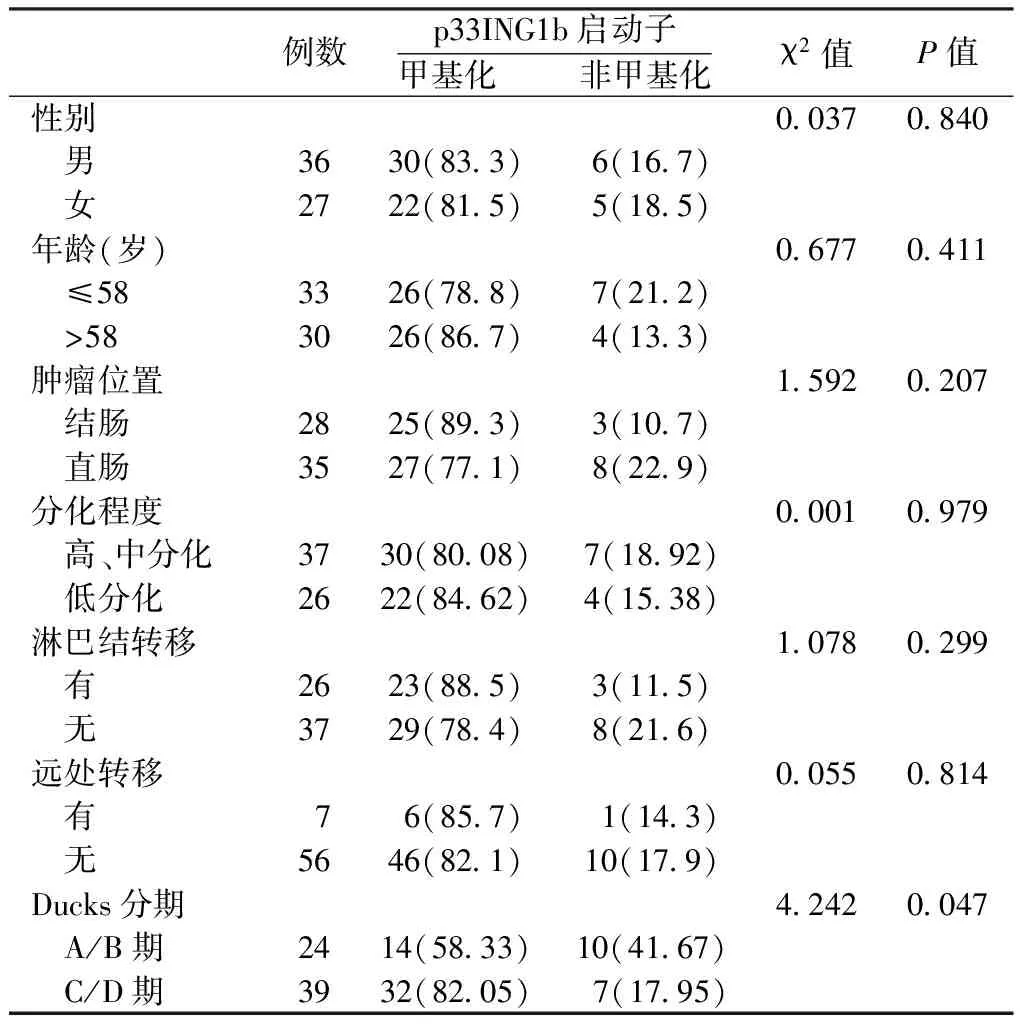
例数p33ING1b启动子甲基化 非甲基化χ2值P值性别00370840 男3630(833)6(167) 女2722(815)5(185)年龄(岁)06770411 ≤583326(788)7(212) >583026(867)4(133)肿瘤位置15920207 结肠2825(893)3(107) 直肠3527(771)8(229)分化程度00010979 高、中分化3730(8008)7(1892) 低分化2622(8462)4(1538)淋巴结转移10780299 有2623(885)3(115) 无3729(784)8(216)远处转移00550814 有 7 6(857) 1(143) 无5646(821)10(179)Ducks分期42420047 A/B期2414(5833)10(4167) C/D期3932(8205) 7(1795)
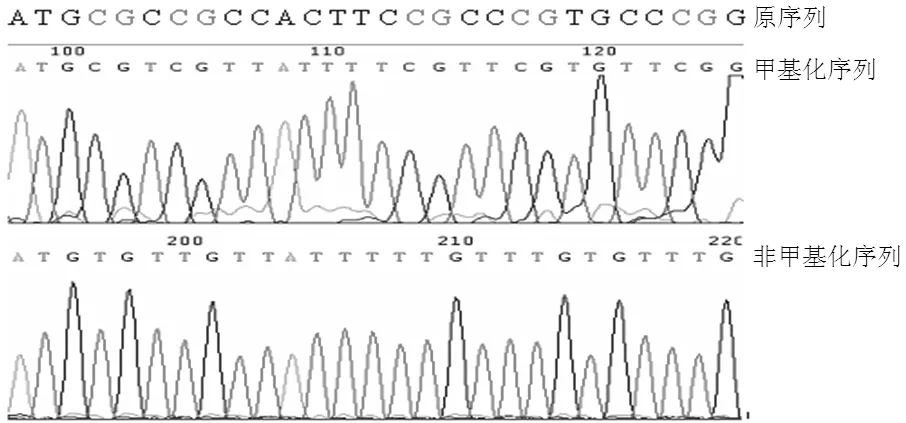
图1 巢式-甲基化特异性PCR产物直接测序结果

Table3 Comparison of relative expression of p33ING1b in DLD-1 and Caco-2 cells before and after interference of 5-aza-dC
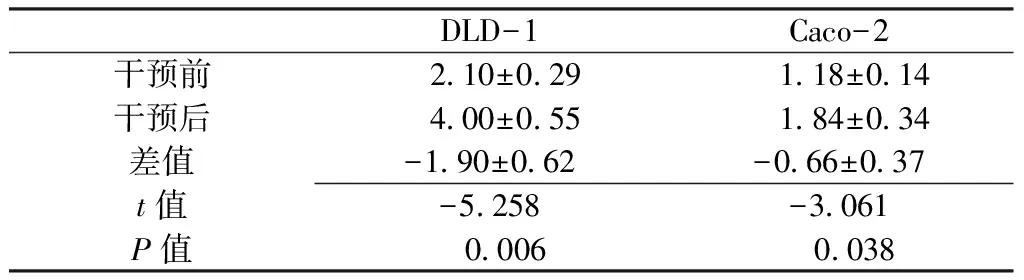
DLD-1Caco-2干预前 210±029 118±014干预后 400±055 184±034差值-190±062-066±037t值-5258-3061P值 0006 0038
3 讨论
Campus等[10]研究表明,p33ING1b与细胞生长增殖抑制、凋亡,肿瘤非依赖性生长、衰老,基因组稳定性维持等存在一定的关联。既往研究显示,p33ING1b在人类结直肠癌组织中表达下降,但突变、杂合性缺失非常少见,其表达下降并不是p33ING1b转录抑制的主要原因[11-12]。结直肠癌[7]、卵巢癌[9]中p33ING1b存在高甲基化现象,但目前尚无有力证据支持p33ING1b启动子甲基化为结直肠癌中p33ING1b转录抑制的原因。
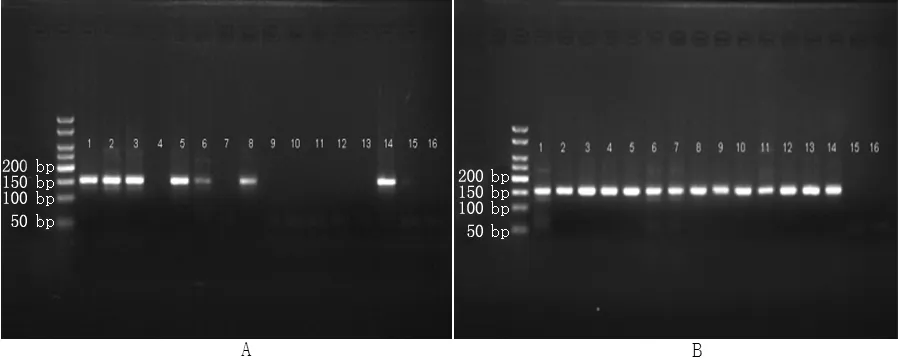
注:A为甲基化,B为非甲基化;1、2、3、4、5为癌组织,6、7、8、9、10为癌旁组织,11、12、13为痔上黏膜组织,14、15、16分别为阳性对照、阴性对照、空白对照
图2 癌组织、癌旁组织、痔上黏膜组织p33ING1b启动子甲基化PCR产物电泳图
Figure2 Electrophoretogram of p33ING1b PCR products in tumor,adjacent tissue and normal mucosa tissue
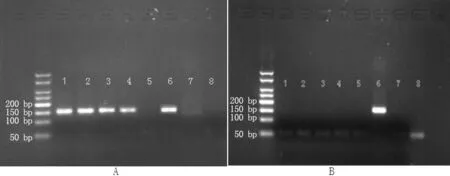
注:A为干预前,B为干预后;1、2为人结直肠癌细胞株DLD-1,3、4、5为人结直肠癌细胞株Caco-2,6、7、8分别为阳性对照、阴性对照、空白对照
图3 5-aza-dC干预前后人结直肠癌细胞株DLD-1、Caco-2的p33ING1b启动子甲基化情况
Figure3 Condition of promoter methylation of p33ING1b in DLD-1 and Caco-2 cells before or after interference of 5-aza-dC
本研究结果显示癌组织p33ING1b启动子甲基化阳性率高于癌旁组织和痔上黏膜组织,提示p33ING1b启动子甲基化与散发性结直肠癌的发生发展存在关联。曹云飞等[7]研究显示,结直肠癌组织p33ING1b启动子甲基化阳性率为48.33%,本研究为82.5%,存在较大差异,分析其原因可能在于采用的检测方法不同,曹云飞等[7]采用的是甲基化特异性PCR(MSP),本研究采用的是nMSP法,而前者的检测敏感度远不如nMSP法[13]。本研究对p33ING1b启动子甲基化与患者临床病理特征的关系进行分析发现,其与患者性别、年龄、肿瘤位置、分化程度及淋巴结转移、远处转移无关,仅与Dukes分期有关;对p33ING1b启动子甲基化与癌组织p33ING1b mRNA表达水平的关系进行分析发现,p33ING1b启动子甲基化癌组织p33ING1b mRNA相对表达量低于p33ING1b启动子非甲基化癌组织。进一步行5-aza-dC干预实验发现,5-aza-dC可有效逆转人结直肠癌细胞株DLD-1、Caco-2的甲基化,并显著上调p33ING1b mRNA表达水平,提示p33ING1b启动子甲基化可能是导致p33ING1b基因转录抑制的原因。刘丽乔等[14]的研究也表明5-aza-dC对人结肠癌细胞株Caco-2中P16基因启动子具有去甲基化作用,并可使其mRNA重新表达。
综上所述,p33ING1b启动子甲基化与散发性结直肠癌存在关联,并可能通过抑制p33ING1b mRNA的表达参与结直肠癌的发生和发展;5-aza-dC能有效逆转人结直肠癌细胞株DLD-1、Caco-2的甲基化,并上调p33ING1b mRNA表达水平,这为结直肠癌的诊断和去甲基化治疗提供了一定的实验依据。
1 Jemal A,Brav F,Center MM,et al.Global cancer statistics[J].Ca Cancer J Clin,2011,61(2):69-90.
2 Migliore L,Migheli F,Spisni R,et al.Genetics,cytogenetics,and epigenetics of colorectal cancer[J].J Biomed Biotechnol,2011,2011:792362.
3 卫生部.2011年中国卫生统计提要[R].2011.
4 Lao VV,Grady WM.Epigenetics and colorectal cancer[J].Nat Rev Gastroenterol Hepatol,2011,8(12):686-700.
5 Laird PW.Principles and challenges methylation analysis of genome-wide DNA[J].Nat Rev Genet,2010,11(3):191-203.
6 Jensen LH,Lindebjerg J,Byriel L,et al.Strategy in clinical practice for classification of unselected colorectal tumours based on mismatch repair deficiency[J].Colorectal Disease,2008,10(5):490-497.
7 曹云飞,陈利生,高枫.ING1启动子甲基化在散发性结直肠癌中的研究[J].中华实验外科,2005,22(12):1554.
8 Saito A,Furukawa T,Fukushige S,et al.p24/ING1-ALT1 and p47/ING1-ALT2,distinct alternative transcripts of p33/ING1[J].J Hum Genet,2000,45(3):177-181.
9 Shen DH,Chan KY,Khoo US,et al.Epigenetic and genetic alterations of p33ING1b in ovarian cancer[J].Carcinogenesis,2005,26(4):855-863.
10 Campus EI,Chin MY,Kuo WH,et al.Biological functions of the ING family tumor suppressors[J].Cell Mol Life Sci,2004,61(19):2597-2613.
11 Chen LS,Wei JB,Zhou YC,et al.Genetic alterations and expression of inhibitor of growth 1 in human sporadic colorectal cancer[J].World J Gastroenterol,2005,11(39):6120-6124.
12 Wei JB,Chen LS,Gao F.Mutation,loss of heterozygosity,and expression of tumor suppressor gene ING1 in sporadic colorectal carcinoma[J].Ai Zheng,2005,24(2):141-144.
13 何纯刚,陈利生,曹云飞,等.p33生长抑制基因1b启动子甲基化检测方法的建立与评价[J].中华实验外科,2009,26(7):945.
14 刘丽乔,罗达雅,付晶晶,等.5-Aza-CdR对人结肠癌Caco-2细胞株P16基因甲基化状态及其生物学表型的影响[J].基础医学与临床,2011,31(2):161-165.

