重组组织型纤溶酶原激活剂静脉溶栓治疗急性缺血性脑卒中疗效及安全性的Meta分析
殷文明,张小宁
缺血性脑卒中是西方国家人群的第三大死因,也是导致永久性残疾的最常见原因。美国每年大约有795 000例患者入院,15%~30%的患者会遗留有永久性残疾,并有14%~27%的患者在1年内死亡。2010年直接和间接用于脑卒中的治疗费用高达737亿美元[1]。美国国立神经性疾病和卒中研究所在1992年提出,重组组织型纤溶酶原激活剂(rt-PA)是一种有效、安全的治疗急性缺血性脑卒中的药物,尤其适用于发作3 h内的患者。1996年美国食品和药物管理局批准使用静脉注射rt-PA治疗发作3 h内的急性缺血性脑卒中患者[2]。美国心脏协会和美国卒中协会也建议发作3 h内的缺血性脑卒中患者可给予静脉注射rt-PA(0.9 mg/kg,最大剂量90 mg)治疗。此外,国际准则(欧洲行程计划)推荐静脉注射rt-PA作为一线治疗药物应用于症状发作3 h内的患者[3-4]。目前,rt-PA已广泛应用于临床,但rt-PA在不同时间窗(开始发病到接受溶栓治疗的时间)的疗效仍存在争议,本研究综合现有的相关试验研究,系统评价rt-PA静脉溶栓治疗急性缺血性脑卒中的疗效和安全性以及不同治疗时间窗对于患者预后及并发症的影响,以期提供最佳临床证据。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 研究类型 随机对照试验。
1.1.2 研究对象 临床明确诊断为急性缺血性脑卒中(颅脑CT、MRI明确诊断),患者年龄≥18岁,患者国籍、性别、种族、职业均不限。
1.1.3 干预措施 rt-PA与安慰剂静脉溶栓治疗急性缺血性脑卒中。
1.1.4 结局指标 (1)3~6个月有利神经评分,包括改良Rankin(mRS)评分0~1分、牛津残障评分(OHS)0~1分;(2)不同时间窗(0~3.0 h、3.1~4.5 h、4.6~6.0 h)有利神经评分;(3)3~6个月总体病死率;(4)症状性颅内出血。
1.1.5 排除标准 (1)合并有脑出血及其他颅内病变;(2)静脉溶栓时间不确定;(3)症状轻,且很快改善;(4)发表文献的作者或文献存在重叠;(5)未设置明确的对照组,相关研究治疗不明确或纳入病例数过少(≤50例)。
1.2 检索策略 计算机检索The Cochrane Library(2013年第3期)、PubMed(1995年1月—2013年6月)、CNKI(1992年1月—2013年6月)、SCI(1995年1月—2013年6月)、EMBase数据库(1995年1月—2013年6月)、Medline(1990年1月—2013年6月)及万方全文数据库(1996年1月—2013年6月)。中文检索词包括:重组组织型纤溶酶原激活物、阿替普酶、静脉溶栓、急性脑梗死、急性缺血性脑卒中、脑栓塞、Meta分析;英文检索词包括:recombinant tissue-type plasminogen activator,alteplase,rt-PA,intravenous thrombolysis,acute cerebral infarction,acute ischemic stroke,Meta analysis。并查阅纳入文献的相关文献、相关会议记录、研究生论文。语言限中、英文。
1.3 文献筛取和资料提取 由2位研究者独立按照纳入和排除标准严格筛选文献,提取资料并交叉核对,如遇分歧则讨论解决或由第三位研究者协助解决。为避免主观偏见,资料提取时隐去作者姓名、刊物名称、年份及国家。资料提取内容包括随机对照试验的基本信息、病例特征、各个结局指标等。
1.4 方法学质量评价
1.4.1 偏倚风险评估 采用Cochrane系统评价员手册5.1版中随机对照试验的偏倚风险评价标准来评价纳入文献的方法学质量,具体内容包括:(1)随机分配方法;(2)分配隐藏;(3)是否采用盲法;(4)有无选择性报告研究结果;(5)有无其他偏倚来源;(6)失访与退出。针对上述6条采用“是”(低度偏倚)、“否”(高度偏倚)或“不清楚”(缺乏相关信息或偏倚情况不确定)给予评价。
1.4.2 证据质量及推荐等级 基于系统评价的结果应用GRADE系统推荐分级方法评价证据质量及推荐等级。证据质量分级如下:(1)高质量(或A)。我们非常确信真实的效应值接近效应估计值。(2)中等质量(或B)。对效应估计值我们有中等程度的信心,真实值有可能接近估计值,但仍存在二者大不相同的可能性。(3)低质量(或C)。我们对效应估计值的确信程度有限,真实值可能与估计值大不相同。(4)极低质量(或D)。我们对效应估计值几乎没有信心,真实值很可能与估计值大不相同。推荐等级分为“强推荐”和“弱推荐”。强推荐表明评价者确信干预措施利大于弊或弊大于利;弱推荐表明利弊不确定或无论证据质量高低均显示利弊相当。
1.5 统计学方法 采用RevMan 5.0软件进行Meta分析。计量资料采用加权均数差(WMD)作为效应值,计数资料采用相对危险度(RR)作为效应值。研究结果以效应值及其95%CI表示。首先对于纳入文献的研究结果进行临床异质性检验(Q检验),如纳入的研究无异质性(P≥0.10,I2≤50%),则选择固定效应模型进行Meta分析;如果研究间存在异质性 (P<0.10,I2>50%),则需进一步分析异质性的可能来源,并分析产生异质性的可能因素。如分析结果提示仅有统计学异质性,而临床异质性不明显,则选择随机效应模型进行Meta分析。如果研究资料存在明显的临床异质性或方法学异质性、纳入文献提供的临床资料不全,不能进行系统评价时,则进行文献综述。如纳入文献存在较为明显的统计学异质性,可排除低质量文献资料进行敏感性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 纳入文献的基本特征及质量评价 初检3 672篇文献,排除重复发表及明显不符合纳入标准的文献后,经阅读文题和摘要初筛纳入73篇文献。进一步查找和阅读全文,严格按照纳入和排除标准,最终纳入7篇文献[5-11],均为随机对照试验,均为英文文献。共包含6 548例患者,其中rt-PA组3 291例,对照组3 257例。文献筛选流程见图1,纳入文献的基本特征见表1。纳入文献的方法学质量评价见表2。
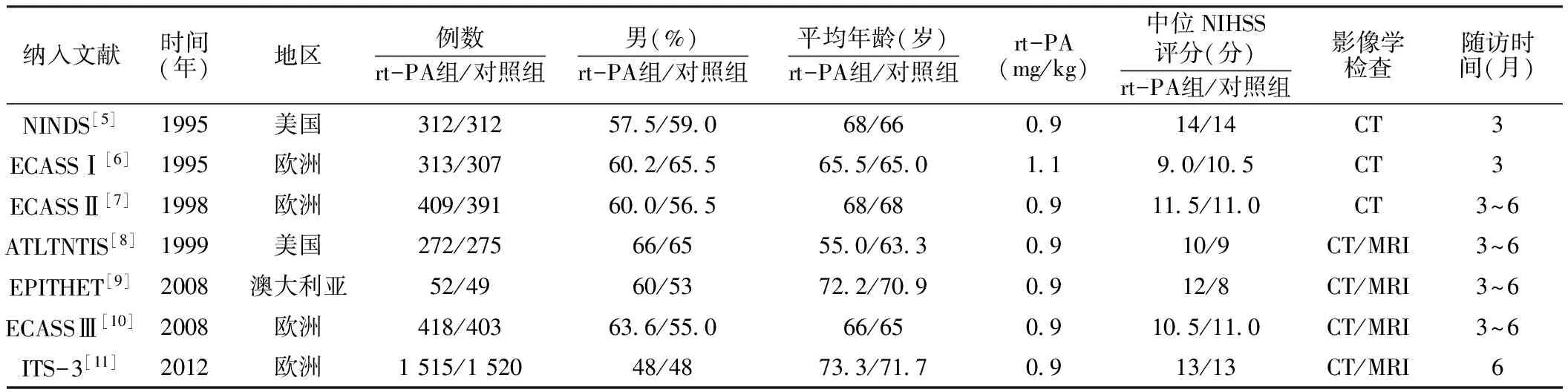
表1 纳入文献的基本特征
注:rt-PA=重组组织型纤溶酶原激活剂,NIHSS=美国国立卫生研究院卒中量表

表2 纳入文献的方法学质量评价
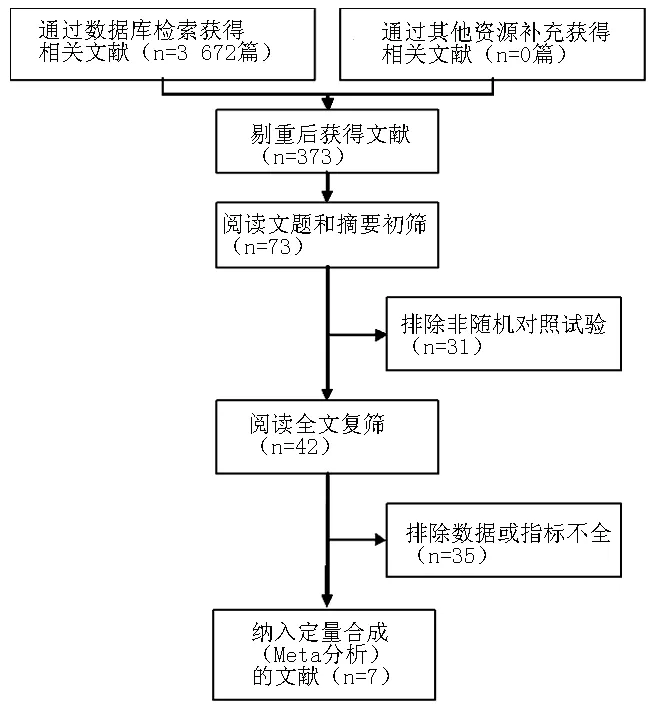
图1 文献筛选流程
2.2 Meta分析结果
2.2.1 有利神经评分发生率 7篇文献[5-11]比较了rt-PA与安慰剂治疗急性缺血性脑卒中3~6个月有利神经评分发生率,各研究间有统计学异质性(P=0.08,I2=47%),采用随机效应模型进行Meta分析。结果显示,rt-PA组治疗急性缺血性脑卒中3~6个月有利神经评分发生率高于对照组〔RR=1.22,95%CI(1.10,1.35),P=0.000 2,见图2〕。
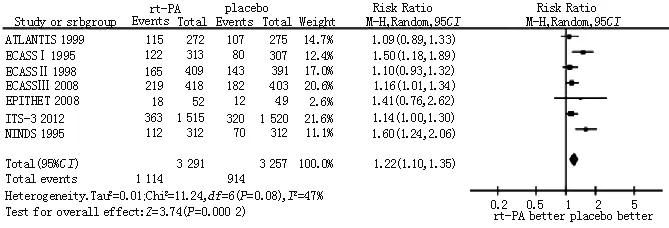
图2 rt-PA组与对照组3~6个月有利神经评分发生率比较的Meta分析
Figure2 Meta-analysis on the incidence of favorable neurological scores of 3 to 6 months between rt-PA group and control group
2.2.2 不同时间窗有利神经评分发生率 6篇文献[5-8,10-11]比较了3个不同时间窗(0~3.0 h、3.1~4.5 h、4.6~6.0 h)rt-PA与安慰剂治疗急性缺血性脑卒中3~6个月有利神经评分发生率,各研究间无统计学异质性(P=0.87、0.52、0.52,I2值均=0%),采用固定效应模型进行Meta分析。结果显示,rt-PA组0~3.0 h时间窗〔RR=1.53,95%CI(1.32,1.78),P=0.000 01〕、3.1~4.5 h时间窗〔RR=1.13,95%CI(1.02,1.25),P=0.02〕有利神经评分发生率均高于对照组;但4.6~6.0 h时间窗rt-PA组与对照组有利神经评分发生率比较,差异无统计学意义〔RR=1.05,95%CI(0.02,1.21),P=0.44,见图3〕。
2.2.3 3~6个月总体病死率 7篇文献[5-11]比较了rt-PA与安慰剂治疗急性缺血性脑卒中3~6个月总体病死率,各研究间无统计学异质性(P=0.15,I2=36%),采用固定效应模型进行Meta分析。结果显示,rt-PA组与对照组3~6个月总体病死率比较,差异无统计学意义〔RR=1.07,95%CI(0.91,1.26),P=0.40,见图4〕。
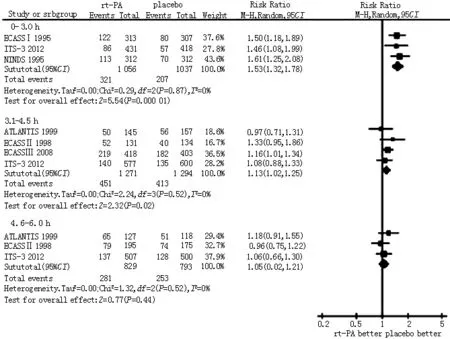
图3 rt-PA组与对照组不同时间窗3~6个月有利神经评分发生率比较的Meta分析
Figure3 Meta-analysis on the incidence of favorable neurological scores of 3 to 6 months in different time windows between rt-PA group and control group
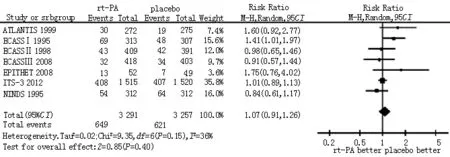
图4 rt-PA组与对照组3~6个月总体病死率比较的Meta分析
Figure4 Meta-analysis on mortality rate of 3 to 6 months between rt-PA group and the control group
2.2.4 症状性颅内出血发生率 6篇文献[5,7-11]比较了rt-PA与安慰剂治疗急性缺血性脑卒中症状性颅内出血发生率,各研究间有统计学异质性(P=0.06,I2=53%),采用随机效应模型进行Meta分析。结果显示,rt-PA组症状性颅内出血发生率高于对照组,差异有统计学意义〔RR=3.94,95%CI(2.31,6.70),P=0.000 01,见图5〕。
2.3 发表性偏倚分析 采用Begger漏斗图评价纳入文献是否存在发表偏移以评价原始分析结果的真实可靠性。漏斗图分析结果显示:有利神经评分、不同时间窗有利神经评分、总体死亡率、症状性颅内出血在漏斗图上均集中在图形上部,左右基本对称,存在发表偏倚的可能性较小(见图6~9)。
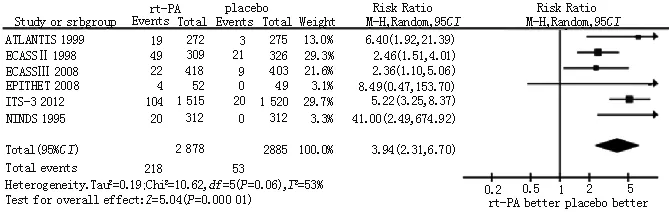
图5 rt-PA组与对照组症状性颅内出血发生率比较的Meta分析
Figure5 Meta-analysis on the incidence of intracranial hemorrhage rate between rt-PA group and control group
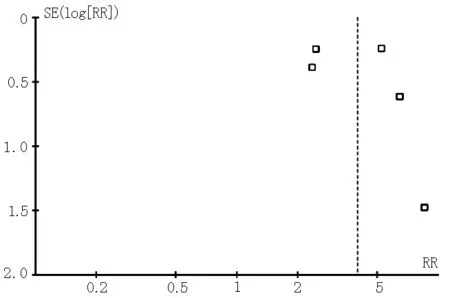
图6 3~6个月有利神经评分漏斗图
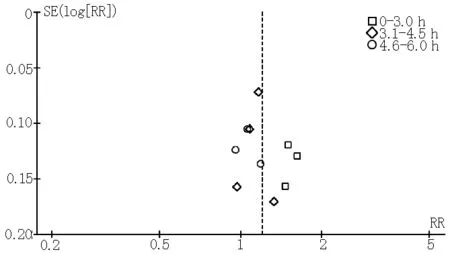
图7 不同时间窗3~6个月后有利神经评分漏斗图
Figure7 Funnel plots of favorable neurological score of 3 to 6 months in different time windows
3 讨论
近年来,很多临床研究证据都支持静脉使用rt-PA可改善缺血性脑卒中患者的症状,但尚未大范围应用于急性缺血性脑卒中患者,仅有6%的缺血性脑卒中患者接受rt-PA静脉溶栓治疗[12],其主要原因是因为大多数患者在出现脑卒中症状时未能及时到医院就诊[13]。如果rt-PA静脉溶栓治疗缺血性脑卒中的时间窗能够延长,更多的患者将有机会获得治疗[14]。
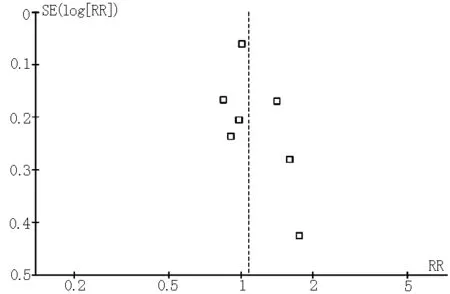
图8 3~6个月总体病死率漏斗图
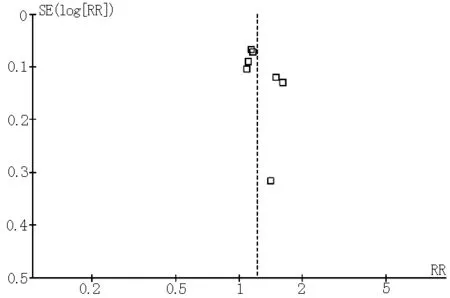
图9 症状性颅内出血发生率漏斗图
Figure9 Funnel plots of the incidence of intracranial hemorrhage
本Meta分析系统评价了rt-PA静脉溶栓治疗缺血性脑卒中的疗效(3~6个月有利神经评分)和安全性(总体病死率、症状性颅内出血发生率)。结果表明,相比于安慰剂治疗,rt-PA静脉溶栓治疗患者确实显示出了更高比例的有利神经评分,患者的独立生存能力得到更好的改善。此外,接受rt-PA静脉溶栓治疗的患者发生颅内出血的风险增高,但远期死亡风险并未增加。
通过比较不同时间窗rt-PA治疗缺血性脑卒中患者的疗效,可以得知,在0~3.0 h、3.1~4.5 h时间窗内接受rt-PA静脉溶栓治疗相比接受安慰剂治疗的患者确实显示出了更高比例的有利神经评分。一项观察性研究表明,3.1~4.5 h予rt-PA静脉注射的664例患者与3 h内的11 865例患者获得了相似的远期有利神经评分,患者远期独立生存能力得到改善[15]。最近的Meta分析则进一步验证了患者在3.1~4.5 h时间窗给予rt-PA静脉注射可以获得更高的远期生活能力,但在4.6~6.0 h接受rt-PA静脉溶栓治疗的患者较对照组有利神经评分以及远期独生活能力均无差异[16-17]。
本研究分析不同结局指标时,纳入的研究之间均有明显的异质性。考虑可能与以下因素有关:(1)不同研究纳入的研究对象、研究规模的大小不同产生的异质性;(2)干预措施如治疗剂型、辅助干预措施及患者的依从性差异产生的异质性;(3)对于结局指标等定义及测量方法的不同产生的异质性。
本Meta分析的局限性:(1)纳入7篇文献,没有完全相同的治疗时间窗,由于rt-PA应用于临床时并未就明确的时间窗进行规定,各个研究均依照当时的时间窗标准进行研究[18-19],对于具体时间窗的划分及分组分析并未统一,可能对分析结果产生影响;(2)非均质性定义症状性颅内出血,由于症状性颅内出血目前尚无统一的诊断标准,各研究结果均自定义了症状性颅内出血,可能对分析结果产生影响;(3)对于患者观察周期没有统一,本研究纳入7篇文献的随访周期为3~6个月,未对远期的有效性及病死率进行观察并做进一步分析。
综上所述,急性缺血性脑卒中患者给予rt-PA静脉溶栓治疗取得了较为显著的疗效。现有证据表明,患者在发病4.5 h内接受rt-PA静脉溶栓治疗可以获得更好的独立生存能力,但超过4.5 h后没有显示更好的远期预后,虽然应用rt-PA后症状性颅内出血发生率较对照组高,但患者的远期病死率并没有增加。受纳入文献数量和质量限制,今后尚需开展大样本、高质量的随机对照试验进一步论证其疗效和安全性,临床医生应根据患者具体情况合理采用治疗策略。
1 WRITING GROUP MEMBERS,Lloyd-Jones D,Adams RJ,et al.Heart disease and stroke statistics——2010 update:a report from the American Heart Association[J].Circulation,2010,121(7):e46-e215.
2 No authors listed.Tissue plasminogen activator for acute ischemic stroke.The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group[J].N Engl J Med,1995,333(24):1581-1587.
3 Chung H,Refoios Camejo R,Barnett D.Alteplase for the treatment of acute ischaemic stroke:NICE technology appraisal guidance[J].Heart,2007,93(12):1616-1617.
4 Bhatt A,Shatila A.Neurohospitalists improve door-to-needle times for patients with ischemic stroke receiving intravenous tPA[J].Neurohospitalist,2012,2(4):119-122.
5 Feng W,Vasquez G,Suri MF,et al.Repeated-measures analysis of the National Institute of Neurological Disorders and Stroke rt-PA stroke trial[J].J Stroke Cerebrovasc Dis,2011,20(3):241-246.
6 Hacke W,Kaste M,Fieschi C,et al.Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke.The European Cooperative Acute Stroke Study(ECASS) [J].JAMA,1995,274 (13):1017-1025.
7 Hacke W,Kaste M,Fieschi C,et al.Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS Ⅱ).Second European-Australasian Acute Stroke Study Investigators[J].Lancet,1998,352(9136):1245-1251.
8 Clark WM,Wissman S,Albers GW,et al.Recombinant tissue-type plasminogen activator (Alteplase) for ischemic stroke 3 to 5 hours after symptom onset.The ATLANTIS Study:a randomized controlled trial.Alteplase Thrombolysis for Acute Noninterventional Therapy in Ischemic Stroke[J].JAMA,1999,282(21):2019-2026.
9 Davis SM,Donnan GA,Parsons MW,et al.Effects of alteplase beyond 3 h after stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET):a placebo-controlled randomised trial[J].Lancet Neurol,2008,7(4):299-309.
10 Hacke W,Kaste M,Bluhmki E,et al.Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J].N Engl J Med,2008,359(13):1317-1329.
11 IST-3 collaborative group.Effect of thrombolysis with alteplase within 6 h of acute ischaemic stroke on long-term outcomes (the third International Stroke Trial [IST-3]):18-month follow-up ofa randomised controlled trial[J].Lancet Neurol,2013,12(8):768-776.
12 Yeo LL,Paliwal P,Teoh HL,et al.Early and continuous neurologic improvements after intravenous thrombolysis are strong predictors of favorable long-term outcomes in acute ischemic stroke[J].J Stroke Cerebrovasc Dis,2013,22(8):e590-596.
13 to Y,Suzuki N.Guidelines in diagnosis and therapy for acute-phase ischemic cerebrovascular disorders:Intravenous rt-PA therapy[J].Nihon Naika Gakkai Zasshi,2007,96(11):2556-2563.
14 Sharma VK,Kawnayn G,Sarkar N.Acute is chemic stroke:comparison of low-dose and standard-dose regimes of tissue plasminogen activator[J].Expert Rev Neurother,2013,13(8):895-902.
15 Ahmed N,Wahlgren N,Grond M,et al.Implementation and outcome of thrombolysis with alteplase 3-4.5 h after an acute stroke:an updated analysis from SITS-ISTR[J].Lancet Neurol,2010,9(9):866-874.
16 Stroke Thrombolysis Trialists′ Collaborative Group.Details of a prospective protocol for a collaborative meta-analysis of individual participant data from all randomized trials of intravenous rt-PA vs.control:statistical analysis plan for the Stroke Thrombolysis Trialists′ Collaborative meta-analysis[J].Int J Stroke,2013,8(4):278-283.
17 Lansberg MG,Bluhmki E,Thijs VN.Efficacy and safety of tissue plasminogen activator 3 to 4.5 hours after acute ischemic stroke:a meta analysis[J].Stroke,2009,40(7):2438-2441.
18 Kunisawa S,Kobayashi D,Lee J,et al.Factors associated with the administration of tissue plasminogen activator for acute ischemic stroke[J].J Stroke Cerebrovasc Dis,2014,23(4):724-731.
19 Ploneda Perilla AS,Schneck MJ.Unanswered questions in thrombolytic therapy for acute ischemic stroke[J].Neurol Clin,2013,31(3):677-704.

