黄海海燕内脏脂质的提取分析及其抗氧化活性的研究
赵 鑫,赵雅娉,周大勇,刘 丽,启 航,*
(1.大连工业大学食品学院,辽宁大连116034;2.国家海洋食品工程技术研究中心,辽宁大连116034;3.辽宁省大连海洋渔业集团公司技术研发中心,辽宁大连116000)
近年来,营养型脂肪酸对于人类的健康作用引起了人们的广泛关注[1],研究发现长链的n-3多不饱和脂肪酸具有广泛的健康益处,包括改善心脏疾病,促进幼儿发育,降低肿瘤生长和转移,抑制炎症、血小板聚集、高血压、高脂血以及较好地改善胰岛素敏感性[1-2]。海产品富含二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),一直被视为健康食品,尽管需求量增加,但人均水产品供应已趋于稳定[3]。研究表明,海产品的组织中具有非常相似的脂肪酸组成[4]。因此,虽然海产品废弃物不适合直接用于人类饮食消费,但却成为潜在生产多不饱和脂肪酸的原料。
酶解技术已用于鱼的副产物制备蛋白质、肽和脂质等物质[5-6]。课题组在前期研究中已经应用酶解技术从贝类的副产物中制备了多糖、多肽和脂质等有效成分[7-9]。其中,制备的贝类内脏脂质含有丰富的EPA和DHA[10]。近年来,也有从鱼、虾、贝等海产品的头部和内脏中提取脂质的相关研究[5-6,11]。
黄海海燕(Asterina pectinifera)是棘皮动物,主要分布于我国的黄、渤海海域。由于黄海海燕是肉食性的动物,常对沿海经济水产养殖造成危害。在辽宁和山东沿海,捕获的黄海海燕常作为废弃物丢弃,造成资源浪费和一定程度的环境污染。因此黄海海燕的综合开发利用,对于充分利用海洋生物资源、保护环境都有一定的现实意义。黄海海燕内脏脂质的相关研究国内外鲜见报道,本文以黄海海燕内脏为原料,应用酶解辅助有机溶剂提取技术制备脂质,分析脂质的脂肪酸组成,并研究了脂质的细胞内抗氧化活性。
1 材料与方法
1.1 材料与仪器
黄海海燕(Asterina pectinifera) 大连太平洋海珍品有限公司;Changliver细胞 大连医科大学;中性蛋白酶(60,000U/g)和碱性蛋白酶(40,000U/g) 南宁庞博生物工程有限公司;胰蛋白酶(57,000U/g)和木瓜蛋白酶(39,000U/g) 生工生物(上海)有限公司;DMEM培养基 美国Hyclone公司;CCK-8日本同仁化学株式会社;其余试剂 为国产优级纯或分析纯试剂。
RC-6 plus型冷冻离心机、ZKBTES-55型真空冷冻干燥机 美国Virtis;气相色谱质谱联用仪 安捷伦科技有限公司;DN-12A型氮气吹干仪 天津市乐康科技有限公司;酶标仪 瑞士Tecan Infinite;UV-2100型紫外分光光度计 尤尼柯仪器有限公司;CO2培养箱日本三洋;精密pH计 上海雷磁仪器厂;HH-4型数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司。
1.2 实验方法
1.2.1 原料处理 新鲜黄海海燕,清水洗净后,取出内脏部分,经冷冻干燥制成干粉,低温保存备用。
1.2.2 水解度测定 蛋白质的水解度DH(Degree of hydrolysis)代表蛋白质在水解过程中,肽键被裂解的程度或百分比,数学表达式为:DH(%)=被裂解的肽键数/原蛋白质中的总肽键数×100或者表达为DH(%)=α-氨基氮/总氮×100。用凯氏定氮法测定总氮含量,甲醛滴定法测定α-氨基氮含量[12-13]。
1.2.3 索氏提取法提取脂质 取冻干后的样品,用索氏抽提法提取脂质。提取溶剂为乙醚,提取时间6h,水浴温度控制在60℃左右,提取剂5m in回流1次。提取完成后,35℃下,用氮气仪吹干乙醚,得到内脏脂质,称重,冷冻避光保存。
1.2.4 酶辅助有机溶剂提取脂质 黄海海燕内脏干粉放置于样品瓶中,加入4倍体积的去离子水,调节pH到最适反应值,加入适量的碱性蛋白酶(Alc)、中性蛋白酶(Neu)、木瓜蛋白酶(Pap)和胰蛋白酶(Try)(各种酶的特性如表1所示),使其含量为2500U/g底物,在最适温度下振荡保温3h,100℃的沸水中将酶灭活10m in,冷却到室温后,冷冻干燥,加入与去离子水等体积的正己烷,振荡,离心,取上层正己烷层,将其装入已经称量好的称量瓶中,经氮吹仪将正己烷吹干,称量,得到提取脂质的质量。脂质得率的计算公式为:
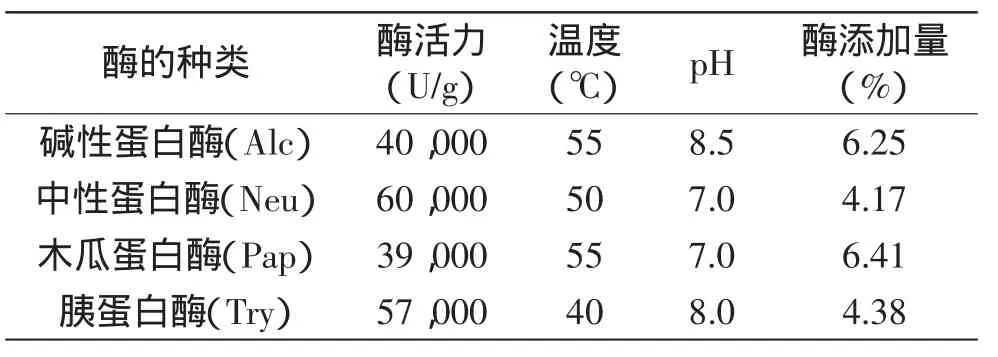
表1 4种蛋白酶的特性Table1 Parameters of 4 kinds of protease
1.2.5 脂肪酸组成分析
1.2.5.1 不可皂化物的分离提取 取100mg脂质样品,加入2.5m L 50%的KOH溶液,5m L 95%的乙醇,充分混匀。充氮气密封,60℃水浴2h,皂化至溶液澄清透明,油滴消失为止(加热过程中充分搅拌)。取出冷却至室温。向皂化混合液中加入3~4m L正己烷,振荡萃取除去不可皂化物,反复6次[14-15]。
1.2.5.2 可皂化物的分离提取 在剩余皂化物混合液中滴加6mol/L的HCl,调至强酸性(pH<1.0),再加入4m L正己烷,振荡萃取可皂化物,反复6次,水洗至中性,氮吹至恒重,充氮,低温保存[14-15]。
1.2.5.3 脂肪酸的甲酯化 以正己烷溶解皂化物干样,从中取2.5mg样品,加入2m L 1%硫酸-甲醇溶液(硫酸∶甲醇=1∶99(v/v)),充分混匀,充氮密封,70℃水浴加热1h。然后取出冷却至室温,加入1m L水后,收集上层液相。水洗至中性,然后用正己烷调至可皂化物浓度为10mg/m L,加入无水硫酸钠,充氮,低温保存[14-15]。
1.2.5.4 GC-MS分析 将脂肪酸甲酯样品稀释为10mg/m L,使用安捷伦6890N GC-5973 MSD气质联用仪进行分析。色谱柱为HP-5-MS毛细管柱(30m×0.25mm×0.25μm),初始温度50℃,保持1m in;以50℃/min速度升至170℃;再以4℃/min升至300℃;以40℃/m in升至320℃,保持3.6m in。进样体积为1.0μL,分流比为50∶1,使用氦气为载气。质谱分析采用EI源70eV,选取Scan模式,扫描范围为50~550m/z,溶剂延迟4m in。根据GC-MS中各组分保留时间以及质谱图,通过脂肪酸标准品和NIST02库检索进行鉴定,用峰面积归一法计算各脂肪酸的组成[16-17]。
1.2.6 细胞氧化损伤保护作用的分析 采用CCK-8比色法测定对H2O2致细胞氧化应激的保护作用。取对数生长期的Changliver细胞,用含10%胎牛血清的DMEM高糖培养基(完全培养基)配成细胞悬液并调节细胞浓度为1×105个/m L。在96孔细胞培养板内,每孔添加188μL细胞悬液,再加入配制好的不同浓度的脂质2μL(脂质溶解在DMSO中),混匀。培养24h,向各孔加入10μL H2O2(150μg/m L)。对照组中加入等体积DMSO。于培养箱中培养24h后,每孔加入CCK-8 10μL,继续培养1.5h,用酶标仪于450nm测OD值。细胞存活率计算公式为:

1.2.7 统计学分析 所有实验都重复3次,数据用平均值±标准偏差表示,用SPSS统计软件(16.0版,IBM,美国)对所有数据做方差分析并用LSD法对数据间做多重比较。
2 结果与讨论
2.1 酶辅助有机溶剂法提取黄海海燕内脏脂质
由索氏提取法测得黄海海燕内脏脂质含量为16.0%±0.80%,略低于扇贝内脏的脂质含量(23.70% ±0.60%)[10]和鲍鱼内脏的脂质含量(20.87%±0.76%)[18]。由于黄海海燕原料低成本和相对较高的脂质含量,可以成为脂质制备工业潜在的可开发资源。
正己烷是脂质制备工业中最常用的有机溶剂[19],本课题组以之为浸提溶剂提取扇贝[10]、鲍鱼[18]内脏油脂,获得较好的效果。有报道认为底物的水解度是影响酶辅助水提取法脂质得率的一个关键因素[20]。因此,推断底物的水解度也可能影响酶辅助有机溶剂提取黄海海燕内脏脂质的得率。
本研究选择了4种蛋白酶水解黄海海燕的内脏,水解后的样品用于脂质的提取。4种酶水解底物的水解度和脂质的得率如图1所示,碱性蛋白酶组(A lc)、中性蛋白酶组(Nue)、木瓜蛋白酶组(Pap)和胰蛋白酶组(Try)辅助有机溶剂法提取的脂质得率分别为6.1%±0.02%、6.77%±0.06%、7.96%±0.04%和5.48%± 0.02%;脂质的得率随着底物水解度的增大而显著提高,其中,木瓜蛋白酶(Pap)组的脂质得率最大。该结果与有机溶剂提取的脂质得率随着底物的水解度提高而增大的结果相一致[21-22]。其主要的原因是蛋白酶破坏纤维蛋白的结构,使嵌入在其中的脂肪球释放,有助于有机溶剂的提取[23]。
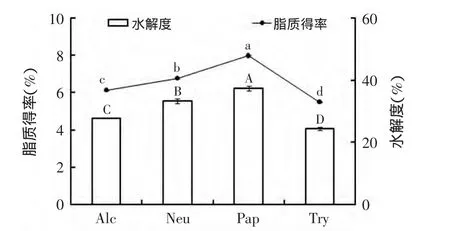
图1 不同酶辅助有机溶剂提取黄海海燕内脏脂质的水解度及脂质得率Fig.1 Profiles of the degree ofhydrolysis values and lipid yields by differentenzyme assisted solvent extractionmethod
2.2 酶辅助有机溶剂法提取黄海海燕内脏脂质的脂肪酸组成
如表2所示,GC-MS法在4种酶辅助有机溶剂法提取的脂质中检测到17种脂肪酸,但各脂肪酸含量存在一定差异。4种油脂中,总多不饱和脂肪酸均占总脂肪酸的40%以上,其中Try组的总多不饱和脂肪酸含量为40.84%±0.14%,显著低于其他3组(p<0.05),其他三组总多不饱和脂肪酸含量均在47%以上,并且其他三组含量之间不存在显著性差异(p>0.05)。在多不饱和脂肪酸中,EPA和DHA的含量分别占总脂肪酸含量的23%和3.8%以上,其中A lc组、Neu组和Pap组中的EPA含量均在30%以上,显著高于Try组的EPA含量(p<0.05);而A lc组的DHA含量最高,达到6.85%±0.22%,显著高于其他3组(p<0.05)。另外4种酶辅助有机溶剂法提取的脂质中,花生四烯酸(AHA)的含量也相对较高,占到总脂肪酸的8%以上,其中Pap组的AHA含量最高,达到10.76%±0.040%,显著高于其他3组(p<0.05)。
黄海海燕内脏脂质中多不饱和脂肪酸含量高于海胆[8]和鲍鱼[18]内脏中多不饱和脂肪酸的含量(海胆34.7%~37.4%,鲍鱼21.38%),而略低于扇贝中多不饱和脂肪酸的含量(55.44%)。其中EPA和DHA含量占总多不饱和脂肪酸的68%以上,其含量高于海胆(EPA,9.7%~10.9%;DHA,0.1%)[8]和鲍鱼内脏(EPA,7.08%;DHA,未检出)[18]中的相应含量,但DHA含量略低于扇贝内脏[10]中的DHA含量(8.51%)。另外黄海海燕内脏脂质中AHA的含量也相对较高,与鲍鱼内脏脂质中AHA的含量相似(9.32%)[18],但明显高于海胆(6.3%~7.4%)[8]和扇贝内脏(未检出)[10]脂质中AHA的含量。海胆、扇贝、鲍鱼、藻类都是海洋中富含不饱和脂肪酸的生物,黄海海燕的体内可能无法合成某些不饱和脂肪酸(例如AHA),所以通过摄食沿海的海珍品来获得维持其自身的营养。这可能就是黄海海燕内脏脂质中的多不饱和脂肪酸含量相对较高的原因之一。
2.3 脂质对细胞氧化损伤的保护作用
考察了应用4种蛋白酶辅助有机溶剂法提取黄海海燕内脏脂质对过氧化氢引起Changliver细胞氧化损伤的保护作用。如图2所示,4种酶辅助有机溶剂法提取的脂质在30~100μg/m L浓度下,都显著抑制了过氧化氢引起的细胞损伤,其抑制效果随浓度的升高而明显增强。该结果表明,黄海海燕内脏脂质具有一定的细胞抗氧化活性,与Chaung等报道的多不饱和脂肪酸保护了氧化应激引起的细胞损伤结果相一致[24]。多不饱和脂肪酸对细胞氧化损伤的保护作用可能是通过激活抗氧化酶[25]、调节分子的表达[26]以及与氧化物质反应[27]等实现的。
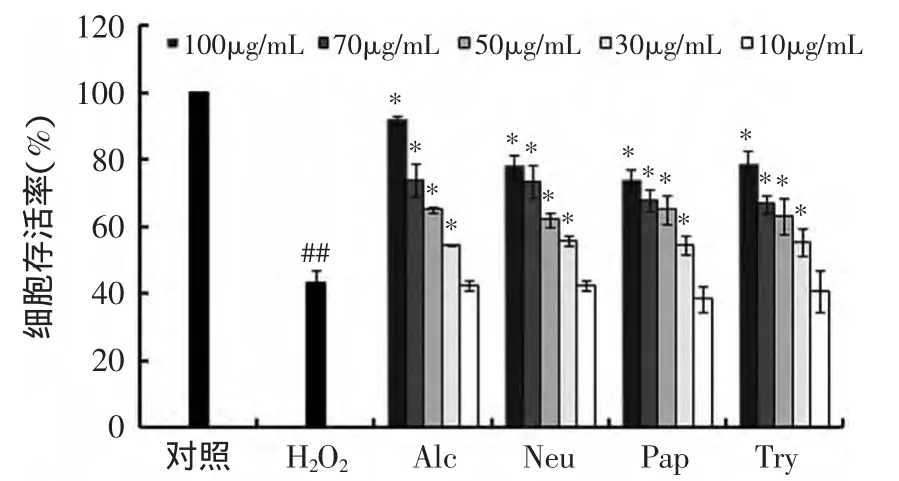
图2 酶辅助有机溶剂法提取黄海海燕内脏脂质的对细胞氧化损伤的保护作用Fig.2 Protective effecton cellular oxidative damage of lipidfrom starfish viscera by differentenzyme assisted solvent extractionmethod
3 结论
采用酶辅助有机溶剂法提取海燕内脏脂质,脂质得率随着底物水解度的增加而提高;海燕内脏脂质中多不饱和脂肪酸含量较高,可占总脂肪酸的40%以上,其中EPA和DHA可占总多不饱和脂肪酸的68%以上;海燕内脏脂质在30~100μg/m L浓度下都可以显著抑制过氧化氢引起的细胞氧化损伤,具有一定的抗氧化活性。可见,作为海产废弃物的黄海海燕,可作为提取长链的n-3多不饱和脂肪酸的潜在资源,有希望实现变废为宝。
[1]Anderson BM,Ma DWL.Are all n-3 polyunsaturated fatty acids created equal[J].Lipids in Health and Disease,2009,33(8):1-20.
[2]Riediger ND,Othman RA,Suh M,et al.A systemic review of the roles of n-3 fatty acids in health and disease[J].Journal of the Academy of Nutrition and Dietetics,2009,109:668-679.
[3]FAO.SOFIA(The State ofWorld Fisheries and Aquaculture)Report2008[M].Rome,Italy:Fisheriesand AquacultureDepartment,Food and Agriculture Organization of the United Nations,2008:3.
[4]Takama K,Suzuki T,Yoshida K,et al.Phosphatidylcholine levels and their fatty acid compositions in teleost tissues and squid muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1999,124:109-116.
[5]Dumay J,Donnay-Moreno C,Barnathan G,etal.Improvement of lipid and phospholipid recoveries from sardine(Sardina pilchardus) viscera using industrial proteases[J].Process Biochemistry,2006,41:2327-2332.
[6]Kechaou ES,Dumay J,Donnay-Moreno C,et al.Enzymatic hydrolysis of cuttlefish(Sepia officinalis)and sardine(Sardina pilchardus)viscera using commercial proteases:effects on lipid distribution and amino acid composition[J].Journal of Bioscience and Bioengineering,2009,107:158-164.
[7]Zhu BW,Wang LS,Zhou DY,et al.Antioxidant activity of sulphated polysaccharide conjugates from abalone(Haliotis discus hannai Ino)[J].European Food Research and Technology,2008,227:1663-1668.
[8]Zhu B,Qin L,Zhou D,et al.Extraction of lipid from sea urchin(Strongylocentrotus nudus)gonad by enzyme-assisted aqueous and supercritical carbon dioxide methods[J].European Food Research and Technology,2010,230:737-743.
[9]Sun LM,Zhu BW,Li DM,et al.Purification and bioactivity of sulphated polysaccharide conjugate ACP I from viscera of abalone Haliotis discus hannai Ino[J].Food and Agricultural Immunology,2010,21:15-26.
[10]Zhou D,Zhu B,Tong L,et al.Extraction of lipid from scallop(Patinopecten yessoensis)viscera by enzyme-assisted solvent and supercritical carbon dioxidemethods[J].International Journal of Food Science and Technology,2010,45:1787-1793.
[11]Dumay J,Donnay-Moreno C,Barnathan G,etal.Optimization ofhydrolysisofsardine(Sardina pilchardus)headswith Protamex:enhancement of lipid and phospholipid extraction[J].Journal of the Science of Food and Agriculture,2009,89:1599-1606.
[12]Gump BH,Zoecklein BW,Fugelsang KC.Prediction of prefermentation nutritional status of grape juice-The formol method[M].Totowa,NJ,USA:Humana Press,Inc,2000:283-296.
[13]Filipe-Ribeiro L,Mendes-Faia A.Validation and comparison of analytical methods used to evaluate the nitrogen status of grape juice[J].Food Chemistry,2007,100:1272-1277.
[14]Kovacs MIP,Anderson WE,Ackman RG.A simple method for the determination of cholesterol and some plant sterols in fishery-based food products[J].Journal of Food Science,1979,44:1299-1301.
[15]Jeong WS,Lachance PA.Phytosterols and fatty acids in fig(Ficus carica,var.Mission)fruit and tree components[J].Journal of Food Science,2001,66:278-281.
[16]Christie WW.Equivalent chain-lengths of methyl ester derivatives of fatty acids on gas chromatography:a reappraisal[J].JChromatography A,1988,447:305-314.
[17]Härtig C.Rapid identification of fatty acid methyl esters using amultidimensional gas chromatography-mass spectrometry database[J].JChromatography A,2008,1177:159-169.
[18]Zhou D,Tong L,Zhu B,et al.Extraction of lipid from abalone(Haliotis discushannai Ino)gonad by supercritical carbon dioxide and enzyme-assisted organic solventmethods[J].JFood Processing,2012,36:126-132.
[19]Suenaga K.Bioorganic studiesonmarine naturalproductswith bioactivity,such as antitumor activity and feeding attractance[J].Bulletin of The Chemical Society of Japan,2004,77:443-451.
[20]Rosenthal A,Pyle DL,Niranjan K.Aqueous and enzymatic processes for edible oil extraction[J].Enzyme and MicrobialTechnology,1996,19:402-420.
[21]Fullbrook P.The use ofenzymes in the processing ofoilseeds [J].Journal of the American Oil Chemists Society,1983,60:476-478.
[22]Dominguez H,NunezMJ,Lema JM.Enzyme-assisted hexane extraction of soya bean oil[J].Food Chemistry,1995,54:223-231.
[23]Yoon SH,Kim IH,Kim SH,etal.Effects ofenzyme treatments and ultrasonification on extraction yields of lipids and protein from soybean by aqueous process[J].Korean Journal of Food Science and Technology(Korea Republic),1991,23:673-676.
[24]Chaung H,Chang C,Chen P,et al.Docosahexaenoic acid and phosphatidylserine improves the antioxidant activities in vitro and in vivo and cognitive functions of the developing brain [J].Food Chemistry,2013,138:342-347.
[25]Venkatraman JT,Chandrasekar B,Kim JD,et al.Effects of n-3 and n-6 fatty acids on the activities and expression of hepatic antioxidant enzymes in autoimmune-prone NZBxNZW F1mice[J].Lipids,1994,29:561-568.
[26]Ye S,Tan L,Ma J,etal.Polyunsaturated docosahexaenoic acid suppresses oxidative stress induced endothelial cell calcium influx by altering lipid composition in membrane caveolar rafts [J].Prostaglandins Leukotrienes and Essential Fatty Acids,2010,83:37-43.
[27]Kaur P,Heggland I,Aschner M,et al.Docosahexaenoic acid may act as a neuroprotector for methylmercury-induced neurotoxicity in primary neural cell cultures[J].Neurotoxicology,2008,29:978-987.

