复方孕二烯酮阴道环组分的测定方法学研究
李春晓 王彦坤 宁美英
1.国家卫生计生委科学技术研究所药物与医用高分子材料中心(北京,100081);2.北京协和医学院研究生院3.沈阳药科大学研究生院
复方孕二烯酮阴道环的主要成分为孕二烯酮和炔雌醇,两者联用可用于女性避孕[1]。目前孕二烯酮市售药物制剂为孕二烯酮和炔雌醇复方口服片剂。美国惠氏(Wyeth)公司生产的敏定偶,其与现代临床常用的短效口服避孕药相比具有明显的临床优势,已成为全球口服避孕药的新宠。但是敏定偶(有效成份复方孕二烯酮)需每天不间断服药,漏服会明显影响其避孕效果。本课题组制备的复方孕二烯酮阴道环[2-3],可以实现恒定释放药物21d,能显著提高服药顺应性。为了对复方阴道环的质量进行控制,需要建立灵敏度高且专属性好的孕二烯酮阴道环组分检测方法。本研究按照中国药典和相关化学药物研究技术指导原则要求[4-7],参照复方孕二烯酮片质量标准(进口药品复核标准汇编2001年,标准号JX20010079),对复方孕二烯酮阴道环组分进行了测定研究。建立并验证了用于复方制剂中有关组分检测的反相高效液相色谱(HPLC)法,为复方孕二烯酮阴道环制剂的体外质量控制提供参考。
1 材料与方法
1.1 仪器与试剂
Waters 2695型 HPLC(Waters公司,美国);CLC-ODS型液相色谱柱(北京迪科马科技有限公司);SHZ-ST-A型水浴恒温振荡器(江苏省金坛市朱林盛唐仪器厂);X(S)K-160型开放式炼胶机(上海双翼橡塑机械有限公司);QLB-25D/Q型平板硫化机(上海双翼橡塑机械有限公司)。孕二烯酮(北京紫竹天工科技有限公司,含量99.16%,批号T01520120201);炔雌醇(北京紫竹天工科技有限公司,含量99.25%,批号 T00420120501);聚维酮K30(国药集团化学试剂有限公司,分析纯,批号20101222);乙 腈 (Fisher 公 司,色 谱 纯,批 号112189);甲醇(Fisher公司,色谱纯,批号110939)。
1.2 色谱条件
色谱柱:Diamonsil C18(250 mm ×4.6 mm,5 μm);流动相:乙腈 -水(50:50,v/v);检测波长:GEST 239 nm,EE 205 nm;流速:1.0 ml/min;进样量:100μl;柱温:室温。
1.3 溶液配制
对照品储备液的配制:取孕二烯酮对照品14 mg,精密称定,用乙腈-水(50:50,v/v)配制浓度为700 ng/ml的孕二烯酮对照品储备液。另取炔雌醇对照品18 mg,精密称定,用乙腈-水(50:50,v/v)配制浓度为360 ng/ml的炔雌醇对照品储备液,于4℃冷藏,备用。供试品溶液的配制:取复方孕二烯酮阴道环(含孕二烯酮14 mg,炔雌醇1.8 mg),空白区段中间切断,将孕二烯酮段与炔雌醇段分开,切碎(厚度0.5 mm)。分别置于装有100 ml甲醇的锥形瓶中,室温下磁力搅拌36 h后冰浴超声2 h,经0.45μm滤膜滤过,孕二烯酮组取续滤液1.0 ml于10 ml容量瓶中,炔雌醇组取续滤液4.0 ml于10 ml量瓶中,用乙腈-水(50:50,v/v)稀释至刻度,摇匀,分别作为孕二烯酮、炔雌醇供试品溶液,于4℃冷藏,备用。自身对照溶液的配制:精密量取孕二烯酮、炔雌醇供试品溶液各1.0 ml,分别置于100 ml量瓶中,用乙腈-水(50:50,v/v)稀释至刻度,摇匀,得孕二烯酮、炔雌醇自身对照溶液,于4℃冷藏,备用。
1.4 专属性试验
1.4.1 空白干扰试验 取处方量的空白阴道环碎片(厚度为0.5 mm)及辅料PVPK30,置于装有100 ml甲醇的具塞锥形瓶中,冰浴超声,经0.45μm滤膜滤过,取续滤液4.0 ml置于10 ml量瓶中,用流动相稀释至刻度,进样分析,记录色谱图。
1.4.2 酸破坏 取阴道环孕二烯酮段和炔雌醇段,切碎(厚度0.5 mm),称取适量(含孕二烯酮14 mg,炔雌醇1.8 mg),分别置于具塞锥形瓶中,一式3份,做备用样品。加1 mol/L盐酸溶液适量,于室温放置24 h,加0.1 mol/L氢氧化钠溶液调节至中性,参照“1.3”项下操作,制备孕二烯酮、炔雌醇酸破坏供试品溶液,摇匀待测。
1.4.3 碱破坏 备用样品加1 mol/L氢氧化钠溶液适量,于室温放置24 h,加0.1 mol/L盐酸溶液调节至中性,参照“1.3”项操作,制备孕二烯酮、炔雌醇碱破坏供试品溶液,摇匀待测。
1.4.4 氧化破坏 备用样品加3%过氧化氢试液适量,室温放置8 h,参照“1.3”项操作,制备孕二烯酮、炔雌醇氧化破坏供试品溶液,摇匀待测。
1.4.5 高温破坏 备用样品于60℃烘箱中放置24 h后取出,放至室温,参照“1.3”项操作,制备孕二烯酮、炔雌醇高温破坏供试品溶液,摇匀待测。
1.4.6 光照破坏 备用样品分别于(4500±500)Lx光照条件下放置48 h,参照“1.3”项操作,制备孕二烯酮、炔雌醇光照破坏供试品溶液,摇匀待测。
1.5 检测限
分别将孕二烯酮、炔雌醇对照品储备液进行稀释,在“1.2”项色谱条件下,按信噪比(S/N)3:1计算检出限。
1.6 重复性试验
按“1.3”项方法分别平行制备孕二烯酮、炔雌醇供试品溶液及自身对照溶液各6份,在“1.2”项色谱条件下进样分析。按主成分自身对照法计算两药未知杂质含量。
1.7 溶液稳定性试验
取“1.3”项下孕二烯酮、炔雌醇供试品溶液,照“1.2”项色谱条件,分别于0、4、8、12、24 h进样,记录各峰面积,考察样品稳定性。
1.8 有关物质检查
取3批复方孕二烯酮阴道环,按“1.3”项操作,制备孕二烯酮、炔雌醇供试品溶液及自身对照溶液,按“1.2”项色谱条件,分别精密量取两药自身对照溶液100μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%,再精密量取供试品溶液和对照液各100μl,分别进样,记录色谱图至主成分峰保留时间的2倍。供试品溶液色谱图中如有杂质峰,用自身对照法计算杂质的含量。
2 结果
2.1 专属性试验
2.1.1 空白干扰试验 孕二烯酮和炔雌醇检测条件下辅料的HPLC图谱见图1。结果显示,在相应保留时间无其他峰出现,空白硅橡胶载体及辅料不干扰孕二烯酮及炔雌醇有关物质测定。
2.1.2 强制降解试验 强制降解试验结果见图2、图3。图谱中显示,样品经酸、碱、氧化、高温、光照破坏后药物略有降解,各降解产物峰与两主药峰之间均可达到良好分离。
2.2 检测限
由色谱分析结果可知,孕二烯酮和炔雌醇的检测限分别为4 ng/ml和5 ng/ml。
2.3 重复性试验
6 份供试品溶液中孕二烯酮和炔雌醇杂质总和的RSD分别为1.6%和1.3%,方法重复性良好。
2.4 溶液稳定性试验
孕二烯酮及炔雌醇在24 h内杂质峰面积总和RSD分别为1.4%和0.9%。两药供试品溶液在24 h内均基本稳定。
2.5 有关物质检查
3 批样品测定结果见表1。结果显示所制备的3批样品分别在孕二烯酮及炔雌醇检测条件下的单杂、总杂均<0.5%。
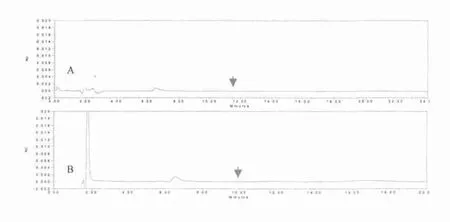
图1 孕二烯酮(A)和炔雌醇(B)检测条件下辅料的HPLC图谱
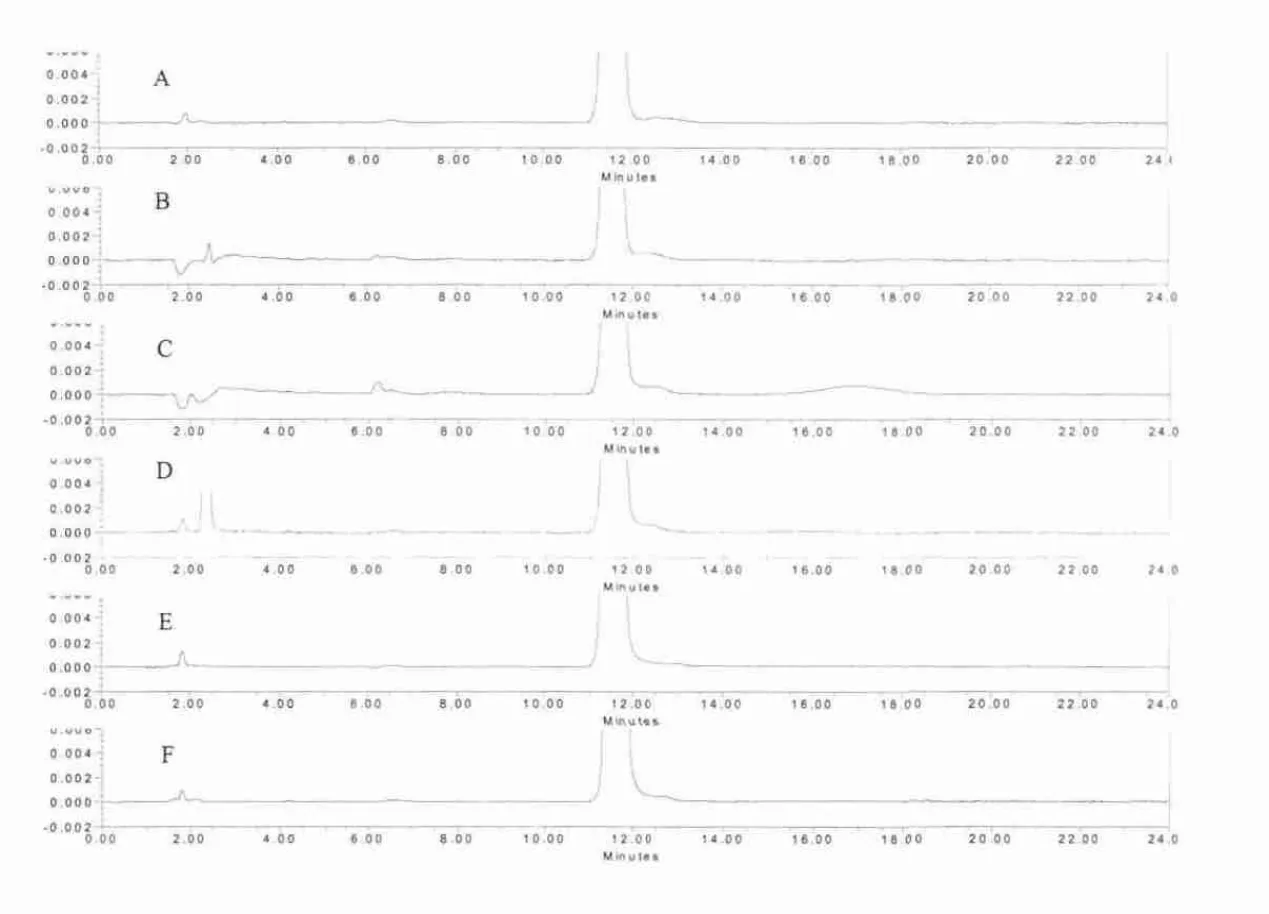
图2 阴道环中孕二烯酮在未处理(A)、酸(B)、碱(C)、氧化(D)、高温(E)、光照(F)条件下的 HPLC图谱(t1/2=11.71 min)
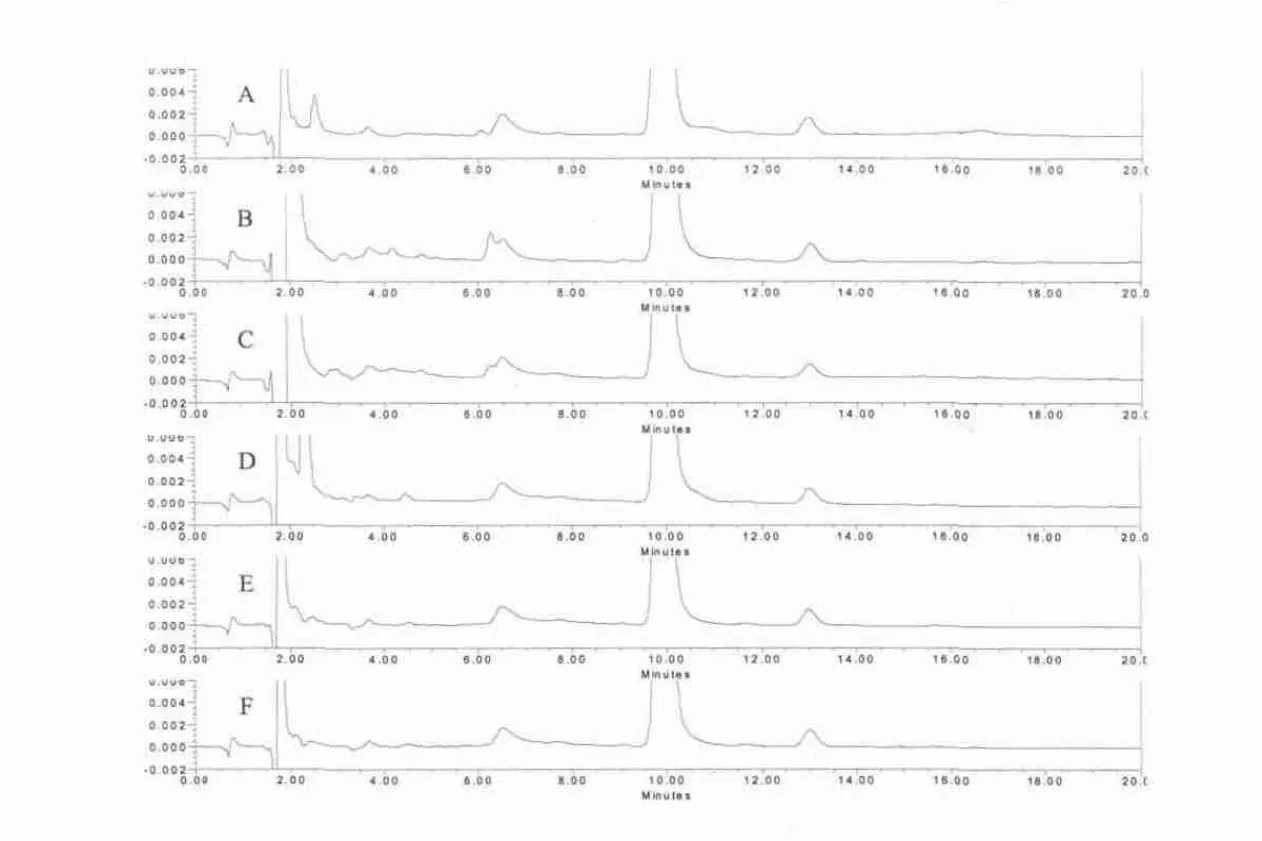
图3 阴道环中炔雌醇在未处理(A)、酸(B)、碱(C)、氧化(D)、高温(E)、光照(F)条件下的 HPLC图谱(t1/2=9.86 min)
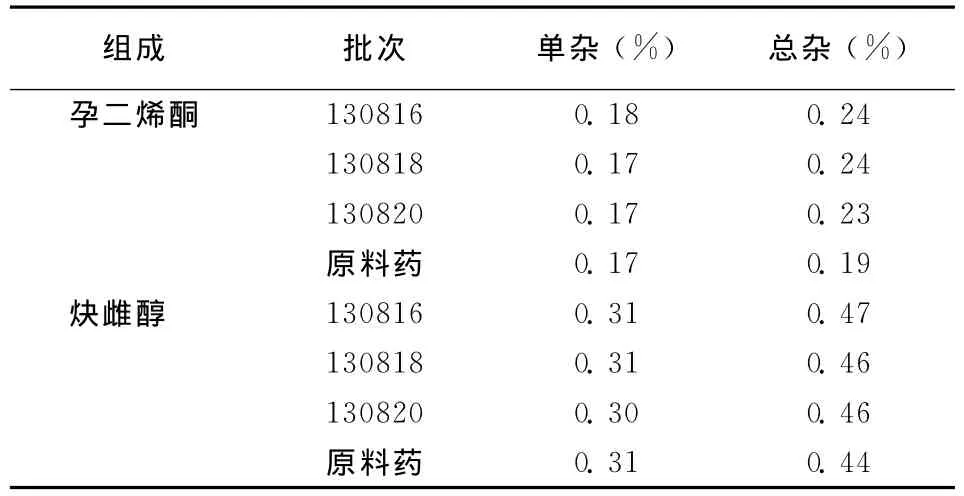
表1 复方孕二烯酮阴道环中有关物质的检测结果
3 讨论
复方孕二烯酮片质量标准中采用高效液相色谱法对两药同时进行有关物质检查及含量测定,色谱条件如下,色谱柱为C18柱,流动相为乙腈-水(40:60,v/v),检测波长为215 nm。本研究参考此标准,重新对HPLC方法进行了摸索。鉴于实验室所用高效液相色谱仪为 Waters 2695型,配备 Waters 2487型双通道紫外检测器,根据紫外扫描结果,将孕二烯酮与炔雌醇检测波长分别设定为239 nm和205 nm。方法建立之初对流动相组成进行了考察,尝试采用甲醇-水、乙腈-水、甲醇-乙腈-水为流动相,由于炔雌醇检测波长处于末端吸收,乙腈较甲醇截止波长低,且乙腈分离具有选择性好、柱压低、改善峰形等优点,故有机相选择乙腈;同时对流动相配比进行了考察,发现当配比为50:50时,峰形及保留时间最佳;最后对炔雌醇205 nm、210 nm和215 nm不同波长进行了考察,由于其释药量较低,最终选择响应最大的205 nm作为其检测波长。
本研究采用不加校正因子的主成分自身对照法对复方孕二烯酮阴道环中的有关物质进行检测和定量,专属性试验结果表明,孕二烯酮及炔雌醇能够与降解产物完全分离,辅料不干扰主药的测定。试验结果表明该HPLC专属性强,灵敏度高,可以用于复方孕二烯酮阴道环中有关组分的测定。
复方孕二烯酮阴道环有关组分的测定方法国内外未见报道,本文在复方孕二烯酮片的含量测定方法基础之上优化了检测波长,将HPLC法用于复方孕二烯酮阴道环有关组分的检测,经方法学验证专属性强,符合相关要求,可为复方孕二烯酮阴道环质量标准的制订提供科学依据。
[1] 赵爽,郑建华.第3代孕激素口服避孕药的种类与应用[J].实用妇科与产科杂志,2005,21(1):6-8.
[2] 李春晓,王彦坤,宁美英.孕二烯酮储库型阴道环的制备及释药机制的研究[J].药学学报,2014,49(3):399-405.
[3] 王彦坤,刘颖,李春晓,等.复方孕二烯酮阴道环的制备及体外释放[J].中国医院药学杂志,2014,34(14):1171-1176.
[4] 张玉琥.化学药物复方制剂杂质研究的特点及基本思路[J].中国新药杂志,2006,15(16):1327-1329.
[5] 张震,张玉琥.化学药品复方制剂中有关物质的定性归属方法[J].中国新药杂志,2008,17(21):1898-1900.
[6] 《化学药物杂质研究的技术指导原则》课题研究组.化学药物杂质研究的技术指导原则[R].2005.
[7] ICH指导委员会编.ICH药品注册的国际技术要求[M],周海均译.北京:人民卫生出版社,2006.

