乳腺原发性弥漫性大B细胞淋巴瘤临床病理观察
黎骋
乳腺原发性弥漫性大B细胞淋巴瘤临床病理观察
黎骋①
目的:通过研究乳腺原发性弥漫性大B细胞性淋巴瘤(DLBCL)的临床病理特征及免疫表型,探讨乳腺DLBCL的诊疗及预后。方法:按2008年WHO淋巴瘤分类标准,收集31例乳腺原发性DLBCL,分析其临床病理特征、免疫分型并进行诊疗随访。结果:按Ann Arbor分期标准,Ⅰ期15例,Ⅱ期14例,Ⅲ期1例,Ⅳ期1例。镜下多呈现肿瘤性淋巴细胞弥漫浸润分布,呈“哨兵样”排列,残存乳腺结构。可行免疫分型的病例均为非生发中心B细胞(GCB)型。31例患者中29例患者有完整的随访资料,随访时间5年,其中16例存活,13例死亡,生存时间5~41个月。结论:乳腺原发性DLBLC免疫表型多为非GCB型,免疫组化标记有助于确诊,治疗以手术联合化疗、放疗等为宜。
乳腺恶性肿瘤; 大B细胞淋巴瘤; 临床病理
乳腺原发性恶性淋巴瘤(primary malignant lymphoma of the breast,PBL)是一种较为少见的乳腺恶性肿瘤,在乳腺恶性肿瘤中约占3%~5%[1],在淋巴结外恶性肿瘤的中约占2.0%~2.4%[2]。据研究发现,目前绝大多数PBL都属于DLBCL[3-4]。本文收集了31例乳腺原发DLBCL的临床资料,对其临床特点、组织病理特征及影响预后的因素进行了分析,现报告如下。
1 资料与方法
1.1 一般资料 收集2005年1月-2008年1月本院乳腺原发性弥漫性大B细胞淋巴瘤患者31例,均为女性,年龄30~78岁,平均(58.24±4.65)岁。其中左乳14例,右乳15例,双乳2例。按Ann Arbor分期标准,Ⅰ期15例,Ⅱ期14例,Ⅲ期1例,Ⅳ期1例。患者均以乳房无痛性肿块为首发症状,术前临床诊断多为乳腺癌。所有患者均行手术治疗,部分予术后辅助化疗和/或放疗。乳腺原发性淋巴瘤按Wiseman和Liaor的诊断标准:(1)病理证实淋巴瘤浸润致乳腺病变;(2)影像学检查无远处器官转移;(3)身体其他器官或组织无淋巴瘤病史;所有患者均进行体格检查、乳腺钼靶摄片、CT检查以及骨髓穿刺等,按Ann Arbor分期标准进行临床分期。自病理确诊之日起进行电话追踪、问卷调查,随访截止日期2013年3月31日。
1.2 组织病理切片染色方法 (1)标本:新鲜组织标本采用福尔马林溶液固定,石蜡包埋,切片机进行4 μm薄层切片,常规HE染色。(2)组织学分型:按2008年WHO淋巴瘤分类标准,对每例进行详细的病理形态学观察并分型。(3)免疫组织化学染色:每例均予以CD20、CD79a、CD3、CD45RO、CD10、Bcl6、MUM1、Ki-67、CK 和EMA等免疫组织化学染色。染色步骤如下:切片用二甲苯进行常规脱蜡,梯度酒精和蒸馏水水化。0.5%H2O2封闭内源性过氧化酶10 min,自来水冲洗接着用蒸馏水冲洗,0.01 mol/L、pH=6.0的柠檬酸缓冲液进行高温修复抗原2 min(Ki-67等染色采用1 mmol/L、pH9.0的EDTA修复液),冷水降温后自然冷却,PBS冲洗。滴加阻断过氧化物酶(RE7102)抑制内源性过氧化物酶5 min,PBS冲洗3次×5 min,滴加二抗(NovolinkTM聚合物)孵育切片30 min,PBS洗3次×5 min,二氨基联苯胺(DAB)显色5 min,自来水洗,蒸馏水洗,苏木精复染2 min或不复染,自来水洗。脱水,透明,封片。以PBS代替一抗作空白对照,以已确诊的淋巴瘤切片和正常淋巴结切片作阳性对照。评价阳性结果采用半定量方法[4],每一种免疫标记的阳性细胞数>25%为阳性(+),阳性细胞数≤25%为阴性(-)。阳性结果即肿瘤细胞核出现清晰棕黄色颗粒,在高倍镜(×400)下选取10个具有代表性的视野,计算增殖指数=(阳性细胞数/瘤细胞总数)×100%。按Hans等[5]提出的免疫分型标准则将DLBCL分为GCB和非GCB两 型。 ①GCB型:CD10+/Bcl6+/-/MUM1+/-,CD10-/ Bcl6+/-/MUM1-;②非-GCB型:CD10-/Bcl6+/-/MUM1+。
1.3 统计学处理 采用SPSS 13.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用t检验,计数资料比较采用 χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 原发DLBCL临床及预后资料 31例患者中,29例获完整的随访资料,随访时间5年,其中16例存活,13例患者死亡,见表1。
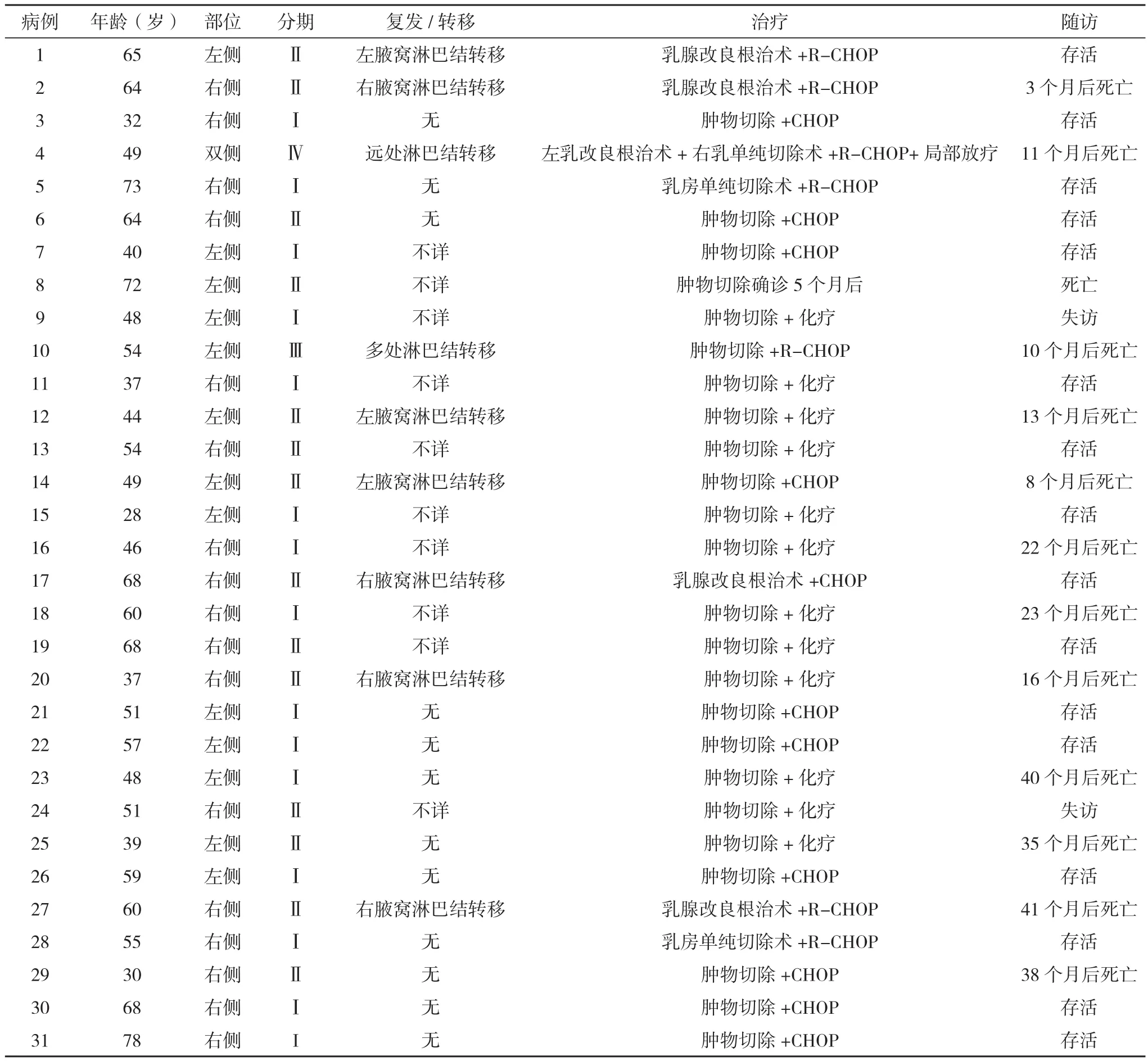
表1 31例乳腺原发DLBCL临床及预后资料
2.2 淋巴瘤病理特征 肿瘤主要由长短不一的梭形瘤细胞构成,以中-大细胞为主,呈结节状和弥漫性生长,部分区域见瘤细胞被胶原束分隔,使瘤细胞排列成束带状或结节状。肿瘤细胞核异型性明显,核膜较清楚,多数核染色质呈粗颗粒状,可有少数小核仁或单个大核仁,易见核分裂。瘤细胞侵蚀乳腺小叶及导管,致正常结构破坏,部分小叶残存,乳腺正常结构消失。少许瘤细胞浸润乳腺导管上皮形成淋巴上皮病损,或围绕残存导管和血管呈浸润性小叶癌样改变。偶见核呈肾形或马蹄铁形的大细胞;血管较丰富,见点状坏死,其间散在小淋巴细胞浸润。
2.3 原发性DLBCL的免疫组化结果 31例中有9例进行免疫组化分子表型检测,结果显示9例均为非GCB型,见表2。
3 讨论
原发性乳腺恶性淋巴瘤是一种少见的恶性肿瘤,国内报道为数甚少,几乎都发生于女性患者[6]。肿瘤多位于右侧,呈多结节性,25%发生在双侧。PBL几乎均为非霍奇金淋巴瘤,以弥漫性大B细胞淋巴瘤(DLBCL)多见,有学者研究发现PBL中48%~79%的病理类型为DLBCL。以往认为PBL的预后很差,大部分患者在诊断后2年内死亡[7]。
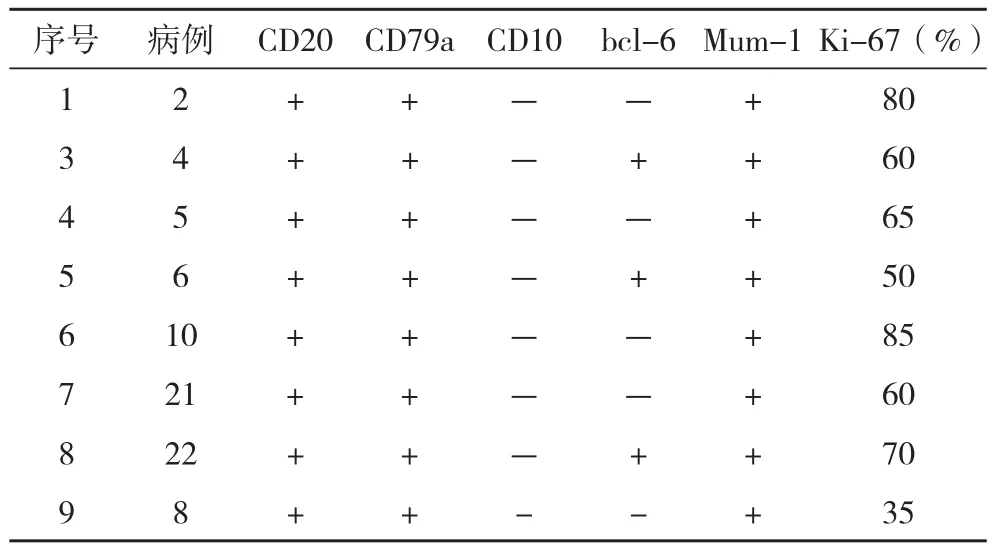
表2 9例乳腺原发性DLBCL的免疫组化结果
PBL无特异临床表现,诊断主要依靠组织病理学检查,免疫组化检测有助确诊、分型及判断预后。显微镜下乳腺结构破坏,大量淋巴样细胞弥漫浸润残存乳腺导管或小叶间隙。免疫组化检测提示上皮标记CK、EMA阴性表达,淋巴细胞CD45、B细胞标记(CD20、CD79a)或T细胞标记(CD3、CD2、CD45RO)则呈阳性表达,即可确诊PBL[8]。大多数PBL为B细胞源性的非霍奇金淋巴瘤,以弥漫性大B细胞淋巴瘤最为常见;其次为黏膜相关淋巴瘤,前者恶性程度高。DLBCL瘤细胞多呈弥漫生长,其细胞核体积巨噬细胞核不小于正常的巨噬细胞核,或超过2个正常淋巴细胞。细胞学形态多样,以CB最常见,其次为IB。部分原发性乳腺DLBCL病例可由结外边缘区B细胞淋巴瘤演进而来[9]。
鉴别诊断:(1)慢性乳腺炎:组织学检测提示以成熟的小淋巴细胞和浆细胞为背景,免疫标记无限制性免疫球蛋白轻链表达。(2)炎性乳癌、髓样癌、未分化癌:晚期乳腺癌组织学检测提示瘤细胞呈鸟巢状或腺样排列,上皮标记CK (+)、EMB(+),而淋巴细胞标记CD45(-)、CD20(-)、CD79a(-)、CD3(-)有助鉴别[10]。
原发乳腺弥漫性大B细胞淋巴瘤的标准治疗方案尚未确立,多主张以化疗联合放疗等进行综合治疗[11]。手术需获取满足病理诊断的组织标本,乳腺全切及腋窝淋巴结清扫术对患者预后有害无益应予避免[12-13],新近研究有患者尝试化疗加自体外周血干细胞移植,取得显著疗效,为新的研究方向。由于本病发病率低,随访时间短且半数失访,无法准确进行预后,需积累病例进一步研究。国外有关文献报道,原发性乳腺患者弥漫性大B细胞淋巴瘤患者5年存活率51%,10年存活率45%,预后略好于原发性中枢神经系统DLBCL,但差于甲状腺、韦氏环、胃肠道[14]。有价值的好的预后因素有:低IPI、低LDH、分期(IE期)、肿瘤大小(直径<4~5 cm)、腋窝淋巴结无转移、年龄(<65岁)、化疗、放疗,而IPI、分期、治疗选择、免疫分型预后价值更大,并且众多研究表明乳腺手术切除治疗无益于预后。
[1] Validire D,Capovilla M,Asselain B,et al.Primary breast non-Hodgkin’s lymphoma: a large single center study of initial characteristics,natural history,and prognostic factors[J].Am J Hematol,2009,84(3):133-139.
[2] Jeannenet-Sozzi W,Taghian A,Epelbaum R,et al.Primary breast lymphoma: patient profile outcome and prognostic factors. A multicentre rare cancer network study[J].BMC Cancer,2008,8(11):86.
[3] Jennings W C,Baker R S,Murray S S,et al.Primary breastlymphoma: the role of mastectomy and the importance of lymph node status[J].Ann Surg,2007,245(5):784-789.
[4] Yhim H Y,Kim J S,Kang H J,et al.Matched-pair analysis comparing the outcomes of primary breast and nodal diffuse large B-cell lymphoma in patients treated with rituximab plus chemotherapy[J].Int J Cancer,2012,131(1):235-243.
[5] Hans C P,Weisenburger D D,Greiner T C,et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J].Blood,2004,103 (1):275-282.
[6] Ryan G,Martinelli G,Kuper-Hommel M,et al.Primary diffuse Large B-cell lymphoma of the breast: prognostic factors and outcomes of a study by the international Extranodal Lymphoma Study Group[J]. Ann Oncol,2008,19(2):233-241.
[7] Martin-Arruti M,Vaquero M,Diaz D E,et al.Bcl-2 and BLIMP-1 expression predict worse prognosis in gastric diffuse large B cell lymphoma (DLBCL) while other markers for nodal DLBCL are not useful[J].Histopathology,2012,60(5):785-792.
[8] Earnest R E,Downey D M,Fox J P,et al.Recurrence of primary breast lymphoma in contralateral breast: case report and review of the literature[J].J Surg Educa, 2008,65(5):364-366.
[9] Talwalkar S S,Miranda R N,Valbuena J R,et al.Lymphomas involving the breast: a study of 106 cases comparing localized and disseminated neoplasms[J].Am J Surg Pathol,2008,32(9):1299-1309.
[10] Lin Y C,Tsai C H,Wu J S,et al.Clinicopathologic features and treatment outcome of non-Hodgkin lymphoma of the breast: a review of 42 primary and secondary cases in Taiwanese patients[J].Leuk Lymphoma,2009,50(6):918-924.
[11] Oya M,Hirahashi M,Ochi M,et al.Spontaneous regression ofprimary breast lymphoma[J].Miho Ochi Pathol Int,2009,59(9):664-669.
[12] Jeanneret-Sozzi W,Taghian A,Epelbaum R,et al.Primary breast lymphoma: Patient profile, outcome and prognostic factors. A multicentre Rare Cancer Network study[J].BMC Cancer,2008,8 (86):1-7.
[13] Stasi R,Evangelista M L,Brunetti M,et al.Analysis of differential therapeutic strategies for primary breast lymphoma: two case reports[J].Med Oncol,2009,26(1):22-26.
[14]马青山,王凤明,王世秀,等.原发性乳腺淋巴瘤临床及预后分析(附37例报告)[J].中国肿瘤临床,2008,35(21):1206-1209.
The Clinicopathological Observation of Breast Primary Diffuse Large B-cell Lymphoma
LI Cheng.//Medical Innovation of China,2014,11(03):054-056
Objective:To study the clinicopathological features and immunophenotype of breast primary diffuse large B-cell lymphoma (DLBCL),to explore the diagnosis and prognosis of breast DLBCL.Method:According to 2008 WHO lymphoma classification criteria, collected 31 cases of breast primary DLBCL, analyzed its clinicopathological features and immunophenotyping, as well as carried on the diagnosis and follow-up.Result:According to the Ann Arbor staging criteria, 15 cases were in stageⅠ,14 cases were in stageⅡ,1 case was in stage Ⅲ and 1 case was in stage Ⅳ. Microscope showed that more tumor lymphatic cells are diffuse infiltration distribution, and present an arrangement like the “sentry type”, and remain the breast structure. Feasible immunophenotype cases were all non-germinal center B cells type (GCB). Among the 31 patients, 29 patients had the complete follow-up data, in 5-year’s follow-up period, 16 patients survived and 13 died, survival time was from 5 to 41 months.Conclusion:Breast primary DLBLC immunophenotype are more non-GCB types, immunohistochemical markers are helpful in diagnosis, it is appropriate to use surgery combination chemotherapy and radiotherapy.
Breast cancer; Large B-cell lymphoma; Clinical pathology
10.3969/j.issn.1674-4985.2014.03.022
2013-07-12) (本文编辑:蔡元元)
①广西梧州市红十字会医院 广西 梧州 543002
黎骋
First-author’s address:Red Cross Hospital of Wuzhou City,Wuzhou 543002,China

