热处理对大豆油体表面的油体蛋白和外源性蛋白影响
陈业明,赵路苹,熊小辉,阮奇珺,张彩猛,华欲飞
(江南大学食品学院,江苏无锡 214122)
热处理对大豆油体表面的油体蛋白和外源性蛋白影响
陈业明,赵路苹,熊小辉,阮奇珺,张彩猛,华欲飞
(江南大学食品学院,江苏无锡 214122)
研究了热处理不同pH生豆浆和吸胀大豆种子对大豆油体上油体蛋白和外源性蛋白的影响,并通过SDS-聚丙烯酰胺凝胶电泳表征油体蛋白和外源性蛋白的变化。研究表明:热处理生豆浆和吸胀的大豆种子时,随着温度和时间的增加,都可以抑制内切蛋白酶P34的活性,有利于油体蛋白保留在油体上;而且热处理对吸胀的大豆种子效果更显著。热处理不同pH的生豆浆时,随着热处理强度和生豆浆pH的增加,外源性蛋白(主要是大豆球蛋白、伴大豆球蛋白和过敏性蛋白Bd 30K)会从油体上逐渐解离下来。在80℃、pH8.5下处理生豆浆5~30min时,油体纯度高达97%,且含有的过敏性蛋白Bd 30K低于1%。
大豆油体,油体蛋白,外源性蛋白,热处理,过敏性蛋白
大豆是世界上重要的油料作物之一,主要含有蛋白质和油脂,其中蛋白质贮存在蛋白质液泡中,油脂贮存在大豆油体中[1-2]。油体是植物种子贮存油脂的亚细胞器,主要由三酰甘油酯(TAG)、磷脂(PL)和油体结合蛋白组成。Tzen和Huang提出的油体结构模型认为,油体内部主要是甘油三酯,外部为磷脂单分子层和嵌入其内的油体结合蛋白组成的半单位膜,这个半单位膜是由13个磷脂分子和1个油体结合蛋白质分子组成[3]。油体结合蛋白质分为三类:油体蛋白(oleosin)、油体钙蛋白(caleosin)和油体固醇蛋白(steroleosin),但油体钙蛋白和油体固醇蛋白在大豆油体中含量很少。Zhao等[4]报道大豆油体有多种不同 分 子 量 的 油 体 蛋 白(主 要 是 24ku oleosin和18ku oleosin)、两种不同分子量的油体钙蛋白(27ku和29ku)和一种油体固醇蛋白(41ku)。
大豆油体富含多不饱和脂肪酸和对人体健康有益的脂溶性生物活性物质(如维生素E、磷脂和异黄酮等)[5-7],其特殊结构和功能性成分,使大豆油体成为天然的乳化剂,在食品和化妆品行业有广阔的应用前景。
在大豆油体的提取过程中,许多外源性蛋白会结合到油体表面,如大豆球蛋白、伴大豆球蛋白和过敏性蛋白Bd 30K,其中Bd 30K是大豆蛋白中一种重要的免疫显性过敏原,这给油体运用带来了安全问题。赵路苹等[8]研究发现生豆浆经过80~100℃加热15min可以得到高纯度大豆油体。Chen等[9]报道,从pH11的生豆浆中提取得到不含有过敏性蛋白(Bd 30K)的油体。由于在100℃和pH11的条件下大豆蛋白质严重变性,同时高pH提取油体不利于环境保护[10]。故本文选择较低温度(50~80℃)和较低pH(6.5~8.5)的条件,探索热处理不同pH的生豆浆和吸胀的大豆种子,对大豆油体上油体蛋白和外源性蛋白的影响,并通过SDS-聚丙烯酰胺凝胶电泳表征油体蛋白和外源性蛋白的变化,以期对在较低温度与pH下提取不含过敏性蛋白的高纯度大豆油体方法提供一定指导意义。
1 材料与方法
1.1 材料与仪器
大豆 南农88-31号,购买于南京农业大学国家大豆改良中心;蔗糖、溴酚蓝、三羧基氨基甲烷(Tris)、甘氨酸、四甲基乙二胺(TEMED)、考马斯亮蓝G250 分析纯,国药集团化学试剂有限公司;丙烯酰胺、N,N’-甲叉双丙烯酰胺、巯基乙醇 优级纯,美国Sigma公司;标准蛋白 美国Bio-Rad公司。
90型磁力搅拌器 上海泸西仪器分析厂;WH-1微型漩涡混合仪 上海泸西分析仪器厂;PHS-3C pH计 上海精密科学仪器有限公司;MJ-60BE01B组织捣碎机 美的电器有限公司;Optima L-XP超速离心机 美国Beckman Coulter;Mini-PROTEAN型垂直电泳仪、ChemiDoc XRS+凝胶成像仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 生豆浆的制备[8]将20g大豆浸泡在去离子水(1∶9,w/w)中,在4℃冰箱放置18h。向吸胀的大豆中加入新鲜去离子水至总重200g,用组织捣碎机以18000r·min-1的速度磨浆90s,用四层纱布过滤除去豆渣。滤液称为生豆浆(pH6.8)。
1.2.2 热处理不同pH的生豆浆 1.2.1制备的生豆浆分为三组,第1组不调pH,作为对照;第2、3组分别调pH7.5和8.5。三组生豆浆分别在50、60、70、80℃水浴锅中加热0、1、2、5、15、30min,取出后立即水冷却。通过考察50~80℃加热不同pH生豆浆0~30min,探究对大豆油体蛋白和外源性蛋白质的影响。
1.2.3 热处理吸胀的大豆种子 将20g大豆浸泡在去离子水(1∶9,w/w)中,在4℃冰箱放置18h。然后,向吸胀的大豆中加入新鲜去离子水至总重200g,分别在60、70、80℃水浴锅中保温0、5、15、30、45、60min,立即在水中冷却,18000r·min-1磨浆90s,纱布过滤除去豆渣,得到不同条件下的豆浆。
1.2.4 大豆油体的提取方法 油体提取方法参考赵路苹等[8]报道的方法,向热处理的不同pH生豆浆和热浸泡大豆后制备的豆浆中,分别加10%蔗糖(w/w)搅拌10min,取8.5g上述混合溶液加入超速离心管中,再在超速离心管上层加3g去离子水。4℃,35000r·min-1离心60min。收集上浮(油体),用去离子水冲洗3次,去除表面粘附的溶液。提取的油体以1∶10(w/w)溶于去离子水。
1.2.5 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE) SDSPAGE参考Laemmli[11]的方法,浓缩胶浓度为5%,分离胶浓度为12.5%。样品溶解液为0.25mol·L-1Tris-HCl(pH6.8),1%SDS,2% 巯基乙醇和0.02%溴酚蓝。取油体样品0.5mL,加入0.5mL样品溶解液,在漩涡混合仪 上 混 匀 ,煮 沸3min,12000r·min-1离 心10min,取 下层清液上样。样品在浓缩胶中电流为15mA,样品进入分离胶后将电流调为25mA,溴酚蓝距前沿约1cm时停止电泳,再固定、染色和脱色。用凝胶成像仪拍照,电泳分析使用QuantityOne1-D分析软件。
2 结果与分析
2.1 不同pH生豆浆的热处理结果与分析
2.1.1 热处理pH6.8生豆浆对大豆油体蛋白和外源性蛋白的影响 从图1可以看到,生豆浆提取的油体上有很多种蛋白,包括内源性蛋白和外源性蛋白。内源性蛋白主要是24ku oleosin和18ku oleosin,外源性蛋白主要是大豆球蛋白(A3、酸性肽链与碱性肽链)、β-伴大豆球蛋白(α、α’与β)、γ-伴大豆球蛋白和30ku(Bd 30K和P34)。其中,Bd 30K是大豆中主要的过敏性蛋白,P34是特异性水解大豆油体蛋白的一种内切蛋白酶[12]。图中16ku是24ku oleosin水解的肽段。根据Zhao等[4]报道,4℃下从pH6.8生豆浆中提取的大豆油体于室温放置1h后,24ku oleosin被内切蛋白酶P34水解,产生16ku的肽段。
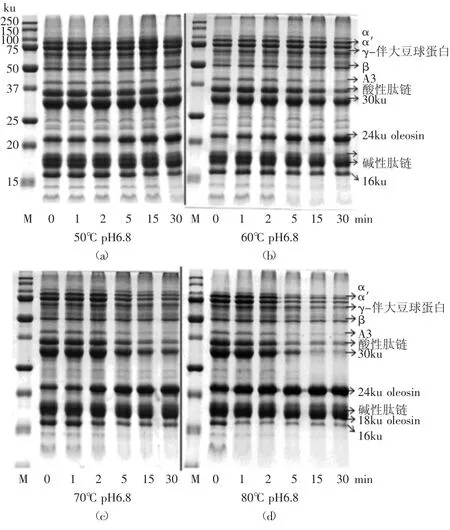
图1 热处理pH6.8生豆浆对大豆油体蛋白和外源性蛋白的影响Fig.1 Effect of heat treatment of pH6.8 raw soymilk on oleosins and extrinsic proteins
从图1可以看出,未经热处理的生豆浆(pH6.8)中提取的油体上,24ku oleosin较少,16ku肽段较多。然而随着热处理温度和时间的增加,24ku oleosin在油体上保留较多,16ku的肽段减少。50℃加热15min、60℃加热5min、70℃加热2min及80℃加热1min以上,24ku oleosin保留在油体上较多,水解产生的16ku肽段较少。这是因为:未经热处理的生豆浆中存在内切蛋白酶P34,热处理可使内切蛋白酶P34活性受抑制,那么24ku oleosin水解程度降低,更多的油体蛋白保留在油体上,产生较少的16ku肽段。经过电泳分析软件计算,随着热处理强度的增加,18ku oleosin含量变化不明显。
此外,从图1还可以看出,随着pH6.8生豆浆热处理温度和时间的增加,油体上外源性蛋白质从大豆油体表面解离的越来越多。外源性蛋白从油体上解离下来的原因可能:生豆浆中大豆球蛋白的变性温度为(90±2)℃,β-伴大豆球蛋白的变性温度为变性温度为(70±2)℃[13],热处理强度增加时,油体表面结合的外源性蛋白发生不同程度变性,改变这些蛋白的表面性质[14],从而减弱了与油体间的相互作用力。经过电泳分析软件得知,80℃热处理15~30min生豆浆,所提取油体上90%的外源性蛋白质解离下来,且30ku占总蛋白含量的5%以上,得到较高纯度油体。

图2 热处理pH7.5生豆浆对大豆油体蛋白和外源性蛋白的影响Fig.2 Effect of heat treatment of pH7.5 raw soymilk on oleosins and extrinsic proteins
2.1.2 热处理pH7.5生豆浆对大豆油体蛋白和外源性蛋白的影响 图2可以看出,未经加热的生豆浆(pH7.5),24ku oleosin保 留 在 油体上 较 少 ,16ku肽 段较多;当热处理时间和温度增加时,24ku oleosin在油体上保留较多,16ku逐渐减少。50℃加热15min、60℃加热5min、70℃加热2min以上,较多24ku oleosin保留在油体上,水解产生较少的16ku肽段。与热处理pH6.8生豆浆中提取的油体相比,在相同热处理强度下,pH7.5生豆浆得到的油体上保留更多的24ku oleosin,水解产生的16ku肽段更少。这说明除温度外,增加生豆浆pH也可以抑制P34活性。但是,当80℃加热pH 7.5生 豆 浆1min 以 上 ,P24 oleosin 没 有 明 显 变 化 ,而16ku肽段比70℃加热时的多,甚至也比80℃加热pH6.8生豆浆的多,导致这一现象的原因还有待研究。综上所述,增加温度和pH可以抑制内切蛋白酶P34活性,有利于油体蛋白保留在油体上。
此外,随着热处理强度的增加,外源性蛋白逐渐从油体上解离下来。在相同热处理强度下,pH7.5比pH6.8的生豆浆中所提取油体上结合的外源性蛋白质(尤其是30ku)少,经电泳分析软件计算,70℃加热15~30min和80℃加热5~30min可以去除95%以上的外源性蛋白。其中70℃加热15~30min时30ku占总蛋白含量的4.5%以上;80℃加热5~30min时,30ku占总蛋白含量的1.9%~2.7%。

图3 热处理pH8.5生豆浆对大豆油体蛋白和外源性蛋白的影响Fig.3 Effect of heat treatment of pH8.5 raw soymilk on oleosins and extrinsic proteins
2.1.3 热处理pH8.5生豆浆对大豆油体蛋白和外源性蛋白的影响 从图3可以看出,50~70℃热处理pH8.5生豆浆中提取的油体上,24ku oleosin在1~30min内都没有明显变化,水解产生很少的16ku肽段。在相同热处理强度下,pH8.5抑制内切蛋白酶P34的活性比pH6.5和pH7.5下作用更强,外源性蛋白质从油体上解离下来的程度更大,且获得高纯度油体的加热时间减少。这可能是因为纯油体和外源性蛋白质在中性条件下带有负电[15],随着生豆浆pH的增加,油体及大豆蛋白质带负电荷增加,导致油体和外源性蛋白质之间的静电斥力增加,促进外源性蛋白从油体上解离下来。因此,70℃加热15~30min及80℃加热5~ 30min可以去除97%以上的外源性蛋白。且经电泳分析软件计算,在70℃加热15~30min时30ku占总蛋白含量的1.2%~1.5%;80℃加热5~30min时30ku占总蛋白含量的0.7%~0.9%。
2.2 热处理吸胀大豆种子对大豆油体蛋白和外源性蛋白的影响
在成熟的植物种子中,蛋白质贮存液泡与油体是独立的亚细胞器[16],吸胀的大豆种子经过磨浆,蛋白质贮存液泡破碎,释放出的蛋白质通过作用力结合到油体表面。本实验探究热处理吸胀的大豆种子对油体蛋白和外源性蛋白的影响。
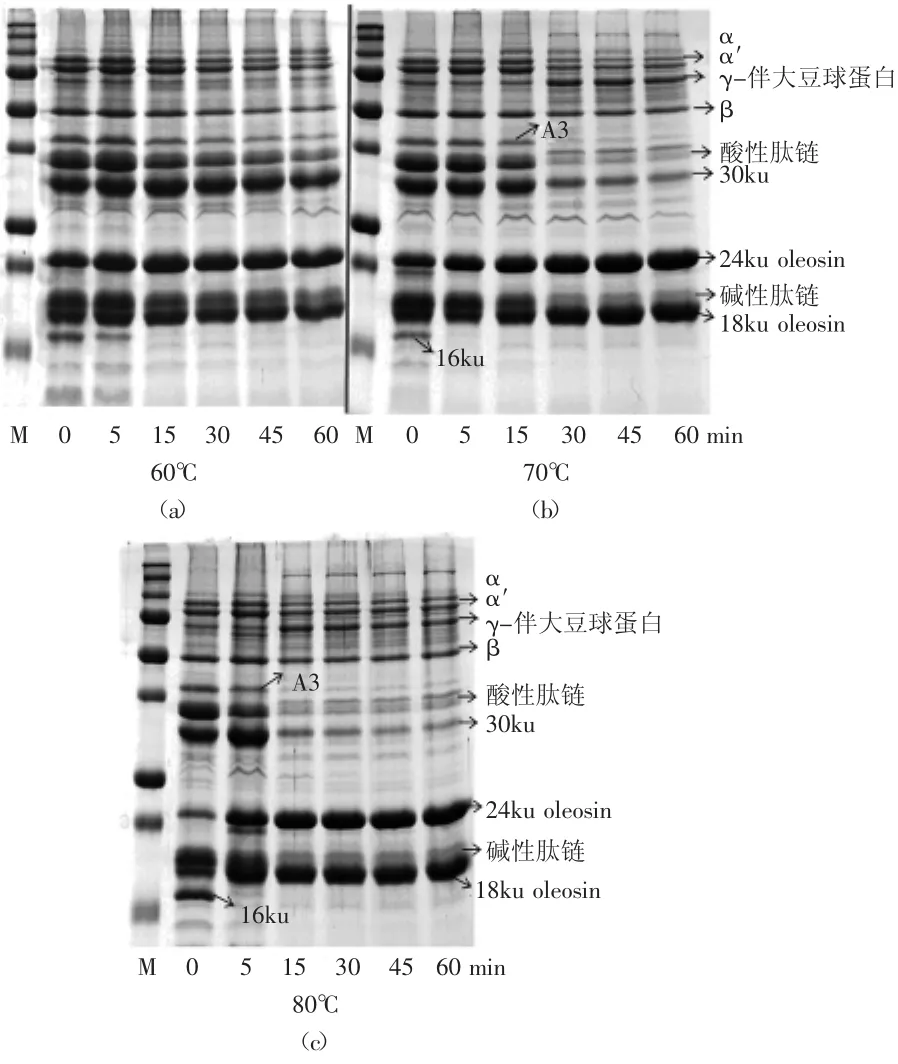
图4 热浸泡大豆种子对大豆油体蛋白和外源性蛋白的影响Fig.4 Effect of heat treatment of soybean seed on oleosins andextrinsic proteins
通过图4可以看出,60℃浸泡15~60min和70、80℃浸泡5~60min都会使内切蛋白酶P34失活,24ku oleosin和18ku oleosin含量变化不显著,16ku肽段没有出现。浸泡温度为60℃时,即使浸泡60min,油体上结合的外源性蛋白仍很多,油体纯度低;70℃浸泡处理30min和80℃浸泡15min以上,油体上结合的外源性蛋白明显减少,油体纯度增加。这说明,热处理吸胀大豆种子可以有效抑制P34的活性。与热处理生豆浆相比,热处理吸胀的大豆种子更有利于减少油体蛋白的水解。导致这一结果的可能原因:吸胀的大豆种子经过热处理时,贮存液泡内的大豆蛋白质会发生不同程度的变性,种子磨浆后变性的大豆蛋白质从贮存液泡里释放出来,变性的蛋白质不容易结合到油体表面,同时P34也在磨浆之前活性受抑制,即使磨浆后结合到油体表面,其活性也很低。
3 结论
本文考察了pH6.8、7.5、8.5生豆浆的热处理和大豆种子的热浸泡对大豆油体表面油体蛋白和外源性蛋白的影响。研究表明:
3.1 热处理生豆浆和吸胀的大豆种子,对18ku oleosin影响不显著。
3.2 生豆浆和大豆种子未经热处理时,24ku oleosin被内切蛋白酶P34水解而在油体上保留较少,同时产生16ku肽段;热处理强度和pH的增加会抑制P34活性和促进外源性蛋白的从油体上解离。
3.3 增加生豆浆的pH、热处理的温度及热处理的时间,可以更多的去除油体表面的外源性蛋白质,增加油体的纯度,同时促进过敏性蛋白Bd 30K的去除,更有利于油体在食品和化妆品行业的应用。
综上所述,生豆浆pH8.5,经80℃加热5~30min处理,高速离心得到的油体纯度高达97%,且含有的过敏性蛋白Bd 30K低于1%。
[1]韩宝达,李立新.植物种子贮藏蛋白质及其细胞内转运与加工[J]. 植物学报,2010,45(4):492-505.
[2]IWANAGA D,GRAY D A,FISK I D,et al.Extraction and characterization of oil bodies from soy beans:A natural source of pre-emulsified soybean oil[J].Journal of Agricuture and Food Chemistry,2007,55:8711-8716.
[3]TZEN J T C,HUANG A H C.Surface structure and properties of plants seed oil bodies[J].The Journal of Cell Biology,1992,117:327-335.
[4]ZHAO L,CHEN Y,CAO Y,et al.The Integral and Extarinsic Bioactive Proteins in the Aqueous Extracted Soybean Oil Bodies [J].Journal of Agricuture and Food Chemistry,2013,61(40):9727-9733.
[5]WHITE D A,FISK I D,GRAY D A.Characterisation of oat(Avena sativa L.) oil bodies and intrinsically associated E-vitamers[J].Journal of Cereal Science,2006,43:244-249.
[6]FISK I D,GRAY D A.Soybean(Glycine max) oil bodies and their associated phytochemicals[J].Journal of Food Science,2011,76:1349-1354.
[7]FISK I D,WHITE D A,CARVALHO A,et al.Tocopherol-an intrinsic component of sunflower seed oil bodies[J].Journal of the American Oil Chemists’Society,2006,83:341-344.
[8]赵路苹,陈业明,张彩猛,等.提取条件对大豆油体表面蛋白质的影响[J]. 大豆科学,2013,32(6):835-839.
[9]CHEN Y,ONO T.Simple extraction method of non-allergenic intact soybean oil bodies that are thermally stable in an aqueous medium[J].Journal of Agricultural and Food Chemistry,2010,58(12):7402-7407.
[10]FRIEDMAN M,LEVIN C E,NOMA A T.Factors governing lysinoalanine formation in soy proteins[J].J Food Sci,1984,49,1282-1288.
[11]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[12]CHEN Y,ZHAO L,CAO Y,et al.Oleosins(24 and 18 kDa)are hydrolyzed not only in extracted soybean oil bodies but also in soybean germination[J].Journal of Agricultural and Food Chemistry,2014,62(12):956-965.
[13]汪立君,李里特,张晓峰,等.利用DSC对大豆蛋白质热变性的研究[J]. 中国农业大学学报,2001,6(6):93-96.
[14]PETRUCCELLI S,ANON M C.Thermal aggregation of soy protein isolates[J].Journal of Agricultural and Food Chemistry, 1955,43:3035-3041.
[15]TZEN J T C,CAO Y Z,LAURENT P,et al.Lipids,proteins and structure of seed oil bodies from diverse species[J].Plant Physiology,1993,101(1):267-276.
[16]KATAVIC V,AGRAWAL G K,HAJDUCH M,et al.Protein and lipid composition analysis of oil bodies from two Brassica napus cultivars[J].Proteomics,2006(6):4586-4598.
Effect of heating on oleosins and extrinsic proteins from soybean oil bodies
CHEN Ye-ming,ZHAO Lu-ping,XIONG Xiao-hui,RUAN Qi-jun,ZHANG Cai-meng,HUA Yu-fei
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Effect of heat treatment of soybean seed and different pH value of raw soybean milk on oleosins and extrinsic proteins from soybean oil bodies were studied,and oleosins and extrinsic proteins were characterized by SDS-PAGE.The conclusions were demonstrated as three points.When soybean seed of imbibition and raw soybean milk were treated by heat,the endo protease activity of P34 was inhibited with increasing of temperature and time.Consequently,it was benefical for oleosin keeping at oil body and the effect of heat treatment on soybean seed of imbibition was more remarkable than raw soybean milk.Extrinsic proteins(including glycinin,conglycinin,and allergic protein of Bd 30K)were gradually hydrolyzed from oil body with increasing of heat treated strength and pH when raw soybean milk with different pH walues was heated.The purity of oil body and content of Bd 30K were 97%and under 1%respectively when oil body was prepared from raw soybean milk at 80℃,pH8.5,and 5~30min.
soybean oil body;oleosins;extrinsic proteins;heating;allergic protein
TS214.2
A
1002-0306(2014)22-0106-05
10.13386/j.issn1002-0306.2014.22.015
2014-02-17
陈业明(1982-),男,副教授,研究方向:粮食、油脂及植物蛋白。
* 通讯作者:华欲飞(1962-),男,教授,研究方向:粮食、油脂及植物蛋白。
国家自然科学青年基金(31301496);江南大学博士研究生科学研究基金项目(JUDCF10025)。

