α-蒎烯衍生物的制备及其室内毒力测定1)
陈旭日 马 玲 曹传旺 邱本军 韩旭洋 罗 帅 杨 洋
(东北林业大学,哈尔滨,150040)
责任编辑:程 红。
当今人们的环保意识不断提高,广谱的化学农药由于对环境造成严重污染而受到严格限制,探索新型高效易得杀虫药剂替代化学农药进行有害生物综合防治成为当今各国科研工作者关注的热门话题[1]。松节油是我国丰富的自然资源,其主要成分是α-蒎烯,通过蒸馏可直接将α -蒎烯从松节油中分离出来[2],其本身具有一定的生物活性。α -蒎烯具有一定的杀虫和抑菌活性[3]。已有研究表明,α-蒎烯对松纵坑切梢小蠹(Tomicus piniperda)和黑条木小蠹(Trypodendron lineatum)具有较强引诱作用[4-6],对杂拟谷盗(Tribolium confusum)成虫有较强的触杀、驱避作用[7]。α-蒎烯以及含有α-蒎烯的植物精油对储藏物害虫衣鱼(Lepisma saccharina)、大田害虫棉铃虫(Helicoverpa armigera)、大麦虫(Zophobas morio)[8]、斜纹夜蛾(Spodoptera litura)、土传病菌尖孢镰刀菌(Fusarium oxysporum)具有良好的控制作用[9-10]。α -蒎烯是一种单萜烯,它含有特殊的双环双键结构,因而具有较高的反应活性及独特的反应多样性[11-12]。利用α -蒎烯的不同性质,可以将其合成一系列精细化工原料或产品,已有人对抑菌[13]和线虫[14]防治做了一系列深入地研究。但是,目前合成的α -蒎烯的衍生物作为杀虫剂还很少。因此,α-蒎烯以及含有α-蒎烯的植物精油在有害生物防治领域具有很高的研究价值和广阔的开发利用前景[15],值得进一步深入研究。为使杀虫效果更理想,本研究以廉价易得的α-蒎烯为原料,通过对α -蒎烯几种不同结构的修饰,合成系列新型的化合物并探索其杀虫活性,最终筛选出具有良好杀虫活性的化合物。
1 材料与方法
1.1 材料
仪器和试剂:α -蒎烯,分析纯99.5%,购自美国Sigma 公司;丙酮(98.0%)、无水乙醇(分析纯)、四氯化碳(95%)、N-溴代丁二酰亚胺(分析纯)、苯胺(98%)、三氟化硼乙醚(98.5%)、硼氢化钠(分析纯)、环 己 胺(95%)、甲 醇(95%)、乙 酸 乙 酯(95%)、石油醚(95%)等均由天津市永大化学试剂有限公司生产;所用仪器包括BrukerAV400 MHz 核磁共振仪(美国Nicolet 公司);Agilent 6890 气相色谱仪(美国Agilent 公司);Agilent 5973 质谱仪(美国Agilent 公司);Nicolet380FT -IR 红外光谱仪(美国Nicolet 公司)。
供试昆虫:大麦虫购自哈尔滨大发花鸟鱼市场,带回实验室置于温度(25 ±1)℃、相对湿度(65 ±2)%、光周期12 h 黑暗12 h 光照的恒温培养箱中用麦麸饲养。室内驯化一段时间选择健壮,大小、颜色基本一致的3 龄幼虫用于试验。
1.2 方法
1.2.1 合成路线
α-蒎烯7 种衍生物的合成路线见图1。
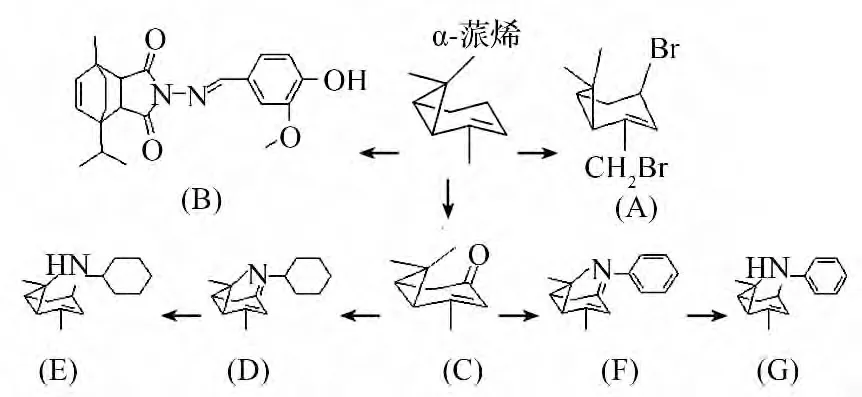
图1 α-蒎烯衍生物的合成路线
制备1 -溴-2 -(溴甲基)-7,7 -二甲基[4.1.0]庚-2 -烯(A):α-蒎烯0.688 g、N-溴代丁二酰亚胺1.908 9 g、30 mL 四氯化碳在室温下反应15 h,反应终止后先过滤,然后经Na2SO4干燥得到粗产物,再经乙酸乙酯和石油醚硅胶柱进一步分离纯化。具体操作方法参照文献[16 -17]。
制备3 -甲氧基-4 -羟基苯基-α-蒎烯马来酰亚胺基酰腙(B):参照文献[18 -19]的合成路线合成化合物B。1HNMR(600 MHz,CDCl3)δ:8.78(s,1H,C15-H),7.53(d,J =1.9 Hz,1H,C6H3),7.16(dd,J=8.1,1.8 Hz,1H,C6H3),6.93(dd,J =8.1,1.5 Hz,1H,C6H3),6.03(t,J=13.0 Hz,2H,C8-H),5.97(d,J=8.5 Hz,1H,C7-H),3.93(d,J =3.7 Hz,3H,OCH3),3.03(d,J=8.1 Hz,1H,C2-H),2.62~2.70(m,2H,C5-H,C11-H),1.50~1.57(m,4H,C14-H,C9-Ha),1.44~1.50(m,1H,C10-Ha),1.341.40(m,1H,C9-Hb),1.27~1.33(m,1H,C10-Hb),1.13(d,J=6.8 Hz,3H,C13-H),1.0(d,J=6.9 Hz,3H,C12- H):MS(ESI)m/z:381.0([M -H]-).Anal.calcd for C22H26N2O4:C69.09,H6.85,N7.32;foundC69.27,H6.83,N7.34。
制备马鞭草烯酮(C):在以乙醇为溶剂、反应温度为70 ℃、反应时间为6 h、氯化铜用量为1%、叔丁基过氧化氢(TBHP)用量为4 倍、氧气流量为25~35 mL·min-1的最佳条件下,α - 蒎烯转化率可达100%,主 要 产 物 马 鞭 草 烯 酮[20]的 产 率 为83.7%。1HNMR(300 MHz,CDCl3)δ/ × 10-6:1.02(s,3H),1.47(s,3H),2.00(d,3H,J =1.9 Hz),2.10~2.08(m1H),2.42(m,1H),2.70~2.62(m,1H),2.91~2.80(m,1H),5.71(m,1H).IR(KBr)/cm-1:3026.99(C = C2H),2 922.37,2 834.23(C2H),1 682.70(C=O),1 468.99,1 436.63,1 365.71(2CH3,2CH2).MS(70 eV)m/z:150(M+),135,122,107,91,80,67,55,39,27。
制备(10z)-N-(5.7.7 -三甲基[4.1.0]庚-4 -乙二胺-3 -亚基)环己胺(D):称量C2.668 0 g、环己胺9.104 0 g、三氟化硼乙醚0.288 3 g、甲苯40 mL 加入到有分水器和冷凝器的烧瓶中回流冷凝20 h,反应结束后用水和饱和食盐水洗涤呈中性,再经Na2SO4干燥得到粗产物,最后经过硅胶柱色谱柱进行纯化。1HNMR(400 MHz,DMSO -d6)0.799(s,3H,C8-3H),0.797(d,J =7.2 Hz,3H,C10-3H),1.177(s,3H,C9-3H),1.758~1.872(m,2H,C2-H,C7-H),1.930~2.050(m,2H,C1-H,C5-H),2.218~2.330(m,2H,C4-H,C7-H),2.33~2.395(m,1H,C4-H);IR(KBr)/cm-1:2 984(CH3),2 930(CH2),2 885(CH3),3 026.99(C =C2H),1 646(C=N),1 474(CH2),1 449(CH3),1 368[(CH3)2],1 325~1 030(C - C),964(CH2);MS(70 eV)m/e(%)29(M+,3),41(M+,18),55(M+,43),67(M+,7),77(M+,3),83(M+,100),95(M+,7),110(M+,5),123(M+,43),137(M+,7),150(M+,3),164(M+,5),178(M+,2),196(M+,6),218(M+,7),233(M+,20)。
制备N-环己基-5.7.7 -三甲基[4.1.0]庚-4 -乙二胺-3 -胺(E):称取D0.509 7 g,甲醇20 mL 加入到烧瓶内,在冰浴条件下冷却至0~5 ℃,始终控制体系温度在0~5 ℃,分批次地加入硼氢化钠,加完硼氢化钠后移除冰浴并在室温条件下反应,直到无气泡产生时加入一定量的水终止反应。然后用石油醚萃取3 次,并合并有机相。将有机相先用水和饱和食盐水洗涤呈中性,再经Na2SO4干燥得到粗产物,最后经过硅胶色谱柱进行分离纯化。1HNMR(400 MHz,DMSO -d6)0.800(s,3H,C8-3H),0.968(d,J =7.2 Hz,3H,C10-3H),1.169(s,3H,C9-3H),1.261~1.371(m,2H,C4-H,C7-H),1.404~1.500(m,1H,C1-H),1.576~1.649(m,1H,C5-H),1.998~1.864(m,3H,C4-H,C7-H),2.539~2.600(m,1H,C3- H);IR(KBr)/cm-1:3 026.99(C = C2H),2 984(CH3),2 922(CH2),2 854(CH3),1 367(CH3),1 259~1 034(C-C),899(CH2),721(CH2);MS(70 eV)m/e(%)41(M+,14),44(M+,42),55(M+,24),82(M+,38),96(M+,26),110(M+,31),125(M+,100),139(M+,31),152(M+,7),235(M+,1)。
制备(10z)-N-(5.7.7-三甲基[4.1.0]庚-4-乙二胺-3-亚基)苯胺(F):称取C 7.253 2 g、苯胺1.454 4 g、三氟化硼乙醚0.929 7 g,甲苯60 mL 作带水剂加入到有分水器和冷凝器的烧瓶中回流冷凝35 h,反应结束后用水和饱和食盐水洗涤呈中性,再经过Na2SO4干燥得到粗产物,最后经过硅胶柱色谱柱进行 分 离 纯 化。1HNMR(400 MHz,DMSO -d6)0.799(s,3H,C8-3H),0.979(d,J =7.2 Hz,3H,C10-3H),1.223(s,3H,C9-3H),1.264~1.450(m,2H,C4-2H),1.758~1.878(m,2H,C2-H,C7-H),1.930~2.054(m,2H,C1-H,C5-H),2.059~2.210(m,1H,C7-H);IR(KBr)/cm-1:3 079,3 059,3 021(CH),3 026.99(C = C2H),2 936(CH3),2 920(CH2),2 872(CH3),1 647(C = N),1 441,1 485,1 594(C=C),1 416(CH2),1 371(CH3),1 321~1 026(C - C),778,699(CH);MS(70 eV)m/e(%)29(M+,4),41(M+,5),51(M+,6),55(M+,6),69(M+,1),83(M+,1),102(M+,7),118(M+,100),130(M+,18),145(M+,8),158(M+,3),172(M+,2),188(M+,5),210(M+,3),228(M+,20)。
制备5.7.7 -三甲基-N -苯基[4.1.0]庚-4-乙二胺-3 -胺(G):称取F 0.596 3 g,甲醇40 mL加入到烧瓶内,在冰浴的条件下冷却至0~5 ℃,始终控制体系温度在0~5 ℃范围内分批次加入硼氢化钠,加完硼氢化钠后移除冰浴并在室温条件下反应,直到无气泡产生时加入一定量的水终止反应。然后用石油醚直接萃取3 次,并合并有机相。将有机相先用水和饱和食盐水洗涤呈中性,再经过Na2SO4干燥得到粗产物,最后经过硅胶色谱柱进行分离纯化。1HNMR(400 MHz,DMSO -d6)0.922(s,3H,C8-3H),1.089(d,J =6.4 Hz,3H,C10-3H),1.285(s,3H,C9-3H),1.480(d,J=10 Hz,1H,C7-H),1.608(dd,J1 =J2 =Hz,1H,C1-H),1.780(t,J=5.6 Hz,1H,C5-H),1.844~1.898(m,1H,C4-H),1.994~2.034(m,1H,C7-H),2.118~2.172(m,1H,C4-H),2.528~2.597(m,1H,C2-H),3.383(dd,J1 =8.4 Hz,J2 =8.2 Hz,1H,C3- H);IR(KBr)/cm-1:3 368(NH),3 026.99(C = C2H),3 083,3 050,3 013(CH),2 951(CH3),2 906(CH2),2 866(CH3),1 601,1 503,1 462(C=C),1 458(NH),1 370(CH3),1 316~1 038(C-C),988~1 039(C -C),988,865(CH2),747,692(CH);MS(70 eV)m/e(%)29(M+,5),55(M+,4),78(M+,16),102(M+,10),118(M+,100),133(M+,17),146(M+,4),172(M+,3),229(M+,15)。
1.2.2 毒理试验
在每个养虫瓶中放入健康的、龄期统一的大麦虫幼虫15 头,瓶内置放用同一打孔器打孔的直径为1 cm 包菜叶片60 片,每片叶片被药液浸渍10 s 后取出并在自然条件下晾干;每个药剂配置6 个质量浓度,每个质量浓度3 个重复,清水处理作为对照,观察大麦虫的中毒症状并及时挑出死亡个体;分别于12、24、36、48、60、72 h 后统计死亡数。(以探针触碰试虫,试虫对机械刺激无反应者视为死亡)以不施药的12、24、36、48、60、72 h 大麦虫幼虫为空白对照。以24、48、72 h 为例来进行分析。
校正死亡率=((处理死亡数-对照死亡数)/处理死亡数)×100%。
1.2.3 数据统计分析
目标产物都是按照合成路线进行的,而且得到的化合物和预想的完全相同。用这7 种化合物对大麦虫进行毒力试验,运用SPSS 19 软件进行数据处理,采用Duncan’s 方法进行显著性分析(α =0.05),通过对比筛选出比较理想的药物。采用POLO软件计算药物对大麦虫幼虫95%置信区间内的半致死浓度(LC50)。
2 结果与分析
2.1 24 h 室内毒力试验
由表1可以看出,每种药物对供试昆虫均有一定程度的毒力作用。随着药液质量浓度的增大,大麦虫的死亡率也有一定的增大趋势,其中化合物B和F 的对大麦虫的毒杀作用是最为明显。在0.001、0.010、0.100、1.000、10.000、100.000 mg·L-1浓度时B 和F 对大麦虫的致死率分别是6.31%、16.45%、20.13%、22.08%、24.67%、26.96%和10.08%、16.33%、20.58%、23.87%、26.11%、30.76%。
2.2 48 h 室内毒力试验
由表1可以看出,室内毒力试验48 h 后,各药物对大麦虫的毒力效果明显增大,说明这些药物对昆虫的毒力有一定的延续作用。化合物B 和F 对大麦虫的毒杀作用较其他化合物仍是最显著的,而且比24 h 大麦虫的死亡率增大较明显。在化合物B和F 作用下,从低质量浓度到高质量浓度大麦虫的死亡 率 分 别 为13.23%、22.66%、25.45%、29.33%、40.15%、46.08% 和20.41%、26.14%、33.66%、43.89%、46.50%、53.36%。
2.3 72 h 室内毒力试验
由表1可知,处理组的大麦虫明显比对照组的死亡率高,而且随着时间的增加各种化合物的毒力作用也更突显。化合物B 和F 对大麦虫的毒杀作用比其它处理组更为明显,大麦虫在72 h 的死亡率从低质量浓度到高质量浓度依次为20.01%、36.23%、46.13%、60.11%、63.25%、70.54%和30.22%、46.41%、53.14%、60.35%、73.33%和86.51%。

表1 α-蒎烯衍生物24 h 时不同药物对大麦虫的毒杀作用
2.4 不同药物在不同时间对大麦虫幼虫的毒力作用
在72 h 对化合物B 和F 进行统计分析(表2)。由表2可以看出,两种化合物B 和F 在72 h 后的卡方值分别为3.04 和1.79。在置信区间为95%时,B和F 对大麦虫作用的LC50分别为543、43 μg·L-1。通过比较可以进一步证明化合物F 比化合物B 对大麦虫的毒力作用更有优势。
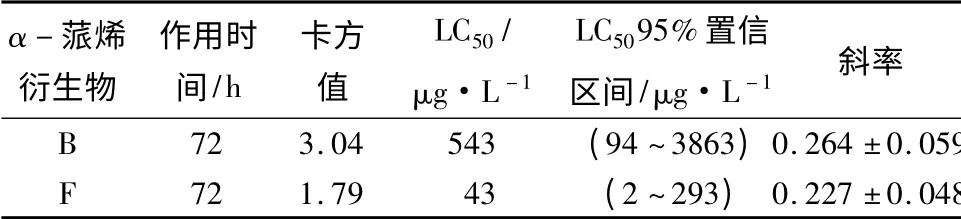
表2 α-蒎烯衍生物B 和F 在72 h 对大麦虫的毒力
由表3可以看出,同一时间条件下化合物B 和F 的毒力回归方程的斜率大于其他处理,进一步说明了这两种化合物对大麦虫幼虫的毒力效果比较理想。随着时间的增加斜率逐渐增大,说明这两种药物对供试昆虫具有持续效应。
通过对比各种药物的毒杀作用(表1)可以看出,化合物B 和F 杀虫效果较好,随处理时间的增加大麦虫的死亡率增大,化合物F 对大麦虫毒力作用较B 强。化合物B 和F 在质量浓度为100 mg·L-1、24、48、72 h时大麦虫的死亡率分别为26.45%、46.76%、70.92%和30.23%、53.47%、86.88%。

表3 α-蒎烯衍生物对大麦虫的毒力回归结果
3 结论与讨论
松节油是我国的天然优势资源,其主要成分是α-蒎烯。α -蒎烯本身及其衍生物具有广泛的生物活性。研究表明[21],α -蒎烯单体具有一定的杀虫效果。本研究以α -蒎烯为原料,对其分子结构进行修饰和重新构建,最终得到7 种目标产物,并且用这7 种目标产物对大麦虫进行室内毒力测定,结果显示化合物B 和F 对大麦虫的毒力效果比较理想,在质量浓度为100 mg·L-1、时间为72 h 时的大麦虫死亡率分别为70.92%和86.88%。这几种化合物的合成路径简便、易于操作,原料价格低廉且容易得到,具有较高的开发潜力。
目前,学者们已经很重视通过改造α -蒎烯分子结构来进行相关研究。马献力等[13]研究发现其衍生物对苹果轮纹病菌、花生褐斑病菌和番茄早疫病菌具有良好的抑制作用,杨益琴等[14]通过修饰α-蒎烯结构得到的衍生物对松材线虫具有很好的毒力作用,但是α -蒎烯的衍生物作为杀虫剂却少见报道,所以要充分利用天然资源的优势,并且对其进行深入的探讨和研究,最终筛选出优质的杀虫剂,开发出α-蒎烯的深加工产品,更好地促进植物园杀虫剂的发展,保护环境健康,而且对促进国家和地方经济的发展具有非常重要的现实意义。
[1] 宋玉双,黄北英.中国林业有害生物防治技术的新进展[J].中国森林病虫,2008,27(6):31 -34,42.
[2] 彭峥国,薛健,吴晓波,等.α-松油醇的提取纯化与稳定性实验[J].医药导报,2011,30(9):1198 -1199.
[3] 陈根强,冯俊涛,张兴.松油烯-4 -醇对粘虫的致毒机制[J].昆虫知识,2006,43(6):785 -788.
[4] Schroeder L M.Attraction of the bark beetle Tomicus piniperda and some other bark and wood living beetles to the host volatiles α-pinene and ethanol[J].Entomologia Experimental et Applicata,1988,46(3):203 -210.
[5] Schroeder L M,Weslien J.Reduced offspring production in bark beetle Tomicus piniperda in pine bolts baited with ethanol and αpinene,which attract antagonistic insects[J].Journal of Chemical Ecology,1994,20(7):1429 -1444.
[6] Czokajlo D,Teale S A.Synergistic effect of ethanol to α-pinene in primary attraction of the larger pine shoot beetle,Tomicus piniperda[J].Journal of Chemical Ecology,1999,25(5):1121 -1130.
[7] 吕建华,林敏刚,屠亚伟.α-蒎烯对杂拟谷盗成虫的控制作用[J].中国粮油学报,2010,25(12):88 -91.
[8] 田雨浓,马伟,韦庆慧,等.α-蒎烯对大麦虫体内解毒酶活性的影响[J].林业科学,2013,49(4):152 -156.
[9] Wang Shengyang,Lai Wanchi,Chu Fanghua,et al.Essential oil from the leaves of cryptomeria japonica acts as a silverfish (Lepismasaccharina)repellent and insecticide[J].Journal of Wood Science,2006,52(6):522 -526.
[10] Sekine T,Sugano M,Majid A,et al.Antifungal effects of volatile Compounds from Black Zira (Bunium persicum)and other spices and herbs[J].Journal of Chemical Ecology,2007,33(11):2123 -2132.
[11] 朱卫国,柳全丰,朱美香,等.松节油合成桃金娘烯醛的研究[J].湘潭大学自然科学学报,1995,17(4):87 -90.
[12] Wender P A,Floreancig P E,Glass T E,et al.Toward the synthesis of taxol and its analo gs:Incorporation of non-aromatic Crings in the pinene pathway[J].Tetrahedron Letters,1995,36(28):4939 -4942.
[13] 马献力,黄建新,段文贵,等.α-萜品烯马来酰亚胺基酰腙衍生物的合成及杀菌活性研究[J].有机化学,2012,32(6):1077 -1083.
[14] 杨益琴,王石发,李艳苹,等.α-旅烯含氮衍生物的合成及其杀松材线虫活性的研究[J].化学学报,2009,67(21):2463 -2474.
[15] 周仕涛.我国植物源农药的研究及前景[J].西南农业学报,2004,17(4):525 -530.
[16] 刘腾飞,王亚权.芳香亲核取代氢反应及4 -氨基二苯胺的合成[J].化学工业与工程,2003,20(5):297 -302.
[17] Yu feili,Padias A B,Hall H K Jr.Evidence for 2-Hexene-1,6-diyl diradicals accompanying the concerted Diels-Alder cycloaddition of acrylonitrile with Nonpolar 1,3-Diene[J].J Org Chem,1993,58:7049 -7058.
[18] 罗常泉,段文贵,岑波,等.合成α-蒎烯-马来酸酐加成物的新工艺研究[J].广西大学学报:自然科学版,2006,31(1):15 -19.
[19] 陆占国,小林直,笠井博子.α-松油烯为原料的单萜衍生物合成及其构造解析[J].化学试剂,2005,27(10):585 -588.
[20] 孙小玲,林林.由α -蒎烯催化氧化制备马鞭草烯酮[J].化学世界,2009(7):414 -417.
[21] 田雨浓.四种萜烯单体对大麦虫生物活性及其作用机理研究[D].哈尔滨:东北林业大学,2013.

