固液平衡模型研究进展
岳金彩,朱南南,刘先红
(1.青岛科技大学计算机与化工研究所,山东 青岛 266042)(2.青岛科技大学化工学院,山东 青岛 266042)
固液平衡是化工热力学研究的重要组成部分,对含固相的多相物系的热力学性质计算、化工分离等均具有重要意义[1-2],为化工产品生产过程的设计、开发和技术改造提供基础数据。
关于流体的相平衡(如汽液平衡、液液平衡)已经得到了较为广泛的研究,且积累了大量的相平衡数据,而对于固液相平衡的研究还很不充分,
许多物系的固液相平衡数据还处于空白状态[3],且固液相平衡的模型研究也很缺乏。
物质固液相平衡模型的建立是一项重要的工作。目前,固液平衡模型大多借鉴汽液平衡的数学模型[4],并在此基础上进行一些改造,其中较为成熟的模型有:经验模型法、活度系数法、状态方程法。其他领域的研究方法和成果也被用来定量研究固液平衡,主要方法有:拓扑法、人工神经网络法、模糊粒子群法等。近几年,国内外对于固液平衡的研究主要集中在三元以及多元物系,从热力学理论出发,根据固液平衡自身的特点推导出模型,然后利用实验数据来验证模型的准确程度[5-9]。笔者综述了固液平衡中常用的数学模型及其优缺点,并展望了未来固液平衡模型的发展。
1 经验模型法
经验模型法是通过对溶解度数据的分析处理,找出其内在规律并关联数学模型。经验模型法将温度作为影响溶解度的重要因素进行研究,适用于内插数据点,无外推功能,但却具有适应性强、应用范围广的优点,在先期研究中起着重要的作用。随着热力学的发展,这种方法应用较少。
1.1 理想溶液模型
对于固液平衡体系,依据热力学原理有以下普适的溶解度方程[10]。

(1)
忽略影响较小的压力项和热容差项,用熔点温度代替三相点温度,并假设溶液为理想溶液,即γ=1,可得到如下简化方程:
(2)
周彩荣等[11]采用该模型关联了新戊二醇在8种有机溶剂中的溶解度,总平均相对误差为3.94%,关联结果较好。洛健美等[12]测定了纳他霉素在三种溶剂的溶解度,并分别回归得到了参数A、B,计算值与实验结果吻合较好,平均相对误差小于5%。孙鹏等[13]测定了阿维菌素在不同比例的有机溶剂-水体系中的溶解度,并采用该模型对数据进行了关联,相关系数都在98%以上,说明该模型对三元物系同样适用。
Prausnitz等[14]曾指出,在远离临界区域的有限温度范围内,真实溶液中组分的活度系数对于温度的依赖是微弱的,因此该模型不适用于温度范围变化较大的体系。
1.2 Apelblat模型
Apelblat等[15]在常压下,忽略了溶质活度系数的影响,假设溶液摩尔焓变随温度作线性变化,从Clausius-Clapeyron方程推得溶解度随温度关系为:
(3)
李华等[16]测定了庚二酸在水中的溶解度,采用Apelblat模型对数据进行拟合,实验值与计算值符合良好。Zhang等[17]采用Apelblat模型关联了诺氟沙星在乙醇、丙醇、丙酮和三氯甲烷中的溶解度,平均相对误差均小于1%。
Apelblat三参数半经验方程对溶解度数据进行关联,适用于内插性,但不具备外推功能。同时,由于该模型较简单,模型参数数目也较少,如果采用该模型对溶解度数值变化范围较大的体系进行关联和预测,结果偏差会增大。陈蔚[18]采用Apelblat模型关联了胆固醇和24-去氢胆固醇在21种单一溶剂中的溶解度,发现在溶解度随温度变化较大的体系中关联结果偏差较大。
1.3 λh方程
1980年,Buchowski等[19]研究了苯酚和安息香酸在非极性溶剂中的溶解行为,找出了活度、溶解度和温度的关系,并导出了二元体系中的溶解度模型λh方程。
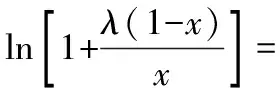
(4)
λh方程不属于严格的活度系数方程,笔者将其归为经验模型。Mao等[20]分别用λh方程、Apelblat模型和UNIFAC模型关联了己二酸在5种溶剂中的溶解度,结果表明λh方程优于其他2种模型。鲍颖等[21]测定了盐酸大观霉素在纯水及不同丙酮-水比例混合溶剂中的溶解度,结果表明,λh方程的关联效果好于R-K方程,鲍颖等将λ、h表达为丙酮浓度的函数,用于内插计算,结果可满足工程需要。
λh方程中只有2个参数,形式简单,在处理多元物系时,仍保持2个参数,将混合溶剂当作虚拟一元溶剂处理,也能得到较好的结果,但给利用纯溶剂的溶解度数据来预测多元物系的溶解度行为带来了困难。
1.4 经验方程
在溶质、溶剂和压力等因素确定时,溶解度主要由温度决定。假设溶解度是随温度连续变化的,则三项式模型可写成以下形式:
x=A+BT+CT2
(5)
徐衡等[3]采用经验方程很好地关联了顺丁烯二酸酐在脂类溶剂中的溶解度数据,严国兵等[22]测定了水飞蓟素在水中的溶解度,实验数据用经验方程进行了关联,相对误差均小于1%。
2 活度系数法
活度系数模型大致可分为两大类,一类是以Van Laar、Margules方程为代表的经典模型,多数是建立在正规溶液理论之上,它们对于较简单的系统能获得较理想的结果;另一类是在20世纪60年代以后从局部组成概念发展起来的活度系数模型,其典型的代表有Wilson、NRTL、UNIQUAC等方程[23]。实验表明,后一类模型更为优秀,能从较少的特征参数关联或推算混合物的相平衡。笔者主要对后一类模型作了综述。
2.1 Wilson方程
1964年,Wilson提出了以局部组成为基础的活度系数方程——Wilson方程[24]:
(6)
其中,Λij为模型参数,可表示为:
(7)
Shi等[25]采用 Wilson方程关联了2-氯-5-氯甲基吡啶在水以及5种有机溶剂中的溶解度,结果表明Wilson方程能够准确的描述上述物系的固液平衡,平均相对误差小于3.65%。Wei等[26]测定了水杨酸苯酯在C4醇中的溶解度,并分别用Wilson方程、NRTL方程、UNIQUAC方程进行了关联,结果发现Wilson方程的关联结果优与其他两方程。谢宏昭等[27]用Wilson方程关联了枞酸在四种醇类溶剂中的溶解度数据,平均相对误差为1.19%。
Wilson方程具有如下几个突出的优点[28]:
1)对二元溶液它是一个两参数方程,故只要有一组数据即可推算,并且计算精度较高。对含烃、醇、醚、酮、腈、酯以及含水、硫、卤素的互溶体系均能获得较好的结果。
2)二元交互作用能量参数λij-λii受温度影响较小,在不太宽的温度范围内可视为常数。而Wilson参数Λij是随温度变化而变化,因此该方程能反映温度对活度系数的影响,具有半理论的物理意义。
3)仅有二元体系数据可以预测多元体系的行为,无需多元参数。
然而,Wilson方程的应用也有它的局限性:
1)不能用于液相分层的系统;
2)不能反映出活度系数具有最高值或最低值的溶液特征。
2.2 NRTL方程
1968 年 Renon和 Prausnitz在Wilson的局部组成概念和Scott的双流体模型基础上提出了NRTL方程[29]:
(8)
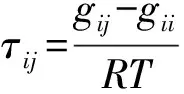
Domanska等[30]测定了一些长链烷烃与含支链的醚组成的几个不同体系中的固液平衡,并使用多种关联方程对数据进行关联,结果表明:NRTL方程最适用于实验物系的关联。Tam等[31]对间氯扁桃酸的溶解度和选择性结晶过程进行了研究,成功地利用NRTL模型和间氯扁桃酸在水中的溶解度数据预测了间氯扁桃酸在甲苯-乙酸乙酯中的溶解度,并与实验数据作了比较,结果吻合良好。宋微微等[32]分别用λh方程和NRTL方程关联了丁二酸在5种有机溶剂中的相平衡数据,结果表明NRTL方程能够很好地关联实验数据。
2.3 E-NRTL方程
Chen等人[33]于1982年基于局部组成概念,结合同性离子相斥和中心溶剂分子周围呈电中性的假设得到了E-NRTL方程。该方程包括两个贡献项:一个为中心离子周围的离子-离子长程静电作用贡献;另一个为任意中心离子周围的短程相互作用项。1986年Chen等[34]在保持模型不变的基础上,增加了一个新Born项,Born项与离子从纯水向混合溶剂迁移时Gibbs自由能的变化有关,此时电解质E-NRTL模型的表达式为:
(9)
从而得到相应的活度系数表达式:
(10)
Chen等针对不同的体系,对E-NRTL方程进行了多次修正[35-37],使方程的应用范围变得更广。在非水溶剂[38]或者溶质溶解度较大时[39],Born项可以忽略。陈素宁[39]采用忽略Born项的E-NRTL 方程对NTS酸-硫酸-水物系的溶解度数据进行回归,回归实验数据的均方差为1.72,说明 E-NRTL方程适合描述NTS酸-硫酸-水物系的固液平衡。吴俊等[40]建立了亚氨基二乙酸-氯化钠-水三元体系溶解度模型,忽略了短程作用项,用含NRTL项的E-NRTL方程对实验数据进行了关联,平均相对误差为2.93%,关联效果较好。
E-NRTL方程适用范围广,精确度高,并且克服了Wilson方程的局限性,可应用于部分互溶、不互溶的体系。相比于其他热力学模型,E-NRTL模型不需要更高次项的参数。然而,由于每个能量参数均含有其他3个参数,回归这些参数需要较大的工作量,而且参数有时不能稳定的从常温向更宽的温度范围扩展。当存在电离平衡时,不同温度下模型参数的关联比较复杂[41]。
2.4 UNIQUAC模型
Abrams和Prausnitz于1975年基于双液膜和局部组成的概念提出了UNIQUAC模型[42],该模型将超额Gibbs自由能分成组合部分和剩余部分,同时将平均面积和局部面积分数关联起来,其模型基本形式为:
(11)
UNIQUAC是UNIFAC方程的基础,形式比较复杂,经过一些学者的修正后[43-44],提高了其计算精度。Mirmehrabi等[45]测定了司他夫定在单一溶剂和混合溶剂中的溶解度数据,分别用NRTL模型和UNIQUAC模型进行了拟合,然后进行内插计算,结果表明,无论在单一溶剂还是混合溶剂中,UNIQUAC模型内插精度均高于NRTL模型。
UNIQUAC模型仅用两个可调整参数(NRTL模型则需3个),且二元参数值随温度的变化较小,在不太大的温度范围内可以适用;由于其主要浓度变量是表面积分数而非摩尔分数,因此,该方程对分子大小悬殊的体系有较好的效果[28]。但由于方程复杂计算量较大,因此需要一些微观参数。
2.5 UNIFAC模型
Fredenslund等[46]吸取了UNIQUAC模型和ASOG模型的优点,并把两者结合起来提出了预测性模型——UNIFAC模型。物质的活度系数仍由组合项活度系数和剩余活度系数组成,其方程如下:
(12)
式中,γiR为剩余部分的活度系数,取决于基团之间的相互作用;γiC是组合部分的活度系数,取决于溶液中各种基团的形状与大小。
UNIFAC模型提出后,为提高预测精度和扩大其使用范围,大量学者对模型提出了修改,主要是对组合项活度系数在总活度系数中的份额做了调整[47-48]。Gmehling等[49]用UNIFAC方程预测了固体非电解质在多种溶剂中的溶解度,结果表明UNIFAC方程对大部分的物系预测精度较高。Carmen等[50]使用UNIFAC模型和修正的UNIFAC模型分别计算了敌草隆和灭草隆在有机非电解质中的溶解度,并与实验值做了对比,结果吻合良好。赵宇[51]通过乌洛托品二元体系实验数据回归得到c-CH2基团新的交互作用参数,并由此计算出乌洛托品在二元三元体系的溶解度,其预测结果的平均相对误差分别为1.62%和2.16%,其精度可以满足工业应用。
相对于以上活度系数模型,UNIFAC及其修正模型应用范围更广,能较好地适用于中低温度下的非极性体系,对部分极性体系、含卤代烃和同分异构体体系,预测值与实验值基本吻合[52],但对于极性太强和高温条件下的体系,预测结果不理想[53],此外,对含有同分异构体的体系预测结果区分不明显,因此需要对模型作进一步改进,例如引入新的基团、修正参数等。
3 状态方程(EOS)法
EOS法研究固液相平衡,实质是用逸度或逸度系数描述固体的溶解度,从而避开了计算溶质的活度系数。常用的状态方程是立方型状态方程,例如RK、SRK、LK、PR、PT等,计算的准确性依赖于混合规则及相互作用参数[54]。
由于EOS法的局限性和溶剂组成的复杂性,使用EOS法描述固液相平衡时多在该法的基础上做一些修正[55-56]。Costa等[57]用修正的SRK方程模拟了聚乙烯和聚丙烯在20种有机溶剂中的溶解行为,并与文献值作了对比,结果吻合良好,但发现SRK方程在高压条件下计算误差较大。
使用EOS法研究固液平衡要求所选用的方程对液相和固相都有较好的精度。由于对固相区、固液共存区的物性了解较少,并且随着物质密度的增大,分子间的相互作用更为复杂,使得EOS法研究固液平衡受到了限制,关键是解决状态方程适用于固相的问题。
4 人工神经网络法
人工神经网络是由大量节点组成的非线性大规模自学习系统,可以模仿人脑神经系统的信息处理。韩金玉等[58]采用前馈型神经网络模型和回归方程预测了紫杉醇在4种溶剂中的溶解度,指出在实验温度范围内,两种模型均能给出满意的结果,人工神经网络更为简便,可用于内插,但难于外推。骆健美等[11]采用三层前传BP网络1-3-1模型对纳他霉素在纯水和甲醇中的溶解度数据进行关联,内插和外推效果令人满意。
采用人工神经网络预测固液相平衡时,需要使用大量的实验数据对网络进行训练,训练后的网络就可以用于预测结果,并且对不同的溶剂系统,可以采用同一个网络模型,很大程度上减少了工作量,但在难以获得大量数据时,这种方法并不可靠。
5 拓扑法
用拓扑理论研究固液相平衡,就是通过研究溶剂和溶质的溶解性与化学结构的定量关系,用分子的拓扑指数表示分子的形状、结构和尺寸,经过多元参数回归分析,建立可用来评价分子物理或化学参数对溶解性影响的一般等式[59]。
Krzysztof等[60]用拓扑理论对萘在19种溶剂中的固液平衡进行了研究,得出具有统计意义的高准确性的三参数等式。金克新等[61-62]在拓扑法研究固液相平衡方面做了较多的工作,他们将拓扑指标与溶液的超额Gibbs自由能进行了关联,得到了硝基氯苯几种同分异构体在不同溶剂和混合溶剂中的溶解度。
6 结束语
对于汽液平衡和液液平衡来说,已经形成了系统、完整的关联方法,固液平衡模型大多数都是由汽液、液液平衡模型发展得到的,由于固相的特殊性质,使得模型的应用受到很多限制。
由于固液平衡模型的重要作用,一直以来有很多学者进行了模型的研究,积累了大量的实验数据和模型参数,但还很不充分。固液平衡模型主要采用活度系数方程,但回归方程参数需要的工作量较大,各个模型的使用范围也有限制,因此,发展可应用于宽范围体系的固液平衡模型是今后研究工作的关键。这项工作已经起步并获得了一定的进展。另外,其他领域的研究方法和成果也值得借鉴。
符号说明
A,B,C,λ,h——经验模型方程参数
ΔCp——热容差,J·mol-1·K-1
gex——总的过量Gibbs自由能
gex,lc——由粒子短程作用贡献的Gibbs自由能
gex,pdh——由长程静电作用贡献的Gibbs自由能
Gij——NRTL方程模型参数
gij-gii——NRTL方程能量参数
ΔHtp——溶质在三相点熔化焓,J·mol-1
P——压力,Pa
Ptp——三相点压力,Pa
R——气体常数,J·mol-1·K-1
T——热力学温度,K
Tm——溶质组分的熔点,K
Ttp——溶质三相点温度,K
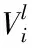
ΔV——溶质比容差,m3·mol-1
x——溶质摩尔分数
αij——NRTL方程非无规参数
γ——组分活度系数
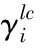
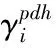
Λij——Wilson方程模型参数
λij-λii——Wilson方程能量参数
τij——NRTL方程模型参数
i——组分i
j——组分j
l——液体
参 考 文 献
[1] Yalkowsky S H, Banerjee S. Aqueous solubility, methods of estimation for organic compounds[M]. New York: Marcel Dekker, 1992: 1-10.
[2] 陈志新,侯虞均.含固体物系相平衡研究的现状和进展[J].化工进展,1993,5:21-24.
[3] 马沛生,董奕,许文.顺丁烯二酸酐在直链二酸二乙酯类溶剂中固液平衡研究[J].化学工程,2000,28(4):48-50.
[4] Prausnitz J M.液体相平衡分子热力学[M].第3版.北京:化学工业出版社,1990:460-475.
[5] Anders Jaretun, Gharib Aly. New local composition model for electrolyte solutions:multicomponent systems[J]. Fluid Phase Equilib, 2000, 175: 213-228.
[6] Costa G M N, Kislansky M, Oliveira L C, et al. Modeling of solid-liquid equilibria for polyethylene and polypropylene solutions with equations of state[J]. Journal of Applied Polymer Science, 2011, 121(3): 1832-1849.
[7] Marcelo P A R, Geisa A L, Raquel L C G, et al. Solid-liquid equilibrium of substrates and products of the enzymatic synthesis of ampicillin[J]. AIChE Journal, 2010, 56(6): 1578-1583.
[8] Wang D G, Li Z B. Modeling solid-liquid equilibrium of NH4Cl-MgCl2-H2O system and its application to recovery of NH4Cl in MgO production[J]. AIChE Journal, 2011, 57(6): 1595-1606.
[9] Thenmozhi M, Karunanithi T. Modeling of polycyclic aromatic hydrocarbon SLE in aromatic solvents[J]. Asia-Pacific Journal of Chemical Engineering, 2010, 5(3): 517-526.
[10] Walas S M.化工相平衡[M].韩世钧等译.北京:中国石化出版社,1991:444-460.
[11] 周彩荣,石晓华,冯伟,等.新戊二醇在溶剂中溶解度的测定及关联[J].高校化学工程学报,2010,24(3):365-369.
[12] 骆健美,金志华,岑沛霖,等.纳他霉素在不同溶剂中溶解度的测定与关联[J].高校化学工程学报,2010,22(5): 373-377.
[13] 孙鹏,刘俊果,杨玉淮,等.阿维菌素在不同醇-水溶剂体系中溶解度的测定与关联[J].高校化学工程学报,2010,24(5):375-378.
[14] Prausnitz J M, Lichtenthaler R N, Azevedo E G. Molecular thermodynamics of fluid-phase equilibria, Second Edition Englewood Cliffs[M]. Prentice-Hall Inc, 1986: 230-266.
[15] Apelblat A, Manzurola E. Solubilities ofO-acetylsalicylic,3,5-dinit rosalicylic andp-toluicacid and magnesium-DL-aspartate in water fromT=(278 to 348) K[J]. J Chem Thermodyn, 1999, 31(1): 85-91.
[16] Li H, Zhu J, Hu G. Measurement and correlation for solubility of pimelic acid in water[C]. Proceedings of the 5th Joint China-Japan Chemical Engineering Symposium, Xi’an Shanxi, 2009.
[17] Zhang C L, Li B Y, Wang Y. Solubilities of norfloxacin in ethanol, 1-propanol, acetone and chloroform from 294.15 to 318.15 K[J]. The Canadian Journal of Chemical Eegineering, 2010,88(1):63-66.
[18] 陈蔚.胆固醇和24-去氢胆固醇的溶解度[D].浙江:浙江大学,2010:15-65.
[19] Buchowski H, Ksiazcak A. Solvent activity along a saturation line and solubility of hydrogen bounding solids[J]. J Phys Chem, 1980, 84: 975-979.
[20] Mao Zhibo, Sun Xiaobo, Luan Xianghai,et al. Measurement and correlation of solubilities of adipic acid in different solvents[J]. Chinese Journal of Chemical Engineering, 2009, 17(3): 473-477.
[21] 鲍颖,王静康,王永莉,等.盐酸大观霉素在纯水及丙酮-水混合溶剂中的溶解度测定与关联[J].高校化学工程学报,2003,17(4):457-460.
[22] 严国兵,白同春.水飞蓟素在水中溶解度的测定及关联[J].苏州大学学报:自然科学版,2004,20(2):79-83.
[23] 陈新志,蔡振云,胡望明,等.化工热力学[M].北京:化学工业出版社,2009:85.
[24] Wilson G M. Vapor-liquid equilibrium Ⅺ. A new expression for the excess free energy of mixing[J]. J Am Chem Soc, 1964, 86: 127-130.
[25] Shi Xiaohua, Li Ming, Zhou Cairong. Measurement and correlation for solubility of 2-Chloro-5-chloromethylpyridine in different solvents[J]. Chinese Journal of Chemical Engineering, 2010, 18(4): 654-658.
[26] Wei D W, Pei Y H, Zhang C. Measurement and correlation of solid-liquid equilibria of phenyl salicylate with C4Alcohols[J]. Chinese Journal of Chemical Engineering, 2009, 17(1): 140-144.
[27] 谢宏昭,周龙昌,陈小鹏,等.枞酸在四种醇类溶剂中的溶解度测定与关联[J].高校化学工程学报,2011,25(3): 385-389.
[28] 陈钟秀,顾飞燕,胡望明.化工热力学[M].北京:化学工业出版社,2009:95-96.
[29] Renon H, Prausnitz J M. Estimation of parameters for NRTL equation for excess Gibbs energy of strongly nonideal liquid mixtures[J]. Ind Eng Chem Proc Des Dev, 1969, 8: 413-419.
[30] Domanska U, Lachwa J, Morawski P. Phase equilibrium and volumetric prosperities in binary mixtures containing branched chain ethers[J]. J Chem Eng Data, 1999, 44(5): 947-984.
[31] Tam Le Minh, Heike Lorenz, Morgenstern A S. Enantioselective crystallization exploiting the shift of eutectic compositions in solid-liquid phase diagrams [J]. Chem Eng Technol, 2012, 35(6): 1003-1008.
[32] 宋微微,马沛生,相政乐.丁二酸在五种有机溶剂中溶解度测定及关联[J].高校化学工程学报,2007,21(2):341-344.
[33] Chen C C, Britt H I, Boston J F. Local composition model for excess Gibbs energy of Electrolyte Systems[J]. AIChE Journal, 1982, 28(4): 588-596.
[34] Mock B, Evans B, Chen C C. Thermodynamic representation of phase equilibria of mixed-solvent electrolyte system[J]. AIChE Journal, 1986, 32(10): 165-1664.
[35] Chen C C, Bokis C P, Mathias P. Segment-based excess Gibbs energy model for aqueous organic electrolytes[J]. AIChE Journal, 2001, 47(11): 2593-2600.
[36] Bollas G M, Chen C C, Barton P I. Refined electrolyte-NRTL model: activity soefficient expressions for application to multi-electrolyte systems[J]. AIChE Journal, 2008, 54(6): 1608-1620.
[37] Chen C C, Song Yuhua. Generalized electrolyte-NRTL model for mixed-solvent electrolyte Systems[J]. AIChE Journal, 2004, 50(8): 1928-1938.
[38] Chen C C, Zhu Yizu, Evans L B. Phase partitoning of biomolecules: solubilities of amino acids[J]. AIChE Journal, 1989, 5(3): 113-115.
[39] 陈素宁.癸二酸、壬二酸和NTS酸生产中固液平衡的测定与研究[D].浙江:浙江大学,2009:21-38.
[40] 吴俊,杨运泉,罗和安,等.亚氨基二乙酸-氯化钠-水三元体系溶解度模型[J].化学工程,2006,34(1):44-47.
[41] 夏云龙,项曙光.电解质NRTL模型的发展及应用[J].河北化工,2004(1):9-11.
[42] Abrams D S, Prausnitz J M. Statistical thermodynamocsof liquid mixtures: a new expression of the excess Gibbs energy of partly of completely miscible systems[J]. AICHE Journal, 1975, 21: 116-128.
[43] Ajay G, Domanska U, Frank R. Solid-liquid phase equilibria of ternary mixtures containing polynuclear arom atic compounds[J]. Chem Eng Data, 1994, 39: 175-178.
[44] Smith R L J, Acosta G M, Arai K. Prediction and correlation of triglyceride-solvent solid-liquid equilibria with activity coefficient models[J]. Fluid Phase Equilibria, 1998, 145: 53-68.
[45] Mirmehrabi M, Rohani S, Perry L. Thermodynamic modeling of activity coefficient and prediction of solubility: Part 2. semipredictive or semiempirical models[J]. Journal of Pharmaceutical Sciences, 2006, 95(4): 798-808.
[46] Fredenslund A, Jones R L, Prausnitz J M. Gronp-contribution estimation of activity coefficients in nonideal liquid mixtures[J]. AIChE Journal, 1975, 21(6): 1086-1099.
[47] Larsen B L, Rasmussen P, Fredenslund A. A Modified UNIFAC group-contribution model for prediction of phase equilibria and heats of mixing[J]. Ind Eng Chem Res, 1987, 26: 2274-2286.
[48] Gmehling J, Li J D, Schiller M. A Modified UNIFAC model to present parameter matrix and results for different thermodynamicproperties[J]. Ind Eng Chem Res, 1993, 32(1): 178-193.
[49] Lohmann J, Ropke T, Gmehling J. Solid-liquid equlibria of several binary systems with organic compounds[J]. J Chem Eng Data, 1998, 43: 856-860.
[50] Carmen R, Henrik K, Hansen, William A. Calculation of solubilities of the pesticides diuron and monuron in organic nonelectrolyte solvents using UNIFAC and modified UNIFAC (dortmund) models[J]. Canadian Journal of Chemcal Engineering, 2010,3: 530-535.
[51] 赵宇.几种有机物系固液相平衡的研究[D].北京:北京化工大学,2012:23-61.
[52] 李秀丽.UNIFAC及其修正模型的评价研究[D].青岛:青岛科技大学,2009:3-25.
[53] Thenmozhi M, Karunanithi T. Modeling of polycyclic aromatic hydrocarbon SLE in aromatic solvents[J]. Asia-Pacific Journal of Chemical Engineering, 2010, 5: 517-526.
[54] 高玉国.反式-1,2-环己二醇三元体系固液相平衡研究[D].郑州:郑州大学,2006:6-9.
[55] Oliveira M B, Pratas M J, Marrucho I M, et al. Description of the mutual solubilities of fatty acids and water with the CPA EoS[J]. AIChE Journal, 2009, 55(6): 1604-1611.
[56] Tsivintzelis I, Economou I G, Kontogeorgis G M. Modeling the solid-liquid equilibrium in pharmaceutical-solvent mixtures: Systems with complex hydrogen bonding behavior[J]. AIChE Journal, 2009, 55(3): 756-768.
[57] Costa G M N, Kislansky S, Oliveira L C. Modeling of solid-liquid equilibria for polyethylene and polypropylene solutions with equations of state[J]. Journal of Applied Polymer Science, 2011, 121: 1832-1849.
[58] 韩金玉,肖剑,王华,等.紫杉醇溶解度的测定与关联[J].化工学报,2001,52:64-67.
[59] 朱政.熔融结晶法提纯β-甲基萘研究[D].天津:天津大学,2007:14.
[60] Krzysztof O, Ryszard D. Solubility-structure relationship in naphthalene organic solvent binary system[J]. Journal of solution chemistry, 1991, 20(2): 241-248.
[61] 谈遒,金克新,谢朝钢.固液平衡研究-利用拓扑法指标关联活度系数[J].化学工业与工程,1989,6(2):3-15.
[62] 金克新,陈勇强,谢朝钢.硝基氯苯体系固液平衡研究[J].化学工业与工程,1993,10(2):1-8.

