动物抗凝血酶Ⅲ和褐藻糖胶结合的结构模拟
黄德满,尹哲进,文成规,尹学峰,王泽港
(1.金日成综合大学生命科学学院,平壤 99903;2.扬州大学生物科学与技术学院,江苏 扬州 225009)
褐藻糖胶(fucoidan,FUC)是一类主要由岩藻糖及硫酸酯基团组成的多糖类物质,广泛存在于褐藻及一些海洋无脊椎动物(如海参,海胆等)体内[1]。 含有丰富的免疫调节成分,具有类似于肝素的多糖结构,有较好的抗凝血活性,虽然其活性低于肝素,但由于肝素的副作用较大,因而仍具有较好的应用前景。
过去几十年间FUC得到了较为广泛、系统的研究,己证实其具有多种生理活性,包括抗凝血与抗血栓、抗病毒、抗肿瘤、免疫调节、抗炎、降血脂、抗氧化、抗补体特性、抗炎,还具有尿道、肾病、胃保护作用等[2-6]。但基于其结构信息的构效关系研究却相对较少。
随着生物信息学和结构生物学的发展,越来越多的受体生物大分子的三维结构被测定,可以用基于结构的药物设计方法设计新的先导化合物[7-9]。
本试验应用生物信息学的方法,研究分析了动物抗凝血酶Ⅲ和褐藻糖胶的结构变化特征。
1 材料与方法
1.1 数据库和软件
数据库:PIR(蛋白质功能预测数据库,http://pir.georgetown.edu/),PDB(蛋白质数据库,http://www.rcsb.org/pdb/)、CHARMM(Chemistry at HARvard Macromolecular Mechanics)的 PAR22(http://www.charmm.org/)。
软件:多序列比对软件 ClustalW (http://www.ebi.ac.uk/Tools/msa/clustalW),分子模拟软件ChemOffice Ultra7.0,HyperChem 7.03,VMD1.82,生物大分子分子动力学并行计算软件 Hyangsan[10]。
1.2 抗凝血酶Ⅲ和褐藻糖胶的结构仿真系统的构建
利用HyperChem7.03,以抗凝血酶Ⅲ分子(从蛋白质结构数据库PDB中获得编号为1ANT的蛋白结构)为模型,模拟褐藻糖胶的结构模型。为了提供与生物体内相似的水环境,用VMD1.82中的TIP3模型,生成水分子。
2 结果与分析
2.1 搜索抗凝血酶Ⅲ的肝素结合位点
褐藻糖胶与肝素在化学结构和功能上具有相似的特征,二者具有相同的抗凝血酶Ⅲ结合位点。在蛋白质序列数据库(PIR)中,以抗凝血酶Ⅲ的蛋白序列为搜索序列,用 “BLAST”程序进行数据库搜索,获得相似性较高的抗凝血酶Ⅲ的蛋白质序列,用于进一步分析抗凝血酶Ⅲ的肝素结合位点。
用大分子结构搜索程序Vast, 以抗凝血酶Ⅲ 1ANT(PDB序列号)为标准序列来搜索结构数据库PDB的同源序列,获得高度同源序列1TB61、1ANTI、1ATH2、1ANTL、2ANTI、I59611、1ATTA、P41361、1ATT2、Q7M364。应用多序列比对软件CLUSTALW对这些同源蛋白质序列进行多重序列比对。多序列比对结果显示,Arg13、Asn45、Arg46、Arg47、Glu113、Lys114、Lys125和Arg129是高度保守的肝素结合位点。
2.2 抗凝血酶Ⅲ与褐藻糖胶结合后抗凝血酶Ⅲ的结构变化
观察模拟过程中抗凝血酶Ⅲ—褐藻糖胶结构的变化,其结构变化时间持续了3.5 ns(图1)。如图1所示,2.2 ns后振动状态变成相对稳定的状态,而在抗凝血酶Ⅲ(不结合褐藻糖胶)的分子动力学模拟实验中,120 ps后观察到稳定状态,所用的时间是结合褐藻糖胶时所用时间的百分之二。比较抗凝血酶Ⅲ与抗凝血酶Ⅲ—褐藻糖胶复合物的结构,发现反应中心环(RCL)的变化最明显(图2)。
这表明抗凝血酶Ⅲ和褐藻糖胶相结合后,抗凝血酶Ⅲ的结构发生了明显的改变,即外源分子的结合会改变抗凝血酶Ⅲ的三维构象。具体表现为结合后RCL更加外露,易于与其它反应分子结合,从而增强抗凝血酶Ⅲ的反应活性。
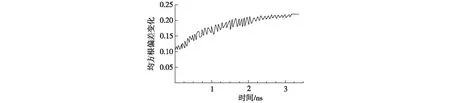
图1 抗凝血酶Ⅲ与褐藻糖胶结合后抗凝血酶Ⅲ的均方根偏差(RMSD)的变化Fig.1 The RMSD change of antithromin Ⅲ combined with fucoidan

注:A代表抗凝血酶Ⅲ和褐藻糖胶结合初期状态;B代表抗凝血酶Ⅲ和褐藻糖胶结合平衡状态图2 抗凝血酶Ⅲ和褐藻糖胶结合时RCL的结构变化Fig.2 The RCL change of antithrombin Ⅲ combined with fucoidan
2.3 抗凝血酶Ⅲ和褐藻糖胶结合位点残基的变化
褐藻糖胶和抗凝血酶Ⅲ结合的时候,Lys28、Lys29、Ala43、Thr44,Ala383和Arg393的均方根偏差(RMSD)在0.150 nm以上(表1)。

表1 褐藻糖胶和抗凝血酶Ⅲ结合时均方根偏差最高的残基均方根偏差(RMSD)Table 1 The residues having great RMSD when fucoidan is bound to antithrombin Ⅲ
抗凝血酶Ⅲ中的Lys28、Lys29、Ala43、Thr44在褐藻糖胶的结合位点周围,并且Lys28、Lys29、Ala43和Thr44周围的褐藻糖胶的结合位点具有较高的RMSD值。Ala383和Arg393分别是抗凝血酶Ⅲ和凝血酶的结合位点,也就是形成RCL的残基。这些残基结合活性的增强是抗凝血酶Ⅲ与配体之间结合后产生的结果。
褐藻糖胶结合位点的8个残基中有4个残基(Arg13、 Arg46、Arg47、Glu113)的RMSD较平均RMSD(0.049 nm)高,而另外4个残基比平均RMSD的值低(表2)。

表2 抗凝血酶Ⅲ的肝素结合位点残基的均方根偏差(RMSD)Table 2 RMSD of the residues at the binding site of antithrombin Ⅲ to heparin

注:A代表抗凝血酶; B代表抗凝血酶Ⅲ和褐藻糖胶结合;C代表抗凝血酶Ⅲ和肝素结合图3 抗凝血酶Ⅲ和褐藻糖胶结合时Arg393的位置变化Fig.3 The various states of Arg393 in some sorts of antithrombin Ⅲ combined with fucoidan
这表明,抗凝血酶Ⅲ中的褐藻糖胶的结合位点是相对固定的。但是当褐藻糖胶和抗凝血酶Ⅲ结合,引起靠近褐藻糖胶的残基的均方根偏差(RMSD)增高,并导致Lys28与Thr44之间的部分出现了较大的变化。无论褐藻糖胶结合与否,凝血酶Ⅲ内RCL部分,Ala383和Arg393的RMSD比较高,与其它部分相比具有较高的结合活性。另一方面,褐藻糖胶和抗凝血酶Ⅲ复合物的所有原子的平均RMSD是0.208 nm,其中RCL中的Cα原子的平均RMSD是0.074 nm,这表明除Cα外其它原子的空间位置变化都很大。模拟结果表明,抗凝血酶Ⅲ和褐藻糖胶结合时Arg393从抗凝血酶Ⅲ的内部激发到了复合物结构的表面(图3)。当被褐藻糖胶激活的抗凝血酶Ⅲ和凝血酶结合时,抗凝血酶Ⅲ的Arg393与凝血酶的活性中心残基Asp、His、Ser结合,并进入到四面体的过渡状态。
抗凝血酶Ⅲ和凝血酶的复合物与抗凝血酶Ⅲ和褐藻糖胶的复合物进行比较,Cα原子的平均RMSD值是0.024 nm,RCL的RMSD 平均值是0.017 nm,二者比较接近。这表明,褐藻糖胶和抗凝血酶Ⅲ复合物的结构是有利于结合凝血酶的结构。
3 结 语
计算机辅助药物设计方法,在新药先导化合物的发现和优化中起重要的作用。理论计算和计算机辅助药物设计方法可以研究生物大分子上药物结合部位的结构与性质,配体与受体复合物的构型与立体化学特征,结合模式和选择性等等,可为改进现有的生物活性物质的结构,设计新的化合物,提供理论上的指导和思路[11-12]。
褐藻糖胶和抗凝血酶Ⅲ结合的时候,反应中心环(RCL)的变化最明显,褐藻糖胶和抗凝血酶Ⅲ的结合使抗凝血酶Ⅲ从非活性状态变为了活性状态,从而更容易与凝血酶结合。
本试验通过生物信息学方法,分析了褐藻糖胶与抗凝血酶Ⅲ的作用机制,研究结果为开发新药提供了有重要参考价值的理论依据。
[1] Bilan M I,Usov A I.Structural Analysis of Fucoidans[J].Natural Product Communications,2008(10):1639-1648
[2] 王君,胡霞敏.海藻提取物Fucoidan抗肿瘤作用的实验研究[J].时珍国医国药,2009,20(7):1757-1758
[3] 朱良,张杰平.繁枝蜈蚣藻多糖对小鼠抗疲劳和耐缺氧作用研究[J].食品研究与开发,2009,10:41-43
[4] 宋云端,秦维超,吕涛,等.半叶马尾藻多糖对辐射损伤小鼠免疫功能的保护作用[J].时珍国医国药,2009,20(8):1956-1958
[5] 盛玉青,尹鸿萍,李海涛.螺旋藻多糖硫酸酷化修饰前后抗肿瘤及免疫活性的研究[J].药物生物技术,2006,13(2):4-6
[6] Koyanagi S,Tangnigawa N,Nakagawa H,et al.Oversulfation of Fucoidan Enhances its Anti-angiogenic and Antitumor Activities[J].Biochemical Pharmacology,2003,65(2):173-179
[7] Digabriele A D,Chen D I.Structure of a Heparin-linked Biologically Active Dimer of Fibroblast Growth Factor[J].Nature,1998,393(16):812-817
[8] S Faham,R E Hileman,J R Fromm,et al.Crystallographic Analyses of Heparin Oligosaccharides Binding to Basic Fibroblast Growth Factor[J].Science,1996,271:1116-1120
[9] 文志红,邬素华,陈维涛.医用肝素化抗凝血高分子材料的研究进展[J].塑料,2005,34(2):26-30
[10] Dok man Hwang,Chol man Han.The Development of Molecular Dynamics Paratactic Calculation Software,Hyangsan[J].Journal of Kim Il Sung University:Natural science,2006,52(3):106-111
[11] 高宁国,程秀兰,杨敬,等.肝素结构与功能的研究进展[J].生物工程进展,1999,19(5):4-13
[12] Li W,Johnson D J D,Esmon C T,et al.Structure of the Antithrombin-thrombin-heparin Ternary Complex Reveals the Antithrombotic Mechanism of Heparin[J].Nature Structural & Molecular Biology,2004(11):857-862

