基于金纳米通道分离检测百草枯与阿特拉津
谢 利, 史汶灵, 柳 悦, 黄杉生
(上海师范大学 生命与环境科学学院,上海 200234)
在农业的发展中,农药发挥着重要的作用,然而由于农药的长期使用和残留,造成了环境的严重污染,对人体的危害是难以估量的.目前,国际上对农药最高残留量要求越来越严格,这些都给农药残留分离检测技术提出了更高的要求.
百草枯(又名对草快,Paraquat,1,1-二甲基-4,4 -联吡啶二氯化物,C12H14N2Cl2),属联吡啶类除草剂,易溶于水.长期通过摄取、吸入或皮肤接触会引起肾、肝和心脏的毛病,导致肺出现斑点和食道变窄.此外,它对皮肤、黏膜也有明显的刺激作用,可引起严重的局部损害.阿特拉津(又名莠去津,Atrazine,2-氯-4-乙胺-6-异丙胺-1,3,5-三嗪,化学式C8H14ClN5)属均三氮苯类化合物,三嗪类除草剂.在常温下,其水溶性为33 mg / L,对大部分一年生双子叶杂草具有很好的防治作用[1],是近年来最为广泛使用的一种除草剂.阿特拉津具有淋溶性,易被雨水、灌溉水淋溶至较深土层,或经地表流入河流、湖泊等水域,对地下水和地表水造成污染[2-3],且在适当条件下会重新释放而成为二次污染源[4].长期接触阿特拉津会影响人体的内分泌系统,容易导致乳腺癌和卵巢癌的发生,美国环保局的初步评价认为,阿特拉津属于环境内分泌干扰物,影响人体的内分泌系统以及动物的生殖繁衍.
阿特拉津和百草枯都属于除草剂,也溶于水,因此要检测这2种农药则必须对他们进行分离.分析农药残留的一般过程为提取-净化-检测.提取是将样品中的农药溶解分离出来的操作步骤,净化的基本原理主要为液—液作用、液—固作用、液—气作用及化学反应.经典的样品前处理方法有索氏提取法、液液萃取法、柱层析法、超临界流体萃取等.
目前,痕量农药的检测方法主要有气相色谱[5]、高效液相色谱法[6]、分光光度法、极谱法[7 ]、选择性电极法[8]、红外法、毛细管电泳法[9]及仪器联用法[10]等.然而,这些方法检测农药往往需要进行预分离,操作复杂,在连续监测及现场测定中受到限制.为了控制和遏制农药污染物的危险,研究操作简单、成本低的新分离检测方法越来越受到关注.
本文作者采用化学沉积法得到金纳米通道,通道内具有疏水性.百草枯和阿特拉津由于结构性质的差异导致其在水溶液的存在形态不一样,它们通过纳米通道膜的速率不一样从而达到分离二者的目的.可为有机分子及有机离子的分离提出一个新的思路.
1 实验部分
1.1 仪器与试剂
仪器:U 形流通池(自制),CHI 660电化学工作站(上海辰华仪器有限公司),紫外-可见分光光度计(PCS-2102,尤尼科),液相日立L-2100,场发射-扫描电子显微镜(SEM)(JEOL,日本),透射电子显微镜(TEM)(JEOL,日本),超纯水装置(PWVF,上海康雷分析仪器有限公司).
试剂:聚碳酸酯超滤膜 (PC膜,直径25 mm,孔径100 nm,厚6 μm,孔密度约为6.5×108/cm2,What man公司),阿特拉津(ATR),百草枯(PAR)(分析纯,北京振翔化工有限公司),其他试剂均为分析纯.试验用水均为18.2 MΩ的超纯水.
1.2 实验方法
采用化学沉积的方法,在100 nm PC膜上沉积金8.5 h,得到孔径约为50 nm的金纳米通道阵列膜.为确认金表面的电荷特性,取Au纳米通道膜用二氯甲烷溶解,超声1 min,使得金纳米通道均匀分散在水溶液中,测其zeta电位.
采用与文献[10]相同的分离装置,将纳米通道膜置于流通池的中间,膜的有效透过面积为0.196 cm2(由装置中“O”形孔的面积决定).在进样池中加入待测溶液(5 mL),透过池中放入等体积的母液,维持两边液体高度一致,在进样池与透过池中分别插入铂丝电极,加一恒定电压,经一定时间后,用紫外检测渗透池中待测物的含量,在波长222 nm处测定atrazine的紫外吸收,paraquat的测定波长为256 nm..
2 结果与讨论
2.1 金纳米通道膜的表征
图1为金纳米通道膜的扫描电镜图.由图1可见,100 nm聚碳酸酯原膜(图1 a)沉积金8.5 h后可以得到孔径约为50 nm的金纳米通道(图1 b).为了观测Au纳米通道孔道的型貌,以二氯甲烷将PC膜模板溶解,由其透射电镜图可见,依本法得到的Au纳米通道,具有良好的Au纳米通道结构(图1 c).图2为金纳米通道的Zeta电位图.从图2中可见,金纳米通道表面带有负电荷,有利于离子型百草枯分子的通过.

图1 100 nm 聚碳酸酯原膜(a)和金膜(b)的场发射扫描电子显微镜图及金膜用二氯甲烷溶解后的透射电镜图(c)

图2 金纳米通道的Zeta电位
2.2 百草枯与阿特拉津在金通道内的迁移
将浓度均为1.55×10-5mol/L的百草枯和阿特拉津溶于浓度为0.03 mol/L氯化钠溶液中,在U 形连通池的进样池中加入3 mL上述混合液,渗透池中加入3 mL纯水,间隔一定时间利用紫外检测百草枯的量,液相色谱紫外检测器于222 nm波长处检测渗透池中阿特拉津的含量,作渗透池中物质浓度(纵坐标)随时间(横坐标)的关系,所得直线斜率之比定义为两种待测物的分离度S:
S=Kp/Ka.
(1)
其中Kp代表百草枯的过膜速率,Ka代表阿特拉津的过膜速率.由于金纳米通道表面带有负电荷,与阳离子型百草枯之间有静电作用,可以选择性透过百草枯分子.对分子型阿特拉津而言,不存在此作用.故离子型百草枯要比分子型阿特拉津过膜速率要快.图3为百草枯和阿特拉津过膜量与时间关系,由图3可见,在pc膜中,百草枯和阿特拉津的过膜速度差别不大,而在金纳米通道膜中,百草枯过膜速度明显要比阿特拉津快,即Kp明显要比Ka大,这主要是由于金纳米通道带有负电荷.在无电场作用下,分离度S仅为2.84.
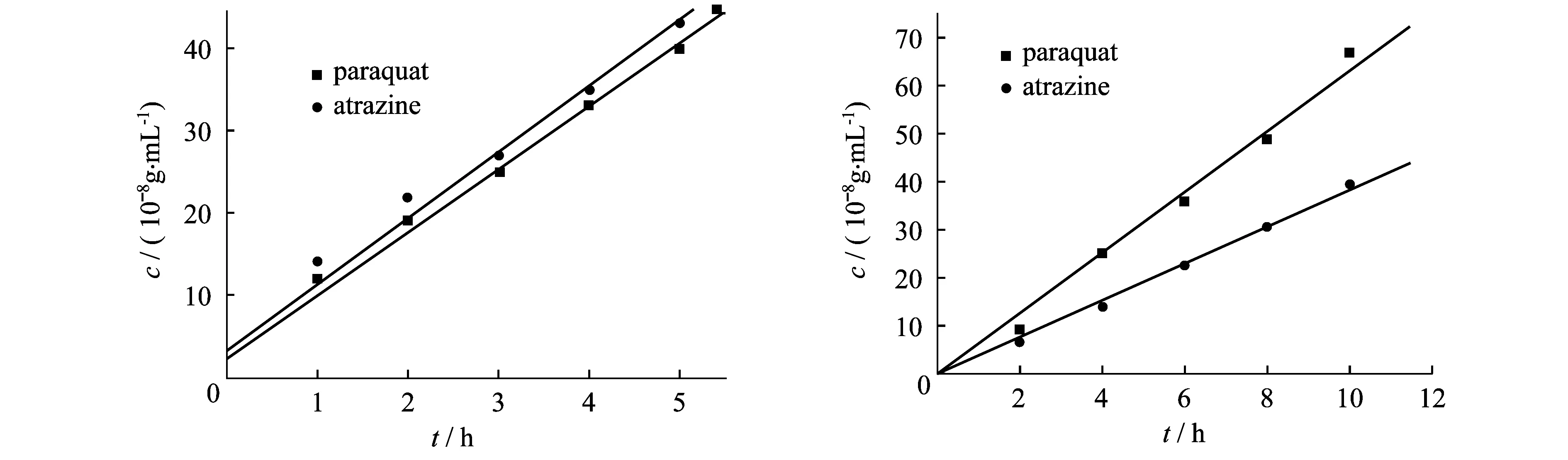
图3 混合组份PAR与ATR的PC膜和金纳米通道膜内迁移情况(左图为PC膜;右图为金纳米通道膜)
PAR为离子型化合物,在电场力驱动下可以快速透过Au纳米通道膜.而对分子型ATR而言,电压对其影响较小.考察了不同电压对PAR和ATR单组份透过纳米通道膜的影响(图4).随着电压的升高,离子型百草枯的通过量逐渐增加,分子型阿特拉津基本保持不变.理论上讲,当施加的电压越大时,paraquat的迁移速率越大.但考虑到所加电压过大时,可能会破坏有机分子的结构,因此,本实验选择加3V的恒电压做进一步考察.

图4 不同电场作用下ATR与PAR 透过量随时间的变化(左图为ATR;右图为PAR)
在3 V恒电压条件下,进样池中的百草枯在金纳米通道膜中的过膜速率远远大于阿特拉津的过膜速率,而且渗透池中百草枯的含量与透过时间成正比,分离度可高达15.7(图5).借此,可将阿特拉津与百草枯成功地分离.
2.3 pH的影响
在恒电压3 V条件下,考察了底液pH值对PAR与ATR过膜的影响.在pH 5.5~8.5 范围内,pH的改变对ATR和PAR的过膜速度基本上不产生影响.以下实验在中性溶液中进行.
2.4 纳米通道膜的重复性
使用过的金膜,用超纯水冲洗5次,再浸泡0.5 h,再冲洗5次,再次使用,图6为PAR和ATR浓度均为1.55×10-5mol/L在经分离60 min后,测定PAR在金纳米通道内过膜的情况.结果可见,实验结果基本保持一致.该实验重复3 d,结果稳定,即只要金膜不破,便可重复使用.
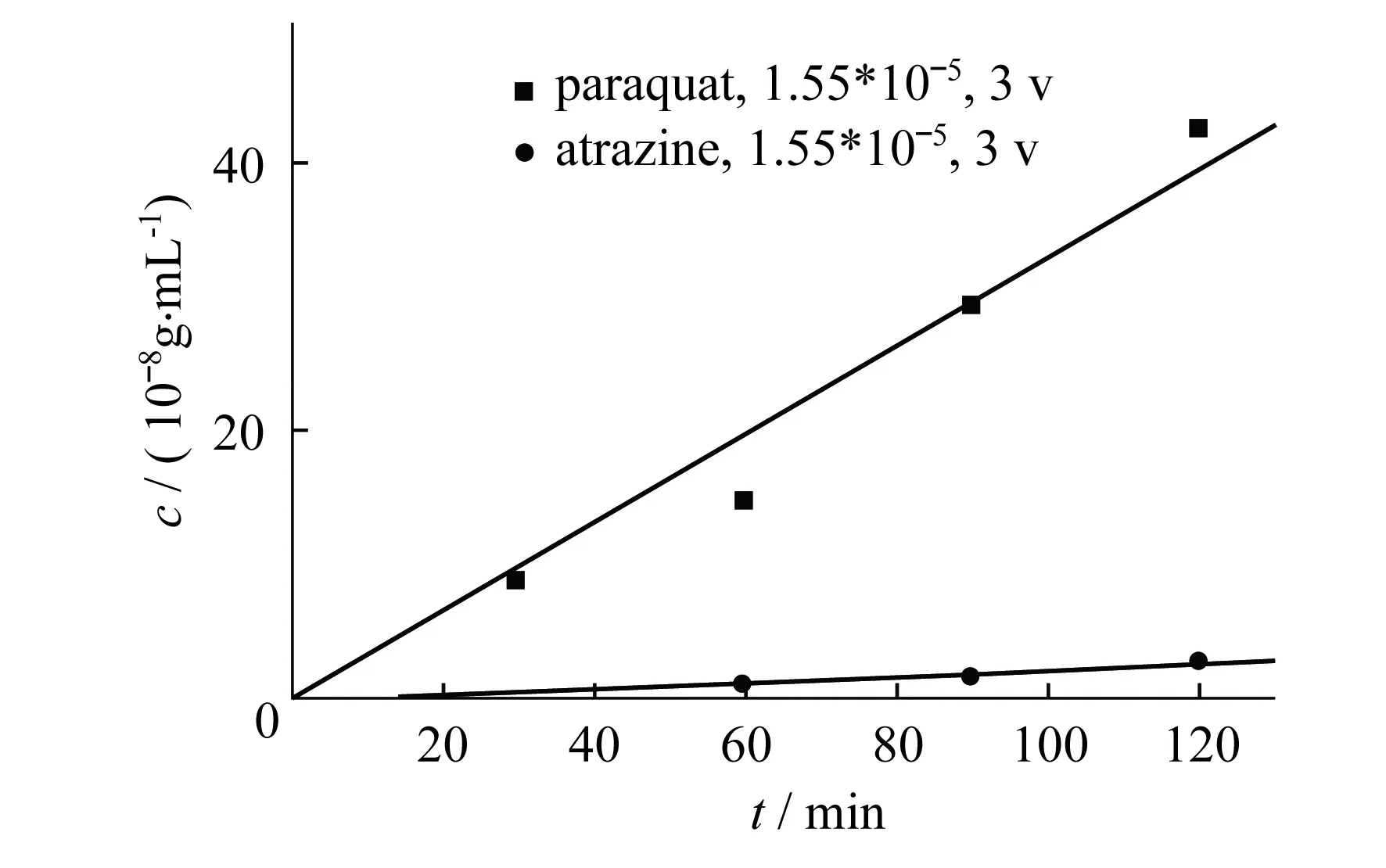
图5 在3V恒电压下,PAR与ATR透过量随时间的变化

图6 金纳米通道膜重复性实验的结果
2.5 百草枯的测定
采用U形池作为阿特拉津百草枯分离的装置,金纳米通道膜置于进样池和渗透池中间,在两端加一3 V恒定电压.以0.03 mol/L氯化钠为底液,在进样池中加入一定浓度的百草枯标准溶液,维持渗透池中液体高度与进样池一致,30 min后用紫外检测渗透池中百草枯的浓度.结果显示,30 min后渗透池中百草枯的浓度与进样池百草枯的浓度在7.8×10-6~6.2×10-4mol/L范围内呈线性关系(图7,横坐标为进样池中百草枯样品的浓度,纵坐标为30 min后渗透池中百草枯的含量).直线方程为y=0.08440x+ 0.01410,R=0.9992.
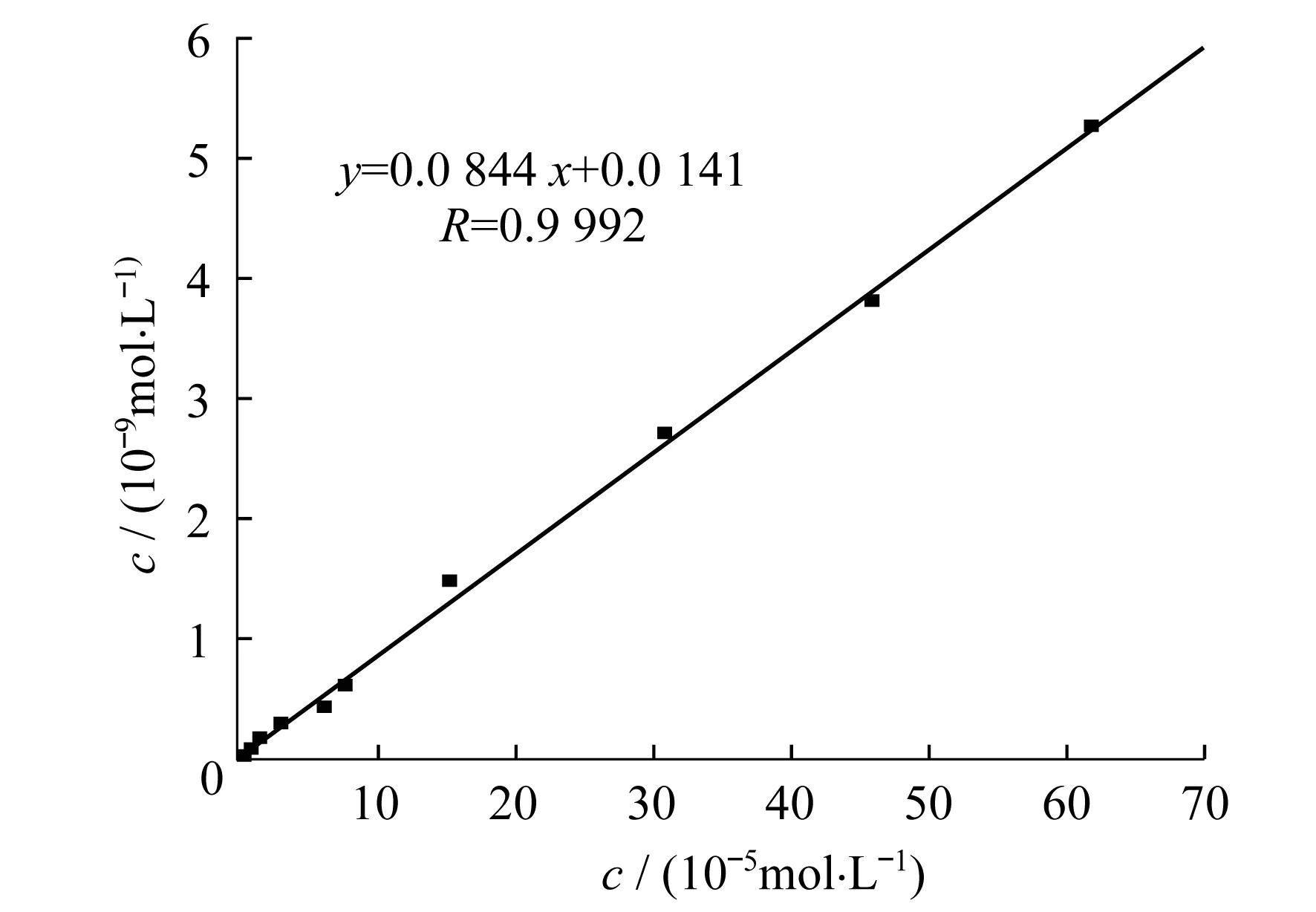
图7 3 V进样池与渗透池百草枯浓度的线性关系图
取上海师范大学附近小河水样,过滤后采用上述方法分离测定其中百草枯,结果表明,其含量在本方法的检测下限以下.
3 结 论
用化学沉积法得到金纳米通道阵列,金膜本身带有负电荷,可使阳离子型百草枯进行选择性透过.依据阿特拉津分子与百草枯分子在结构上的差异,施加一恒定电压,使离子型百草枯受电泳迁移的作用,从而加快分离百草枯的速度.该方法对有机分子及有机离子的分离提出一个新的途径,有利于进一步的检测分析,也为分离检测其他阴阳离子物质提供一个新的思路.此外,金膜可多次重复使用,从而提供了一种方便、有效、节约、对环境要求低的实用性分离材料.
参考文献:
[1] WARE G W.The pesticide book[M].Fresno:Thomson Publications.2000.
[2] COX C.Ten reasons not to use pesticides[J].J Pestic Reform,2001,21(4):2-5.
[3] NEUMANN G,TERAS R,MONSON L,et al.Simultaneous degradation of atrazine and phenol by pseudomonas sp.strain ADP:effects of toxicity and adaptation[J].Appl Environ Microbiol,2004,70(4):1907-1912.
[4] 弓爱君,叶常明.除草剂阿特拉津(Atrazine)的环境行为综述[J].环境科学进展,1997,5(2):38-49.
[5] TINDLE R C,GEHRKE C W,AUE W A.Improved GLC method for atrazine residue determination[J].J A ssoc Off A nal Chem,1968,51(3):682-688.
[6] BURROWS E P,BRUEGGEMAN E E,HOKE S H.Chromatographic trace analysis of guanidine substituted guanidines and s-triazifzes in water[J].J Ch romatogr,1984,294(1):494-498.
[7] HAYES M C,JOURDAN S W,HERZOG D P.Determination of atrazine in water by magnetic particle immunoassay:collaborative study[J].J AOAC Int,1996,79(2):529-537.
[8] NIKOLELIS D P,ANDREOU V G.Electrochemical transduction of interactions of atrazine with bilayer lipid membrane[J].Electroanalysis,1996,8(7):643-647.
[9] SCHMITT P,FREITAG D,SANLAVILLE Y,et al.Capillary electrophoretic study of atrazine photolysis[J].J Ch romatogr A,1995,709(1):215-225.
[10] GRUESSNER B,WATZIN M C.Patterns of herbicide contamination in selected vermont Streams detected by enzyme immunoassay and gas chromatography /mass spectrometry[J].Environ Sci Tech,1995,29(11):2806-2813.
[11] HUANG S S,YIN Y F.Transport and separation of small organic molecules through nanotubules[J].Analytical Science,2006,22(7):1005-1009.
- 上海师范大学学报·自然科学版的其它文章
- Regularization of Casimir free energy for p-dimensional Hypercubic Cavities inside D+1-dimensional Minkowski Spacetime
- 一类非线性中立型变延迟积分微分方程的稳定性分析
- Stability criteria for delay differential-algebraic equations
- Critical behaviors of gravity under quantum perturbations
- 结构化模型下可展期企业债定价
- The research on natural gas pipeline transportation price formulation method

