副猪嗜血杆菌四环素耐药基因TetB的PCR检测方法建立
江 军,李军星,康 磊,3,袁秀芳,徐丽华,王一成
副猪嗜血杆菌四环素耐药基因TetB的PCR检测方法建立
江 军1,2,李军星1,康 磊1,3,袁秀芳1,徐丽华1,王一成1
(1.浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021;2.南京农业大学 动物医学院,江苏 南京 210095;3.安徽农业大学动物科技学院,安徽 合肥 230061)
在本实验室前期研究的基础上,选取与四环素耐药表型相关性较好的TetB基因,建立PCR方法,以探索副猪嗜血杆菌耐药性的快速检测方法。本研究利用四环素主要耐药基因TetB的引物,对PCR反应条件进行优化,以副猪嗜血杆菌基因组DNA为模板,未出现非特异性扩增条带,PCR扩增条带单一。将TetB基因克隆至pMD 19T载体,以重组质粒为标准品,确定了最低检测拷贝数,经测定,最低检测拷贝数为1.54×103。以不同稀释度的21A7菌株基因组DNA为模板,确定了最低细菌检出量,经测定,最低检测细菌数量为4.6×103个。该方法为建立临床快速检测副猪嗜血杆菌耐药性奠定了基础。
副猪嗜血杆菌;耐药基因TetB;PCR检测
副猪嗜血杆菌(Haemophi1us parasuis,Hps)是猪格拉泽氏病(G1asser′s disease)的病原菌,引起猪多发性浆膜炎、关节炎和脑膜炎等[1]。近年来,猪繁殖与呼吸综合征、猪圆环病毒病等免疫抑制性疾病常继发Hps感染而增加发病率和死亡率,给养猪业造成了严重的损失[2],是目前影响浙江省养猪业最严重的细菌之一[3]。
细菌对四环素产生耐药的机制有3种。一是核糖体保护机制,编码核糖体保护蛋白与核糖体结合,阻止四环素与核糖体的结合,保证细菌蛋白质顺利合成,耐药基因有TetM,TetO,TetS,TetW,TetQ,TetT等[4];二是药物排出泵机制,此机制是将进入细胞内的四环素由导出泵排出细胞外,四环素类药物排出泵机制相关的耐药基因包括TetA,TetB,TetC,TetD,TetE,TetG,TetH,TetI,TetJ,TetZ,Tet30,Tet31,TetK,TetL,OtrB,Tcr3,TetPA,TetV和TetY等[5];三是酶钝化机制,TetX基因是唯一通过产生灭活四环素的酶而使细菌耐药的[6]。一般认为,革兰氏阴性基因细菌的耐药机制以抗生素的导出泵机制为主,对猪体内细菌及肠道细菌而言,其决定导出泵的耐药性基因以TetB为主[7]。
本研究在前期浙江省副猪嗜血杆菌耐药性调查中,确定了TetB为引起副猪嗜血杆菌四环素耐药表型的最主要基因的基础上,以TetB为检测对象,通过条件优化,初步建立了副猪嗜血杆菌四环素耐药表型的快速检测方法,为临床上防治副猪嗜血杆菌病合理使用抗菌药物提供依据。
1 材料与方法
1.1 材料
副猪嗜血杆菌菌株由本实验室从浙江省临床发病猪中分离保存,其中21A7菌株经本实验室检测,具备四环素耐药性及TetB耐药基因。PCR试剂及pMD 19T载体为TakaRa宝生物工程 (大连)有限公司产品,蛋白酶K购自生工生物工程 (上海)股份有限公司,细菌培养基购自OXOID LTD,其余试剂均为国产分析纯。
1.2 菌株基因组DNA的提取
以蛋白酶K消化法[8]提取DNA。取400μL纯培养的副猪嗜血杆菌菌液于1.5 m L离心管中,12 000 r·min-1离心3 m in;弃上清,加入400μL TE(pH值8.0)重悬菌体,12 000 r·min-1离心3 min;弃上清,加入400μL Tris(0.000 5%Tween-20,0.1mo1·L-1Tris,pH值8.5)重悬菌体,再加入6μL蛋白酶K(20 mg·m L-1),56℃作用45 m in,100℃再作用20 min,12 000 r·m in-1离心1 min。取上清作为模板进行PCR扩增。
1.3 PCR反应
[3]中的TetB引物,TetB1引物序列为5′-TGGTTAGGGGCAAGTTTTGG-3′,640 bp;TetB2引物序列为5′-GAGCATTGGTAAGGCTC-3′,640 bp。
PCR体系为25μL,包括1×PCR Buffer(含1.5 mM MgC12)、200μmo1·L-1dNTP混合物、各10 pmo1·L-1的上游引物及下游引物、0.2 U的r Taq聚合酶和2μL的模板DNA。
PCR运行程序为94℃预变性5 min;94℃变性20 s,56℃退火20 s,72℃延伸30 s,进行32个循环;最后再72℃延伸5 m in。取5μL的PCR产物进行琼脂糖凝胶电泳检测结果。
1.4 重组质粒pM D19T-TetB的构建
连接。取TetB的PCR产物与pMD 19T Vector连接。连接体系为10μL,包括TetB的PCR产物4.5μL,pMD 19T Vector 0.5μL,So1utionⅠ5μL。将混合物置于16℃金属浴中连接3 h。
转化。将10μL的连接产物加入到100μL的大肠杆菌TOP10感受态细胞中,混匀,冰上放置30 min,42℃热激45 s,冰上再放置1 min后加入700μL无抗性的LB液体培养基,放于37℃,200 r·min-1的摇床中1 h。然后取100μL菌液均匀涂布于含氨苄 (50μg·m L-1)抗性的LB平板上,37℃温箱中过夜培养。
挑菌鉴定。从长菌的平板上随意挑取5个单菌落分别至2 m L含氨苄(50μg·m L-1)抗性的LB液体培养基中,放于37℃,200 r·min-1的摇床中摇2 h。分别取2μL菌液作模板,进行PCR扩增。取5μL的PCR产物进行琼脂糖凝胶电泳。取1 m L呈阳性的菌液送去华大公司测序。
提取重组质粒。取150μL阳性菌液于15 m L含氨苄 (50μg·m L-1)抗性的LB液体培养基中,放于37℃,200 r·min-1的摇床中过夜。取菌液按质粒提取试剂盒说明提取重组质粒pMD 19T-TetB。将提取的重组质粒混匀后分装到1.5 m L的离心管中,用核酸蛋白分析仪测定重组质粒的浓度及纯度(D260/D280),用作TetB基因的标准模板,存放于-20℃冰箱。
1.5 特异性试验
选取不含四环素耐药性的10个临床菌株,进行纯培养,以蛋白酶K消化法提取纯培养细菌的基因组DNA,以总基因组为模板,进行TetB基因扩增,同时设以水为模板的阴性对照,以及以pMD 19T-TetB为模板的阳性对照。
1.6 敏感性试验
1.6.1 对TetB基因的标准模板检测敏感度
将上述所提的标准模板重组质粒pMD19T-TetB作10倍逐级稀释,稀释度为102~109。每个稀释度分别取1μL作模板,进行PCR扩增。取5μL的PCR产物进行琼脂糖电泳。
1.6.2 对TetB基因的标准模板检测敏感度
复苏21A7菌株于无抗性的TSA平板上培养过夜,取单菌落于2 m L无抗性的LB液体培养基中纯培养3~4 h使其处于对数生长期。取100μL对数生长期菌液于1.5 m L离心管,用无抗性的LB液体培养基对菌液作10倍逐级稀释,稀释度为106~109。取各个稀释度的菌液100μL涂于无抗性的TSA平板上,37℃温箱过夜培养。根椐菌落数计算对数生长期纯培养菌液的细菌浓度。
取500μL对数生长期的纯培养菌液于1.5 m L离心管,以蛋白酶K消化法提取纯培养的21A7细菌的基因组DNA。将DNA作10倍逐级稀释,稀释度为100~106。每个稀释度分别取2μL作模板,进行PCR扩增。取5μL的PCR产物进行琼脂糖凝胶电泳。
2 结果与分析
2.1 TetB基因PCR扩增
以副猪嗜血杆菌基因组DNA为模板,扩增到约640 bp的基因片段,与预期大小相符 (图1)。

图1 TetB基因PCR产物的电泳结果
2.2 重组质粒pM D 19T-TetB的PCR鉴定
以菌液为模板进行TetB基因扩增,PCR结果显示,随机挑取的5个菌落都为阳性克隆 (图2),测序结果证实为TetB基因。
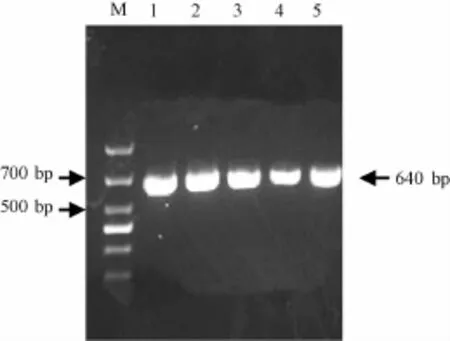
图2 pMD 19T-TetB的PCR鉴定结果
2.3 特异性试验结果
对10个不同临床分离株进行PCR扩增,电泳结果显示,TetB的引物具有良好的特异性,与受试临床分离株的基因组无非特异性扩增 (见图3)。
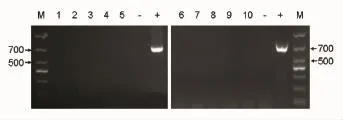
图3 特异性试验PCR结果
2.4 敏感度
经测定,pMD 19T-TetB重组质粒的浓度为0.056μg·μL-1,D260/D280=1.843,符合实验要求。该PCR方法的最低可以检测到107稀释的1 μL质粒 (图4)。TetB基因的拷贝数=(6.02× 1023拷贝数·mo1-1)×(质粒浓度g·m L-1)/(核苷酸分子量g·mo1-1)=(6.02×1023拷贝数·mo1-1)×(5.6×10-5g·m L-1)/(2 195 160 g·mo1-1),未经稀释的质粒为1.54×1013拷贝数·mo1-1。因此,重组质粒经107稀释后1μL所含的拷贝数为1.54×103,即该PCR能检测到的最低质粒含量为1.54×103个。
21A7菌株纯培养菌液稀释后,涂TSA平板后的长菌情况为106稀释度的平板上长菌最多,约为230个单菌落,所以可知1 m L菌液中细菌的数目为230×106×(1 m L/100μL)=2.3×109个· mL-1。21A7菌株DNA各个稀释度的PCR产物的琼脂糖凝胶电泳结果见图5,该PCR方法可以检测到103稀释的2μL基因组DNA,即可以检测到4.6×103个的细菌总DNA。
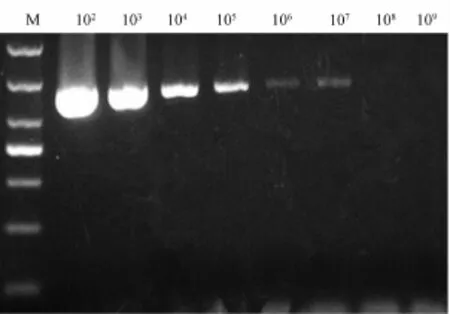
图4 以重组质粒为模板的敏感性试验结果
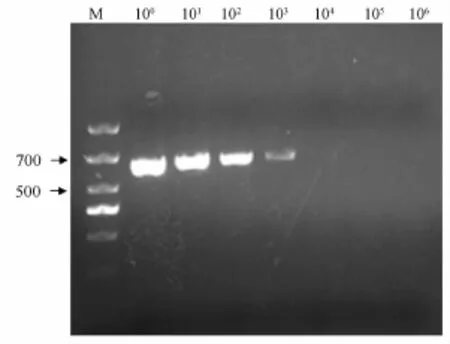
图5 以副猪嗜血杆菌总DNA为模板的敏感性试验结果
3 小结和讨论
四环素具有抗菌谱广、价格低廉等特点,因此是兽医临床最常用的抗生素之一。随着四环素的大量使用,结伴而来的就是细菌耐药性的激增,检测四环素耐药基因是判断细菌四环素耐药性的重要的快速手段。细菌四环素的耐药基因有数十种之多,华中农业大学刘维红等[9]对33株猪源沙门氏菌进行了TetA,TetB,TetC,TetD,TetE,TetG,TetK等四环素耐药基因检测,发现其中29株携带TetB基因,与四环素耐药表型的符合率为87.9%,但并未在其他4个耐药菌株中检测到上述7种耐药基因。这与本实验室前期实验发现的副猪嗜血杆菌TetB基因与四环素耐药表型的符合率(80.56%)[3]较为接近。2010年张纯萍等[10]从269株猪鸡大肠杆菌中检出TetA,TetB和TetM的比率为87.9%,28.4%和15.5%。因此,不同宿主来源或不同菌株中四环素耐药基因的种类差异较大。
建立细菌耐药性的快速诊断技术,对细菌性传染病的治疗具有重要的意义。目前临床上细菌耐药性检测大多采用药敏片试验方法,需要较长检测时间,难以快速诊断。本研究在综合分析本实验室前期有关副猪嗜血杆菌耐药表型和耐药基因相关性的基础上,选取相关性较高的四环素耐药基因为检测对象,探索建立副猪嗜血杆菌四环素抗性的PCR快速诊断方法。所建立的PCR检测方法与副猪嗜血杆菌基因组无非特异性扩增,最低可以检测4.6 ×103个的细菌总DNA,可用于快速判断实验室培养的副猪嗜血杆菌耐药性,克服了细菌培养检测药物敏感性需要较长时间的弊端,对于促进临床合理应用抗生素将具有重要意义。但该方法不建议用于临床病料样品的直接检测,因为病料中可能污染携带TetB基因的其他种类细菌而导致假阳性。
如前所述,细菌四环素耐药基因种类多,包括TetA,TetB,TetC,TetD,TetE,TetG,TetH,TetI等,其中多个基因与副猪嗜血杆菌四环素耐药表型的对应关系尚不明确,如进一步阐明副猪嗜血杆菌四环素耐药性与各种耐药基因的相关性,建立基于多种耐药基因的多重PCR检测方法,将进一步提升副猪嗜血杆菌四环素耐药表型的快速检测实用水平。
参考文献:
[1] O1iveira S,Pijoan C.Haemophi1us parasuis:new trends on diagnosis,epidem io1ogy and contro1[J].Vet M icrobio1,2004,99(1):1-12.
[2] Narita M,Kawashima K,Matsuura S,et a1.Pneumonia in pigs infected with pseudorabies virus and Haemophilus parasuis serovar 4[J].JComp Patho1,1994,110:329-339.
[3] 忽占利,李军星,胡松华,等.副猪嗜血杆菌分离株的耐药性及耐药基因分析 [J].华北农学报,2013,28(4):228-233.
[4] 许晓燕,王楷宬,邹君等.2型猪链球菌对四环素的耐药机制 [J].中国兽医学报,2013,31(10):1471-1475.
[5] Chopra I,Roberts M.Tetracyc1ine antibiotics:mode of action,app1ications,mo1ecu1ar bio1ogy,andepidemio1ogy of bacteria1 resistance[J].Microbio1 Mo1 Bio1 Rev,2001,65(2):232.
[6] 冯新,韩文瑜,雷连成.细菌对四环素类抗生素的耐药机制研究进展 [J].中国兽药杂志,2004,38(2):38 -42.
[7] Lee C,Lang1ois B E,Dawson K A.Detection of tetracyc1ine resistance determineants in pig iso1ates from tree herds with different histories of antimicrobia1 agent exposure[J].App1 Environ Microbio1,1993,59(5):1467.
[8] de 1a Puente Redondo V A,NavasMéndez J,Garca de1B1anco N,et a1.Typing of Haemophilus parasuis strains by PCR-RFLP ana1ysis of the tbpA gene[J].Veterinary M icrobio1ogy,2003,92(3):253-262.
[9] 刘维红,徐引弟,郭爱珍,等.致病性猪沙门菌四环素耐药基因tetB的PCR检测 [J].中国抗生素杂志,2006,31(11):51-55.
[10] 张纯萍,宁宜宝,宋立.健康鸡猪体内大肠杆菌对四环素的耐药性及耐药基因分布 [J].中国农业科学,2010,43(12):2578-2583.
(责任编辑:卢福庄)
S 854
B
0528-9017(2014)12-0000-00
文献著录格式:江军,李军星,康磊,等.副猪嗜血杆菌四环素耐药基因TetB的PCR检测方法建立 [J].浙江农业科学,2014(12):00 -00.
2014-09-17
畜禽健康养殖科技创新团队项目 (2010R50027)
江 军 (1989-),女,河北保定人,硕士,Te1:15058127581,Emai1:1146050993@qq.com
王一成 (1957-),男,浙江温岭人,研究员,硕士生导师,主要从事猪病防控研究。E-mai1:95711@sina.com

