细胞衰老相关基因MTMR2功能初探及相互作用蛋白的鉴定
李超群陈亚丽肖冬光裴华东,
(1. 天津科技大学生物工程学院 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457;2. 北京蛋白质组研究中心 蛋白质组学国家重点实验室,北京 100850)
细胞衰老相关基因MTMR2功能初探及相互作用蛋白的鉴定
李超群1陈亚丽2肖冬光1裴华东1,2
(1. 天津科技大学生物工程学院 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457;2. 北京蛋白质组研究中心 蛋白质组学国家重点实验室,北京 100850)
过氧化氢(H2O2)诱导的细胞衰老在肿瘤形成中有重要作用,为进一步研究其内在机制,通过全基因组shRNA文库筛选出与之相关的MTMR2(Myotubularin-related protein 2)基因,并通过β-半乳糖苷酶染色试验证实其在H2O2诱导的细胞衰老中发挥重要作用。通过克隆质粒、表达纯化并结合质谱分析,发现了MTMR2的一个可能的重要相互作用蛋白14-3-3,并通过生化方法对两者的相互作用进行确认。
过氧化氢 细胞衰老 MTMR2 shRNA文库筛选 shRNA
细胞衰老是一种不可逆的生长停滞状态,与人类衰老和肿瘤形成有着密切的关系[1]。体外培养的人体成纤维细胞(Human diploid fibroblasts,HDFs)像大部分体内细胞一样,在经历有限次的细胞分裂后便失去增殖能力,进入复制性衰老状态。衰老细胞的形态变化主要体现在细胞皱缩,膜通透性、脆性增加,核膜内折,细胞器数量特别是线粒体数量减少,胞内出现脂褐素等异常物质沉积等。
多种应激因素可以诱导细胞衰老的发生,目前研究最广泛的是癌基因相关的衰老,癌基因的过表达可促进细胞的增殖及肿瘤的形成,也可诱导细胞趋向衰老,即癌基因诱导的细胞衰老(Oncogeneinduced senescence,OIS),从而抑制肿瘤的形成[2]。细胞可通过多种机制调控OIS的发生。例如,癌基因可激活p16-Rb途径,抑制E2F并最终导致细胞周期阻滞及OIS的发生。此外,癌基因的表达可激活Arf-p53途径,引起细胞凋亡或OIS的发生。p53也可通过DNA损伤应答(DNA damage response,
DDR)等不依赖于Arf的途径而被激活,研究证实此过程同样在OIS的发生中发挥重要作用[3]。当前,对于过氧化氢(H2O2)诱导的细胞衰老研究较少,H2O2常用于获得短时间内氧化应激诱导的细胞衰老[4]。但是H2O2诱导细胞衰老的具体分子机制仍不是很清楚。因此,深入研究H2O2诱导的衰老机理,筛选参与该过程的相关基因,对进一步理解人类的衰老和年龄相关性疾病的诊断治疗具有重要意义。鉴于shRNA文库技术已经被广泛应用于筛选参与某一信号通路或某一表型的基因[5],本研究也采用shRNA文库筛选H2O2诱导细胞衰老过程中的相关基因,并对筛选结果进行生化分析,旨在为进一步研究其内在机制提供参考。
1 材料与方法
1.1 材料
1.1.1 质粒、文库与细胞 带有FLAG标签的真核表达载体pIRES为本实验室保存,人胚肾细胞293T和人胚肺成纤维细胞WI38均购自ATCC。shRNA文库购自Dharmacon公司。MTMR2(Myotubularin-related protein 2)shRNA靶标序列:5'-TCAGAGAATTCAGTGCATACA-3'。
1.1.2 主要试剂 DNA限制性内切酶、T4 DNA连接酶购自NEB公司;PEI转染试剂购自Invitrogen公司;Flag标签抗体、Flag M2 Beads及H2O2溶液购自Sigma(中国);14-3-3蛋白抗体购自Abcam(中国);DNA快速纯化回收试剂盒,质粒提取试剂盒购自Promega公司,酶切片段回收试剂盒购自OMEGA公司;细胞衰老β-半乳糖苷酶染色试剂盒(碧云天生物技术研究所),其他常规试剂均为进口或国产分析纯级产品。
1.2 方法
1.2.1 文库筛选 在293T细胞中将shRNA文库包装病毒后,收集病毒上清,感染WI38细胞,用100 μmol/L H2O2处理2 h后,恢复培养10 d至单细胞克隆形成,挑取培养皿上长出的单克隆,扩大培养,提取基因组DNA,PCR扩增shRNA靶向序列,将PCR产物克隆到T载体,测序分析。
1.2.2 β-半乳糖苷酶染色 6孔板中培养WI38细胞,吸除细胞培养液,用PBS洗涤1次,加入1 mL β-半乳糖苷酶染色固定液,室温固定15 min。吸除细胞固定液,用PBS洗涤细胞3次,每次3 min。 吸除PBS,每孔加入1 mL染色工作液[使用聚丙烯(polypropylene)容器配制染色工作液,染色工作液的配制方法参考试剂盒说明书]。37℃孵育过夜,用Parafilm或保鲜膜封住6孔板防止蒸发。普通光学显微镜下观察。
1.2.3 pIRES-MTMR2表达质粒的构建 以cDNA文库为模板,分别设计酶切位点为EcoR I 和Sal I的引物序列(下划线部分为插入的酶切位点):sense:5'-CCGGAATTCATGACAAATATGCAGAAGATTT-3'(EcoR I);anti-sense:5'-ACGCGTCGACGGATGGAG AAGAGCTCGAGCTGCG-3'(Sal I),通过PCR扩增MTMR2 编码序列。PCR程序:94℃ 4 min;94℃ 40 s,60℃ 1 min,72℃ 2 min,30个循环;72℃ 10 min。PCR产物经琼脂糖凝胶电泳回收纯化并用EcoR I和Sal I限制性内切酶进行双酶切,载体质粒pIRES进行同样的双酶切。回收酶切的片段和质粒经T4连接酶过夜连接。最后连接体系转化大肠杆菌DH5α,挑取阳性克隆提取质粒,进行酶切和基因测序鉴定,重组质粒命名为pIRES-Flag-MTMR2。
1.2.4 pIRES-Flag-MTMR2的表达纯化与质谱鉴定用转染试剂PEI将pIRES-Flag-MTMR2表达质粒转染293T细胞,6 h后更换新鲜培养基,24 h后将细胞从培养皿刮下,经离心收集到EP管中,PBS洗2次,再用NETN 裂解液[20 mmol/L Tris-HCl(pH8.0),100 mmol/L NaCl,1 mmol/L EDTA,0.5% NP-40]进行裂解,20 min后,离心收取上清,加入5×SDS loading buffer,100℃煮沸8 min,样品经SDS-PAGE电泳和Western blot检测。若表达成功,则依上述步骤,转染12个培养皿(直径10 cm)293T细胞,收取总蛋白并加入80 μL的Flag Beads进行IP纯化,4℃缓慢旋转孵育4 h,然后离心除去上清,将Flag Beads用NETN洗涤3次,最后在Flag Beads中加入60 μL的2×SDS loading buffer,100℃煮沸15 min。样品进行SDS-PAGE电泳,经考马斯亮蓝染色和Western blot确认后,剩余样品再经SDS-PAGE电泳,切胶后进行质谱分析。
1.2.5 免疫印迹分析(Western blot) 将Flag-MTMR2蛋白样品进行SDS-PAGE凝胶电泳,凝胶电泳结
束后,自上而下按照滤纸-胶-膜-滤纸的顺序在半干转移仪上放置好,转膜30 min后将膜取出,放入5%脱脂奶粉,于脱色摇床摇荡(75 r/min)封闭1 h以消除非特异背景。封闭完毕,加入anti-Flag的一抗,于脱色摇床4℃孵育(75 r/min)过夜,使一抗与特异蛋白结合。回收一抗,用TBST洗3次(75 r/min),每次5-10 min。加入二抗,于脱色摇床孵育1 h,使二抗与一抗结合。用TBST洗3次。最后加入ECL试剂,于暗室压片曝光。
1.2.6 细胞免疫荧光试验 将WI38细胞接种于放有盖玻片的6孔细胞培养板。细胞密度适中且完全贴壁,用4%多聚甲醛固定20 min,0.25% Triton X-100透膜15 min,用1% BSA封闭1 h,一抗室温孵育1 h,荧光二抗室温孵育1 h。取下盖玻片,细胞面朝下放在滴有50%甘油PBS的载玻片上封片。荧光显微镜下观察。
2 结果
2.1 shRNA文库筛选结果
经基因组范围的文库筛选,发现一个基因MTMR2和H2O2诱导的细胞衰老有关。如图1所示,正常的WI38用100 μmol/L H2O2处理2 h,培养3 d后,用β-半乳糖苷酶染色试剂盒(Senescence β-Galactosidase Staining Kit)染色,能发现SA-β-Gal(Senescence-associated β-galactosidase)活性水平上调,表明许多细胞发生了衰老。而当细胞转入了靶向MTMR2的shRNA敲低MTMR2蛋白水平时,SA-β-Gal的活性水平显著降低(图1),此外,在过表达MTMR2的WI38细胞中,没有观察到SA-β-Gal活性水平的变化,这可能是因为WI 38细胞内源MTMR2的量已经足够使细胞衰老。以上结果表明,MTMR2与H2O2诱导的细胞衰老紧密相关。
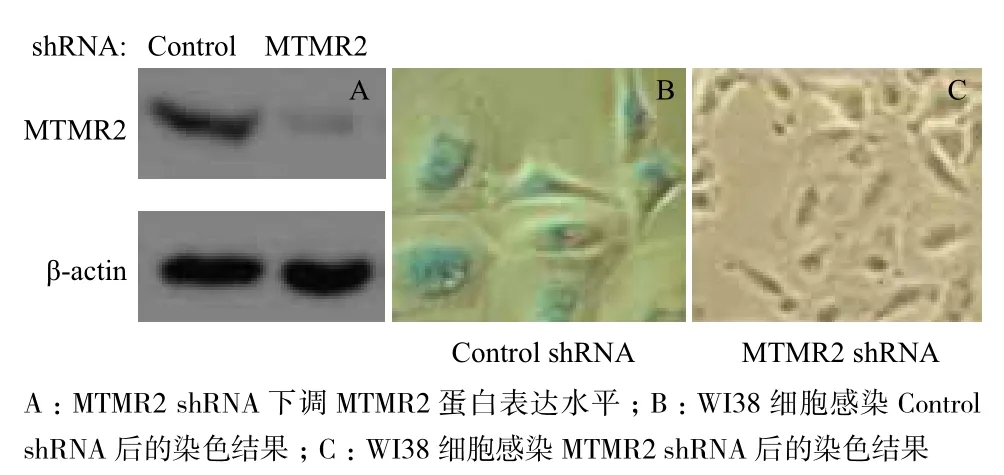
图1 MTMR2 调控WI38细胞衰老
2.2 MTMR2 编码基因的扩增与表达质粒的构建
重组质粒转化大肠杆菌DH5α,挑取阳性克隆并提取质粒,利用EcoR I和Sal I 进行酶切鉴定,双酶切重组质粒后产生一条线性载体条带和一条约1 900 bp的目的条带(图2)。对于酶切鉴定正确的重组质粒进行测序,结果表明插入的目的基因核苷酸序列完全正确。

图 2 重组表达质粒pIRES-Flag-MTMR2 酶切分析
2.3 Flag-MTMR2的表达纯化与质谱分析
将重组质粒pIRES-Flag-MTMR2转染293T细胞,24 h后收集蛋白进行Western blot检测,分别用标签抗体anti-Flag和内源抗体anti-MTMR2检测重组蛋白的表达。结果(图3)显示,Flag抗体检测到Flag-MTMR2的表达,而MTMR2抗体则分别检测到了内源和外源MTMR2蛋白的表达,表明重组质粒pIRES-Flag-MTMR2表达成功。

图3 Flag-MTMR2融合蛋白的表达检测
在重组蛋白成功表达的基础上,在12盘(直径10 cm细胞培养皿)293T细胞中转染重组质粒pIRES-Flag-MTMR2,24 h后收集蛋白,使用Flag beads进行IP纯化,样品经SDS-PAGE电泳后,通过考马斯亮蓝染色和Western blot检测Flag-MTMR2
蛋白的纯化效果。结果(图4)显示,考马斯亮蓝染色和Western blot结果表明经过IP纯化,Flag-MTMR2主带明显,并结合许多相互作用蛋白。

图4 纯化后样品的SDS-PAGE(A)及FLAG抗体检测的Western blot检验(B)
将确认纯化成功的样品,再经SDS-PAGE和考马斯亮蓝染色后,切胶进行质谱分析,鉴定MTMR2的相互作用蛋白。结果表明,在质谱结果中,除含有已经确认的MTMR2的一个相互作用蛋白SBF1(Myotubularin-related protein 5)之外,还发现了高丰度的14-3-3蛋白的4个亚基(表1)。据报道,14-3-3蛋白家族在真核细胞中广泛表达并高度保守,它通过介导或调解蛋白相互作用,在细胞周期、凋亡、信号转导等方面发挥重要的作用。猜测MTMR2可能通过与14-3-3蛋白相互作用而在细胞衰老过程中发挥功能。

表1 Flag-MTMR2纯化后的质谱结果
2.4 MTMR2与14-3-3蛋白相互作用的验证
为进一步确证MTMR2与14-3-3蛋白的相互作用,首先在WI38细胞中通过免疫荧光技术验证14-3-3蛋白与MTMR2的定位关系,发现二者可以共定位(图5)。此外,通过内源的免疫共沉淀试验检测它们之间的相互作用,结果(图6)显示,当用MTMR2的抗体做免疫沉淀时,能共沉淀下来14-3-3 蛋白的θ亚基,表明在细胞内MTMR2能够与14-3-3 蛋白的θ亚基相互作用,而MTMR2与14-3-3蛋白其它亚基的相互作用,仍需进一步的试验确证。
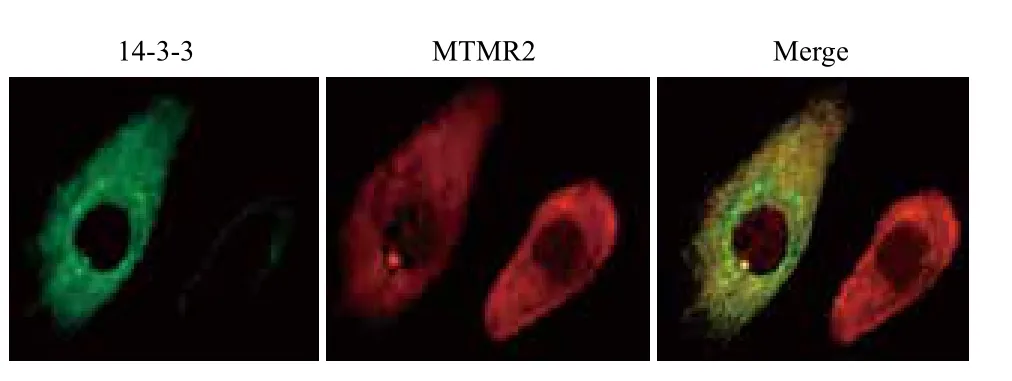
图5 免疫荧光技术证明14-3-3蛋白与MTMR2蛋白共定位
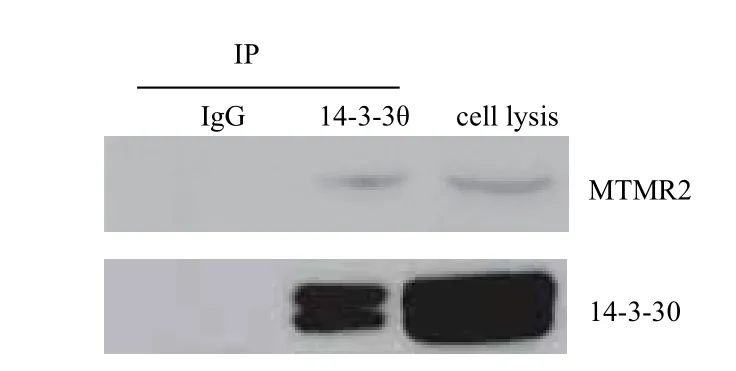
图6 内源免疫共沉淀试验证明14-3-3 θ亚基与MTMR2相互作用
3 讨论
H2O2诱导的细胞衰老一直是人们研究的热点,有报道指出H2O2处理IMR90细胞会使抑癌蛋白p53表达水平短暂增高,细胞周期依赖性蛋白激酶抑制剂p21表达水平持续增强以及抑癌蛋白Rb的去磷酸化[6]。也有文献报道H2O2通过调节TGF-β1的表达水平影响细胞衰老[7]。
本试验利用H2O2诱导的细胞衰老模型,通过shRNA文库筛选,鉴定了1个可能与细胞衰老相关的基因MTMR2。MTMR2是肌微管素蛋白家族的一员,可以编码一种酪氨酸磷酸酶[8],据报道,MTMR2可以将底物PI-3-P和PI-3,5-P2分别去磷酸化成为磷脂酰肌醇和PI-5-P,并且在AKT通路中发挥重要的作用,MTMR2的过表达可以抑制表皮生长因子受体(EGFR)的降解,促进AKT的持续激活[9]。该基因的突变会导致4B型进行性腓骨肌萎缩,这是一种常染色体隐性脱髓鞘神经病[10]。也有报道该
蛋白可能与DNA损伤修复相关[11]。目前,人们对该蛋白的了解仍然很少。我们通过质谱并结合生化试验鉴定到MTMR2的一个可能的重要相互作用蛋白14-3-3,而14-3-3蛋白家族在真核细胞中广泛表达并高度保守,通过识别磷酸化的苏氨酸/丝氨酸而与靶蛋白结合[12]。14-3-3蛋白可以(1)作为接头分子诱导蛋白质之间的相互作用[13];(2)调节蛋白的亚细胞定位[14];(3)激活或抑制酶的活性[15]。通过这些功能进而影响信号转导、细胞周期调控、凋亡、细胞应激等许多生命活动,这对我们进一步研究MTMR2在细胞衰老中的功能以及H2O2诱导细胞衰老的分子机制具有重要指导意义。
4 结论
本研究通过shRNA文库筛选,鉴定了1个可能与H2O2诱导的细胞衰老相关的基因MTMR2,并对其进行了进一步的验证,发现其重要的相互作用蛋白,为深入研究H2O2诱导细胞衰老的内在机制提供了新的方向。
[1]Smith JR, Pereira Smith OM. Replicative senescence:implications for in vivo aging and tumor suppression[J]. Science, 1996, 273(5271):63-67.
[2]Campisi J. Replicative senescence:an old lives’ tale?[J]. Cell, 1996, 84(4):497-500.
[3]Chen Q, Fischer A, Reagan J, et al. Oxidative DNA damage and senescence of human diploid fibroblast cells[J]. Proc Natl Acad Sci USA, 1995, 92:4337-4341.
[4]Herbig U, Ferreira M, Condel L, et al. Cellular senescence in aging primates[J]. Science, 2006, 311:1257.
[5]Kittler R, Pelletier L, Heninger AK, et al. Genome-scale RNAi profiling of cell division in human tissue culture cells[J]. Nat Cell Biol, 2007, 9(12):1401-1412.
[6]Lu T, Finkel T. Free radicals and senescence[J]. Exp Cell Res, 2008, 314:1918-1922.
[7]Rai P, Onder T, Young J, et al. Continuous elimination of oxidized nucleotides is necessary to prevent rapid onset of cellular senescence[J]. Proc Natl Acad Sci USA, 2009, 106:169-174.
[8]Franklin NE, Bonham CA, Xhabija B, et al. Differential phosphorylation of the phosphoinositide 3-phosphatase MTMR2 regulates its association with early endosomal subtypes[J]. J Cell Sci, 2013, 126(6):1333-1344.
[9]Amoasii L, Hnia K, Laporte J. Myotubularin phosphoinositide phosphatases in human diseases[J]. Curr Top Microbiol Immunol, 2012, 362:209-233.
[10]Acosta JC, Banito A, Wuestefeld T, et al. A complex secretory program orchestrated by the inflammasome controls paracrine senescence[J]. Nat Cell Biol, 2013, 15:978-990.
[11]Murakami T, Kutoku Y, Nishimura H, et al. Mild phenotype of Charcot-Marie-Tooth disease type 4B1[J]. J Neurol Sci, 2013, 334(1-2):176-179.
[12]Fu H, Subramanian RR, Masters SC. 14-3-3 proteins:structure, function, and regulation[J]. Annu Rev Pharmacol Toxicol, 2000, 40:617.
[13]Aitken A, Howell S, Jones D. 14-3-3 alpha and delta are the phosphorylated forms of Raf-activating 14-3-3 beta and zeta[J]. J Biol Chem, 1995, 270:5706-5709.
[14]Wang W, Shakes DC. Molecular revolution of the 14-3-3 protein family[J]. J Mol Evol, 1996, 43:384-398.
[15]Fu H, Coburn J, Collier RJ. The eukaryotic host factor that activates exo-enzyme S of Pseudomonas aeruginosa is a member of the 14-3-3 protein family[J]. Proc Natl Acad Sci USA, 1993, 90:2320-2324.
(责任编辑 马鑫)
MTMR2 Interacts with 14-3-3 and Regulates H2O2Induced Cell Senescence
Li Chaoqun1Chen Yali2Xiao Dongguang1Pei Huadong1,2
(1. Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin Key Laboratory Industial Microbiology College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457;2. State Key Laboratory of Proteomics,Beijing Proteome Research Center,Beijing 100850)
H2O2-induced cell senescence plays an important role in tumorigenesis. To further study the underlying mechanism, we identified five relevant members through a genome wide shRNA screening and took MTMR2(Myotubularin-related protein 2) as an example to figure out its function in H2O2-induced cell senescence. By plasmid construction and expression in combination with purification and mass spectrometry, we found a significant interacting protein of MTMR2:14-3-3 proteins family, and their interaction was then confirmed using biochemical methods.
H2O2Cell senescence MTMR2 shRNA pool screening shRNA
2014-04-22
李超群,男,硕士研究生,研究方向:DNA损伤修复;E-mail:BPRC_LI@126.com
裴华东,男,博士,研究员,博士生导师,研究方向:DNA损伤修复与肿瘤细胞代谢;E-mail:peihuadong@hotmail.com肖冬光,男,硕士,教授,博士生导师,研究方向:现代酿造技术和微生物资源开发;E-mail:xdg@tust.edu.cn

