甘草总黄酮提取部位抗小鼠抑郁活性可能与其增强中枢5-羟色胺能神经功能有关
程瑞凤,景 晶,华 冰,薛旻秋,陆钊罡,赵伟鸿,樊紫周,果 嘉,杨卫东,王英华,彭晓东,3
(1.宁夏医科大学药学院药理学系,宁夏银川 750004;2.宁夏回族自治区药品检验所,宁夏银川 750004;3.宁夏颅脑疾病重点实验室,宁夏银川 750004)
甘草总黄酮提取部位抗小鼠抑郁活性可能与其增强中枢5-羟色胺能神经功能有关
程瑞凤1,景 晶1,华 冰1,薛旻秋1,陆钊罡1,赵伟鸿1,樊紫周1,果 嘉1,杨卫东1,王英华2,彭晓东1,3
(1.宁夏医科大学药学院药理学系,宁夏银川 750004;2.宁夏回族自治区药品检验所,宁夏银川 750004;3.宁夏颅脑疾病重点实验室,宁夏银川 750004)
目的 探讨甘草总黄酮提取部位(LF)的抗抑郁作用及可能的作用机制。方法 KM小鼠分别每天po给予LF 5,30和180 mg·kg-1,连续21 d,于第1天、第7天和第21天给药后1 h进行强迫游泳实验(FST),记录4 min内不动时间;另取KM小鼠,按照FST的实验分组处理,于第1天、第7天和第21天po药后1 h进行悬尾实验(TST),记录4 min内不动时间。ICR小鼠分别每天po给予LF 50,150和400 mg·kg-1,连续7 d,进行利血平诱发症状拮抗实验(ART),于末次给药后1 h采用记录小鼠运动不能、上睑下垂和监测肛温;另取KM小鼠,分别每天po给予LF 50,150和400 mg·kg-1,连续7 d,于末次给药1 h后sc阈致死剂量的育亨宾,观察24 h小鼠存活情况;取 KM小鼠,分别每天 po给予 LF 50,150和400 mg·kg-1,连续7 d,第8天进行5-羟色氨酸诱导的甩头实验(HTT),记录30 min内的甩头次数,并检测皮质、海马和丘脑中单胺氧化酶(MAO)活性。结果 FST和TST实验结果显示,与正常对照组比较,LF能够减少小鼠游泳和悬尾的不动时间(P<0.05),且与氟西汀有相似的时-效特点。ART实验结果显示,LF能够拮抗给予利血平1 h后引起的小鼠上睑下垂和运动不能(P<0.05),但不能够拮抗4 h后引起的小鼠体温降低。LF对育亨宾阈致死剂量引起的小鼠死亡没有协同增加作用;LF 150和400 mg·kg-1均能明显协同增加注射5-羟色氨酸后甩头次数(P<0.05),小鼠皮质、海马和丘脑中MAO活性与正常对照无差异。结论 LF在急性绝望小鼠模型上具有抗抑郁样作用,其作用机制可能与其直接增强脑内5-羟色胺能神经功能有关。
抑郁症;甘草;黄酮;5-羟色氨酸;单胺氧化酶;5-羟色胺能神经元
甘草(Glycyrrhiza uralensis Fisch.)为豆科(Leguminosae)甘草属(Glycyrrhiza)多种植物的根和根茎。甘草提取物具有良好的抗实验动物抑郁模型的活性[1-4],其涉及的活性成分包括甘草素(liquiritigenin)、异甘草素(isoliquiritigenin)、光甘草定 (glabridin)、甘草苷(liquiritin)和异甘草苷(isoliquiritin)等,而所涉及的可能作用机制包括对中枢单胺氧化酶(monoamine oxidase,MAO)的抑制[3,5];抑 制 5-羟 色 胺 (5-hydroxytryptamine,5-HT)再摄取转运体蛋白5-HT转运蛋白(serotonintransporter,SERT)及靶位突触后膜5-HT1A受体的阻断作用[4]。由于活性成分多为黄酮,所以增强中枢的抗氧化能力亦可能为甘草抗抑郁活性的重要机制[1,6]。而笔者前期实验研究表明,从宁夏地区栽培甘草中获得的甘草总黄酮(licorice flavonoids,LF)提取部位具有抗大鼠慢性应激抑郁行为的作用,且可能机制涉及对海马神经再生能力的保护作用[7]。
本研究拟采用小鼠强迫游泳实验(forced swimming test,FST)和悬尾实验(tail suspension test,TST),评价LF在急性绝望模型上的抗抑郁样作用;采用 5-羟色氨酸(5-hydroxy-L-tryptophan,5-HTP)诱导小鼠甩头实验(head-twitches test,HTT)、育亨宾毒性增强实验(yohimbine toxicity potentiation test,YTPT)、利血平诱发症状拮抗实验(antagonism of reserpine-induced symptoms test,ART)和脑内MAO活性检测实验,以期进一步研究分析LF的抗抑郁作用及相关机制。
1 材料与方法
1.1药品和试剂
LF,宁夏药检所王英华主任药师提供,其中主要含有甘草苷、异甘草苷、甘草素、异甘草素、甘草查尔酮B、刺甘草查尔酮和4′,7-二羟基黄酮等[8-11]。盐酸氟西汀分散片购自中国苏州制药有限公司;帕吉林 (批 号:068K1468),5-HTP(批 号: C11H12N20C),育亨宾(批号:MFCD00012674),利血平(批号:068K1585)和丙米嗪(批号: SLBC6401V)均为美国Sigma产品;重酒石酸去甲肾上腺素注射液购于上海禾丰制药有限公司;蛋白定量测定试剂盒购于南京建成生物工程研究所。
1.2实验动物
昆明(KM)小鼠和 ICR小鼠,雄性,体质量16~18 g,清洁级动物,由宁夏医科大学动物中心提供,合格证号:SCXY(宁)2005-0001。动物于实验前适应性饲养3 d,自然昼夜节律光照条件下饲养,自由获得食物和水,并维持室温20~24℃,相对湿度50%~60%,每笼5只群养。行为学实验于上午9:00~11:00进行。
1.3 FST检测不动时间
80只雄性KM小鼠,实验室适应饲养3 d后,通过FST进行实验用鼠的筛选。将单只小鼠放入水深15 cm,直径20 cm,水温保持在21~25℃的小桶中,期间小鼠后肢不能触及桶底,强迫游泳4 min。按照标准:① 前80~90s内不动小鼠;②后90 s内绝大多数时间一直游泳,偶尔不动小鼠;③后150 s内游泳不动时间>80%小鼠。剔除不动时间较长和较短的小鼠。将所得合格小鼠60只,按体质量随机分为正常对照组(去离子水,20 mL·kg-1,po),LF组(5,30和180 mg·kg-1,po)和氟西汀(20 mg·kg-1,po)5组,每组12只;每天上午8:00给药,连续21 d,并于给药前1 h禁食不禁水。给药期间分别于给药后的第1天、第7天和第21天po给药1 h后进行FST。实验具体参照文献方法[12-14]。将小鼠分别放入同前所述相同条件的小桶内,观察记录6 min,并累计后4 min内小鼠在水中停止挣扎或者呈漂浮状态、仅微小肢体运动以保持头部浮在水面的持续时间(即不动时间)。
1.4 TST检测不动时间
取80只雄性KM小鼠,实验室适应饲养3 d后,通过FST进行实验用鼠的筛选。将小鼠尾部穿过孔板,距尾尖3 cm处软夹、胶布固定并悬于自制内部漆黑的悬尾箱(32 cm×32 cm×30 cm,且仅正前方呈10 cm×10 cm的圆形开口,便于观察摄录)内,小鼠头部距底面3 cm。筛选时间为3 min,剔除不动时间<25 s及不动时间>150 s的小鼠。将满足要求的60只小鼠按照1.3项进行分组及给药,并于第1天、第7天和第21天给药1 h后依照文献方法[15]791,[16]记录共 6 min,记录后4 min的不动时间。
1.5利血平拮抗实验
取雄性ICR小鼠72只,实验室适应饲养3 d后,随机分为正常对照组、丙米嗪20 mg·kg-1(po)及LF 50,150和400 mg·kg-1(po),每组12只。根据体质量按20 mL·kg-1灌胃给药,连续7 d。各组在第7天给药后1 h均ip给予利血平4 mg·kg-1,按文献方法[13],[15]807观察测定以下指标。
1.5.1运动不能观察
ip利血平1 h后,将小鼠放入直径为7.5 cm的圆圈内观察15 s,记录未出圈的小鼠数目。
1.5.2眼睑下垂观察
ip利血平1 h后,将小鼠单个竖放15 s,观察小鼠上睑下垂程度。眼睑闭合程度评分标准:全闭为4分,3/4闭为3分,1/2闭为2分,1/4闭为1分,未闭为0分。分别将各组小鼠的评分归纳统计,取均值比较。
1.5.3肛温测定
末次po给药前将电子体温计探头插入小鼠肛门内,维持10 s检测肛温作为小鼠基础体温;ip利血平4 h后重复测量肛温。计算用药前后肛温变化的差值。
1.6育亨宾小鼠毒性增强实验观察死亡数
预实验获得育亨宾的小鼠阈致死剂量为30 mg·kg-1(sc)。60只雄性KM小鼠,实验室适应饲养3 d,按照体质量随机分正常对照组及LF 50,150和400 mg·kg-1(po),每组15只。根据体质量按每只小鼠20 mL·kg-1给予量连续灌胃7 d。末次灌胃30 min后给予相应阈致死剂量的育亨宾(30 mg·kg-1,sc),观察记录24 h内每组小鼠的死亡数[13,17]。
1.7 5-HTP诱导小鼠甩头实验和MAO活性检测
参照文献方法[15]808。预实验发现,给予正常小鼠帕吉林(100 mg·kg-1,ip)30 min后,再次给予相应剂量的5-HTP可以记录到特征性甩头行为的阈剂量为10 mg·kg-1(ip)。
取雄性KM小鼠90只,实验室适应饲养3 d后,随机分为正常对照组、氟西汀20 mg·kg-1组、LF50,150及400 mg·kg-1组,每组15只。连续ig给药7 d后,第8天各组首先ip给予帕吉林100 mg·kg-1,30 min后再行 ip给予 5-HTP 10 mg·kg-1,并随即将小鼠置于观察箱内记录小鼠每5 min的甩头次数,共测6次,持续观察30 min。
实验结束后,将小鼠快速处死,在冰台上迅速操作取出全脑,分别剥离皮质、海马和丘脑,然后分别按1∶10质量体积比加生理盐水,制成10%匀浆,2000×g离心10 min得上清液。采用考马斯亮蓝法检测上清液中蛋白质含量,并调整所有样品蛋白质浓度为1 g·L-1。测定酶活性时取样品液0.5 mL,加入0.3 mL 5-HT 4 mmol·L-1,用磷酸缓冲液0.2 mol·L-1(pH 7.4)补足至3 mL。反应系统在37℃下保温1 h,每隔15 min振荡混合1次,1 h后加入0.6 mL盐酸1 mol·L-1终止反应,之后再加入乙酸丁酯4 mL,混合提取,2000×g离心10 min,取上清液在280 nm处测定吸光度值(absorbance,A)。酶活性以每1 mg组织蛋白在37℃ 1 h内产生0.01个A值为一个活性单位(U),以kU·g-1蛋白为单位。
1.8 统计学分析
结果采用Graph PadInStat(Instant Biostatistics Version3.06)软件实施分析。量反应资料数据以表示,选用单因素方差分析和Dunnett t检验。质反应资料采用χ2检验。以P<0.05判断有显著性差异。
2 结果
2.1 LF对小鼠不动时间的影响
2.1.1 强迫游泳实验
如表1所示,在第1天ig给药1 h后,测得的不动时间各组无差别。第7天给药后,与正常对照组比较,氟西汀20 mg·kg-1组则减少33%(P<0.01);LF 30和180 mg·kg-1组小鼠不动时间分别减少25%(P<0.05)和32%(P<0.01)。第21天给药后,氟西汀20 mg·kg-1组则减少27%(P<0.01);LF 5,30和180 mg·kg-1组小鼠不动时间分别减少17%(P<0.05),25%(P<0.05)和26%(P<0.01)。说明LF在小鼠FST模型上具有抗抑郁作用,且与氟西汀作用强度相似。
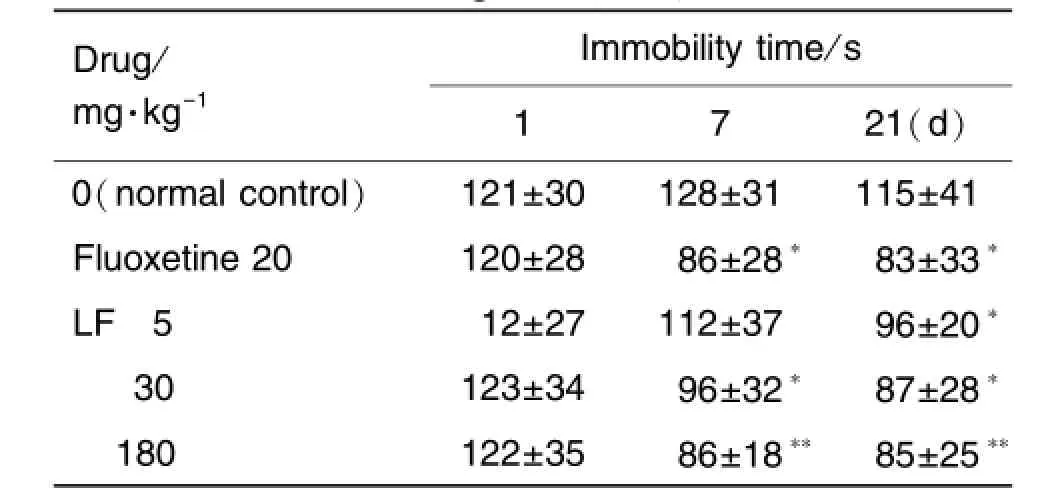
Tab.1 Effect of licorice flavonoids(LF)on immobility time in forced swimming test(FST)in mice
2.1.2 悬尾实验
如表2所示,在第1天实施灌胃给药1 h后,测得的不动时间各组没有差别。在第7天给药后,与正常对照组比较,给予氟西汀20 mg·kg-1组小鼠不动时间减少 26%(P<0.01);LF 30和180 mg·kg-1组小鼠不动时间分别减少19%(P<0.05)和31%(P<0.01)。21 d后,氟西汀组则减少27%(P<0.05);LF 5,30和180 mg·kg-1剂量组小鼠不动时间分别减少 30%(P<0.01),32% (P<0.01)和 34%(P<0.01)。说明 LF在小鼠TST模型上具有抗抑郁作用,作用强度与氟西汀相似。
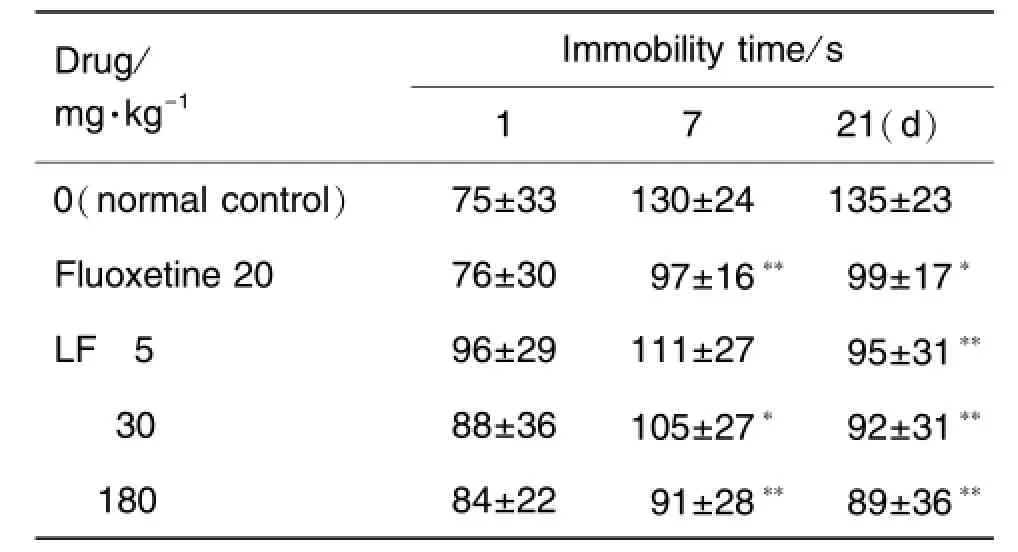
Tab.2 Effect of LF on immobility time in tail suspension test in mice
2.2 LF对利血平诱导的小鼠体温下降、上睑下垂及运动不能的影响
如表3所示,给药7 d后,只有丙米嗪20 mg·kg-1组能够拮抗注射利血平4 h后引起的体温降低,拮抗率为53%(P<0.01);丙米嗪及LF 50,150和400 mg·kg-1均能够明显拮抗注射利血平1 h后引起的上睑下垂,拮抗率分别为82%(P<0.01),61%(P<0.01),73%(P<0.01)和85%(P<0.01);同样,丙米嗪及各剂量组的LF均能够明显拮抗注射利血平1h后引起的运动不能。说明LF拮抗利血平诱导的上眼睑下垂,可能与其增强中枢5-HT神经功能有关;拮抗利血平诱导的运动不能,可能与LF直接或间接增强中枢多巴胺能神经功能有关。
2.3 LF对小鼠育亨宾毒性增强实验中死亡率的影响
给药7 d后,给予LF 50,150和400 mg·kg-1小鼠分别給予阈致死剂量的育亨宾后,小鼠死亡率分别为2/15,1/15和2/15,与单纯育亨宾组无统计学差异。说明LF的抗抑郁作用可能与促进中枢去甲肾上腺素神经功能无关。
2.4 LF对5-HTP诱导小鼠甩头和MAO活性的影响
如表4所示,给药7 d后,氟西汀20 mg·kg-1及LF 150和400 mg·kg-1均能够明显增加注射5-HTP后小鼠的甩头次数。说明LF可能具有增强中枢5-HT能神经功能的作用。表5结果显示,LF对各皮质、海马及丘脑中MAO活性无影响。
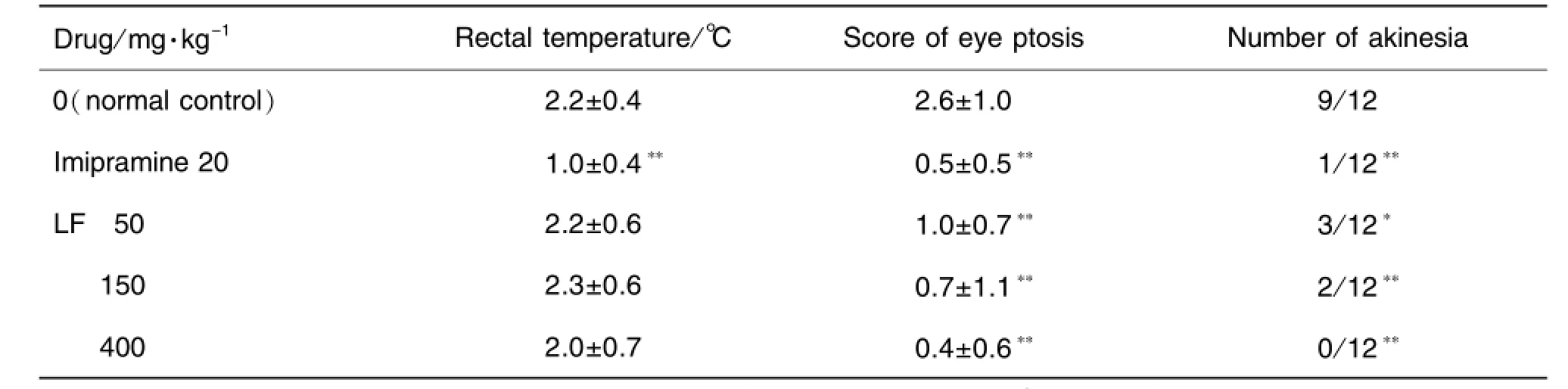
Tab.3 Effect of LF on body temperature,eye ptosis and akinesia of mice

Tab.4 Effect of LF on head-twitches of mice
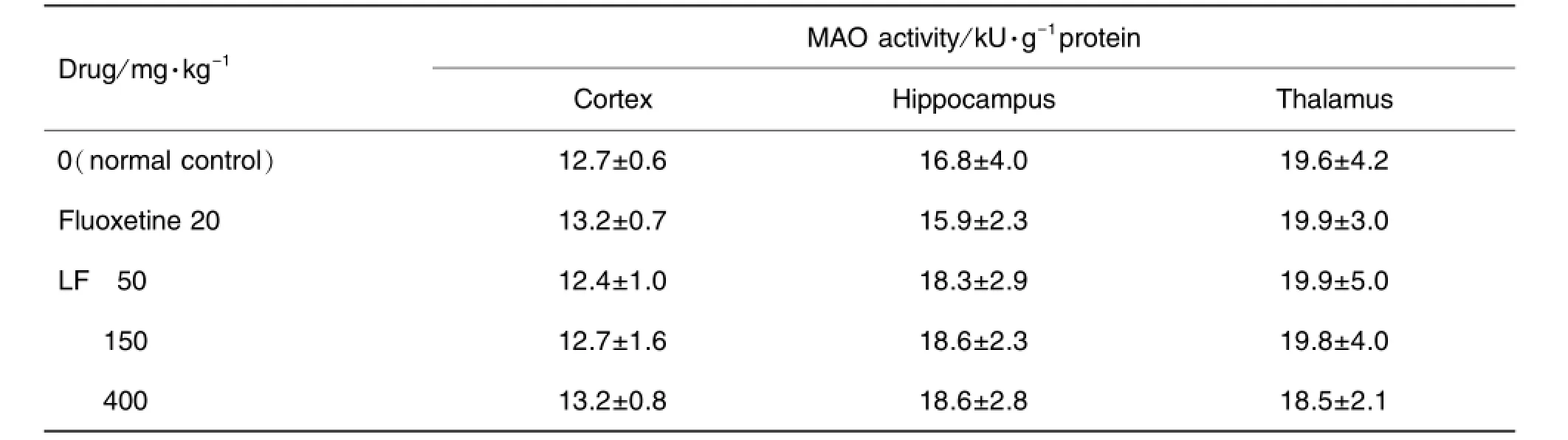
Tab.5 Effect of LF on monoamine oxidase(MAO)activity in brain of mice
3 讨论
本研究结果发现,LF在亚急性用药(7 d)即对FST和TST中的不动时间产生影响,且随用药时间的延长效果则更为明显,说明LF不仅具有对抗慢性应激抑郁行为的作用[7],在急性绝望模型上同样具有抗抑郁样作用。
现代药理学研究表明,目前临床使用的抗抑郁药最终的疗效多数与增强中枢5-HT能神经功能有关[18-19]。利血平作为传统的单胺类神经递质的耗竭剂,主要通过抑制囊泡的再摄取功能使单胺神经递质滞留在囊泡外而被MAO降解,从而使递质耗竭、神经功能下降,继而引起行为和生理反应而。作为经典的抗抑郁动物实验模型。通过对利血平拮抗实验所表现出的动物行为分析与中枢特定神经功能变化的相关性分析得出[13-14],能够拮抗利血平引起的上眼睑下垂症状的药物,可能与其增强中枢肾上腺素能神经功能或5-HT能神经功能机制有关;能够拮抗利血平引起的体温下降的药物,可能与其直接或间接激动中枢β-肾上腺素受体有关;而药物能够拮抗利血平引起的运动不能症状,可能与其直接或间接增强中枢多巴胺能神经功能机制有关。本研究发现,给予LF 7 d,各剂量组对利血平诱发的眼脸下垂及运动不能症状有较好的改善作用,而对体温下降症状没有作用。所以,推测LF可能有中枢5-HT能神经功能或多巴胺能神经功能增强作用,而无中枢β-肾上腺素受体的激动效应。
本研究进一步发现,同样给予7 d的LF不能够协同增强阈剂量水平的育亨宾产生的毒性反应。而研究表明,育亨宾可选择性地抑制中枢去甲肾上腺素能神经突触前膜上的α2受体,抑制去甲肾上腺素的再摄取,进而增强中枢去甲肾上腺素能神经的功能。当将可能增强中枢去甲肾上腺素神经功能的药物与阈致死剂量的育亨宾同时应用,就可以通过上述机制产生协同作用,增强毒性反应。该模型主要用于研究可能通过促进中枢去甲肾上腺素能神经功能发挥治疗作用的药物作用机制的分析[13,18]。所以,推测LF的抗抑郁作用可能与增强中枢去甲肾上腺素能神经功能无关。
5-HTP诱导小鼠甩头实验模型最早由Corne等[20]在1963年建立标准。如果预先给予可能增强中枢5-HT能或去甲肾上腺素能神经功能药物,如5-HT再摄取抑制剂类抗抑郁药或MAO抑制剂,可使中枢相应递质水平蓄积增多;若再给予MAO抑制剂帕吉林进一步抑制MAO的活性后,再行给予5-HTP进一步增加中枢内5-HT水平,实验动物出现特殊的甩头样行为症状[15]808,[20]。本研究结果显示,给予7 d的LF能够明显协同增加5-HTP引起的甩头次数,并且体现了良好的剂量依赖关系。同时本研究通过检测小鼠脑内不同脑区MAO活性发现,与他人的研究结果有所不同[3,5],LF对MAO没有明显的抑制作用,原因可能与他人采用离体实验方法有关。
综上所述,从宁夏地区栽培甘草中提取分离获得的LF在急性绝望模型上具有抗抑郁样作用,其机制可能涉及直接增强中枢5-HT神经功能。
[1] Zhao Z,Wang W,Guo H,Zhou D.Antidepressant-like effect of liquiritin from Glycyrrhiza uralensis in chronic variable stress induced depression model rats[J].Behav Brain Res,2008,194(1): 108-113.
[2] Dhingra D,Sharma A.Antidepressant-like activity of Glycyrrhiza glabra L.in mouse models of immobility tests[J].Prog Neuropsychopharmacol Biol Psychiatry,2006,30(3):449-454.
[3] Tanaka S,Kuwai Y,Tabata M.Isolation of monoamine oxidase inhibitors from Glycyrrhiza uralensis roots and the structure-activity relationship[J]. Planta Med,1987,53(1):5-8.
[4] Ofir R,Tamir S,Khatib S,Vaya J.Inhibition of serotonin re-uptake by licorice constituents[J].J Mol Neurosci,2003,20(2):135-140.
[5] Hatano T,Fukuda T,Miyase T,Noro T,Okuda T. Phenolic constituents of licorice.Ⅲ.Structures of glicoricone and licofuranone,and inhibitory effects of licorice constituents on monoamine oxidase[J]. Chem Pharm Bull(Tokyo),1991,39(5):1238-1243.
[6] Lee SY,Lee SJ,Han C,Patkar AA,Masand PS,Pae CU.Oxidative/nitrosative stress and antidepressants:targets for novel antidepressants[J]. Prog Neuropsychopharmacol Biol Psychiatry,2013,46:224-235.
[7] Fan ZZ,Zhao WH,Guo J,Cheng RF,Zhao JY,Yang WD,et al.Antidepressant activities of flavonoids from Glycyrrhiza uralensis and its neurogenesis protective effect in rats[J].Acta Pharm Sin(药学学报),2012,47(12):1612-1617.
[8] Wang YH,Bai H,Dou DQ,Pei YP,Chen YJ,Li W,et al.Study on the flavonoids constituents of cultivated licorice[J].Northwest Pharm J(西北药学杂志),2004,19(6):252-253.
[9] Zhan XP,Zhai Y,Ma L,Wang K,Wang YH.The study on quality analysis of cultivated licorice in Ningxia[J].Ningxia Med J(宁夏医学杂志),2009,31(11):1008-1009.
[10] Li S,Li W,Wang Y,Asada Y,Koike K.Prenylflavonoids from Glycyrrhiza uralensis and their protein tyrosine phosphatase-1B inhibitory activities[J]. Bioorg Med Chem Lett,2010,20(18):5398-5401.
[11] Li W,Li S,Lin L,Bai H,Wang Y,Kato H,et al. Bioassay-guided isolation and quantification of the alpha-glucosidase inhibitory compound, glycyrrhisoflavone,from Glycyrrhiza uralensis[J].Nat Prod Commun,2010,5(7):1049-1053.
[12] Porsolt RD,Bertin A,Jalfre M.Behavioral despair in mice:a primary screening test for antidepressants[J].Arch Int Pharmacodyn Ther,1977,229 (2):327-336.
[13] Bourin M.Is it possible to predict the activity of a new antidepressant in animals with simple psychopharmacological tests?[J].Fundam Clin Pharmacol,1990,4(1):49-64.
[14] Porsolt RD, Brossard G, Hautbois C, Roux S. Rodent models of depression:forced swimming and tail suspension behavioral despair tests in rats and mice[M]∥ CrawleyJN, Gerfen CR, Rogawski MA.Current Protocols in Neuroscience. New York:John Wiley and Sons,Inc.,2001: 8.10A.1-8.10A.10.
[15] Vogel GH,ed.Drug Discovery and Evaluation: Pharmacological Assays[M].3rd ed.New York: Springer-Verlag Publicatioin,2008:791.
[16] Steru L,Chermat R,Thierry B,Simon P.The tail suspension test:a new method for screening antidepressants in mice[J].Psychopharmacology (Berl),1985,85(3):367-370.
[17] Alpermann HG,Schacht U,Usinger P,Hock FJ. Pharmacological effects of Hoe 249:a new potential antidepressant[J].Drug Dev Res,1992,25 (4):267-282.
[18] Blier P, de Montigny C.Currentadvances and trends in the treatment of depression[J].Trends Pharmacol Sci,1994,15(7):220-226.
[19] Blier P, El Mansari M.Serotonin and beyond: therapeutics for major depression[J].Philos Trans R Soc Lond B Biol Sci,2013,368(1615): 20120536.doi:10.1098/rstb.2012.0536
[20] Corne SJ,Pickering RW,Warner BT.A method for assessing the effects of drugs on the central actions of 5-hydroxytryptamine[J].Br J Pharmacol Chemother,1963,20:106-120.
Anti-depression effect of licorice flavonoids from Glycyrrhiza uralensis through promotion of central serotonergic neural function in mice
CHENG Rui-feng1,JING Jing1,HUA Bing1,XUE Min-qiu1,LU Zhao-gang1,ZHAO Wei-hong1,FAN Zi-zhou1,GUO Jia1,YANG Wei-dong1,WANG Ying-hua2,PENG Xiao-dong1,3
(1.Department of Pharmacology,College of Pharmacy,Ningxia Medical University,Yinchuan 750004,China;2.Ningxia Institute for Drug Control,Yinchuan 750004,China;3.Ningxia Key Laboratory of Cerebrocranial Diseases,Yinchuan 750004,China)
OBJECTlVE To investigate the antidepressant effect and related mechanism of the total flavonoids extract parts(licorice flavonoids,LF)from Glycyrrhiza uralensis Fisch.cultivated locally in Ningxia.METHODS Forced swimming test(FST)and tail suspension test(TST)were adopted to study the antidepressant pharmacological effect in the acute stress-induced depression model in mice. The KM mice were intragastrically administered with LF(5,30 and 180 mg·kg-1)once daily,for 21 consecutive days.One hour after the first,seventh and last administrations,the mice were submitted to FST by recording the immobility period within the last 4 min of the total 6 min in both tests and the results were expressed as decrease in immobility period with respect to vehicle control.In TST,the other group of KM mice was used to evaluate the antidepressant effect in same protocol.In the antagonism of reserpineinduced symptoms test(ART),ICR mice were administered intragastrically with LF(50,150 and 400 mg·kg-1)once daily for 7 consecutive days.One hour after the last administration,the mice received reserpine(4 mg·kg-1,ip),and ptosis or akinesia was measured 1 h after reserpine injection while rectal temperature was measured 4 h after the reserpine injection respectively.The same protocol was adopted in yohimbine toxicity potentiation test(YTT)as in ART.Thirty minutes fter the last adminis-tration,the mice received the threshold lethal dosage of yohimbine(30 mg·kg-1,sc)respectively,and the death number of the mice was calculated in 24 h after the yohimbine administration.In the 5-hydroxy-L-tryptophan(5-HTP)induced head-twitches test(HTT)in mice,after being administered intragastrically with LF(50,150 and 400 mg·kg-1)once daily for 7 consecutive days,the mice received pargiline (100 mg·kg-1,ip)the next day,and 30 min later,5-HTP(10 mg·kg-1,ip)was intraperitoneally injected to induced the head twitch respectively,and the times of head twitch in a 30 min period after 5-HTP treatment were observed at 6 time points.After HTT,the mice were sacrificed quickly,and the monoamine oxidase(MAO)activity in the brain cortex,hippocampus and thalamus was examined to evaluate the antidepressant effect of flavonoids with MAO inhibition.RESULTS Compared with the vehicle control,LF significantly decreased the immobility period in both FST and TST(P<0.05).LF(50,150 and 400 mg·kg-1)antagonized the ptosis and akinesia symptoms respectively in 1 h after reserpine administration(P<0.05),but failed to antagonize hypothermia produced 4 h after reserpine administration.Also,at the same dosage,LF did not synergetically produce the enhancement of death by subcutaneous injection of yohimbine at the threshold lethal dosage.LF(150 and 400 mg·kg-1)could significantly and synergetically increase 5-HTP induced head-twitches response(P<0.05),but LF could not promote MAO activity in the cortex,hippocampus and thalamus at the same dosage.CONCLUSlON LF exerts antidepressant-like effect on the model of acute despair test.The mechanism might be related to direct enhancement of the serotonergic neural function in the brain.
depression; Glycyrrhiza uralensis Fisch.; flavonoids; 5-hydroxy-L-tryptophan;monoamine oxidase;serotonergic neurons
PENG Xiao-dong,E-mail:pengxd@nxmu.edu.cn,Tel:(0951)6980192
R285.5,R964
A
1000-3002(2014)04-0484-07
10.3867/j.issn.1000-3002.2014.04.002
Foundation item:The project supported by National Natural Science Foundation of China(81060113)
2013-12-09 接受日期:2014-05-20)
(本文编辑:乔 虹)

国家自然科学基金(81060113)
程瑞凤(1987-),女,硕士研究生,主要从事神经精神药理学研究,E-mail:crf_1987618@126.com;彭晓东(1967-),男,教授,主要从事神经精神药理学研究,E-mail:pengxd@nxmu.edu.cn.
彭晓东,E-mail:pengxd@nxmu.edu.cn,Tel:(0951)6980192

