大孔树脂对酶解大豆肽脱盐效果影响及其最佳条件研究
,,*,,,, ,,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.北大荒豆制品有限公司,黑龙江哈尔滨 150060)
透析、超滤、纳滤为目前主要的脱盐方法,但这些方法对小分子脱盐效果不佳,而且肽回收率较低[5]。已有报道关于大孔树脂对鱼降压肽有很好的脱盐效果[6]。潘道东等研究了DA201-C对ACE抑制肽的静态吸附实验[7]。大孔树脂利用的是吸附原理和分子筛原理,它主要通过范德华力、氢键的分子间作用力对分子进行吸附。在合适的环境下,吸附剂的内表面积愈大,吸附量愈高。邓劲光,程云辉分别研究了不同种类的大孔树脂对氢化可的松,麦胚肽的吸附洗脱性能[8-9]。基于树脂孔径的大小、极性的强弱和已有的研究综合考虑,选择5种不同树脂对大豆肽进行静态吸附解吸实验,在确定吸附性能较好树脂基础上,优化出树脂的最佳脱盐条件,并对大豆肽进行初步的分离和纯化。

表1 大孔树脂的物理结构参数Table 1 Physics configuration parameters of the macroporous resin
1 材料与方法
1.1 材料与仪器
DA201-C、AB-8、D3520、D4006和NAX-Ⅱ大孔吸附树脂 郑州勤实科技有限公司;大豆分离蛋白(蛋白含量89.12%) 谷神生物科技集团有限公司;Alcalase碱性蛋白酶诺维信(中国)生物技术有限公司;Folin-酚试剂 美国Sigma 公司;其他试剂均为分析纯。
离心机 北京医用离心机厂;LGJ 21真空冷冻干燥机 上海医用分析仪器厂;pH计 奥多利斯科学(北京)有限公司;UV-2401PC紫外可见分光光度计 岛津公司;1.5×60cm的层析柱 上海华美实验仪器厂;HZQ-X100震荡培养箱 哈尔滨市东联电子技术开发有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白酶解液的制备 称取一定质量的大豆分离蛋白于酶反应器中,加水调成一定的底物浓度(蛋白/水,w/w),磁力搅拌器匀速搅拌,待原料充分溶解后,反应温度为55℃,pH控制在(8.0±0.10)。加入一定量的碱性蛋白酶,酶解时间为2h。当反应结束时,pH调为4.5使未水解的大分子蛋白沉淀,90℃灭酶10min,6000r/min离心10min,即得到粗酶解液,浓缩,冷冻干燥得到大豆肽。用pH-State法[10]控制酶解液的水解度,此水解度为15.6%。
1.2.2 大孔吸附树脂静态吸附实验
1.2.2.1 大孔吸附树脂的预处理 本实验选用5种大孔吸附树脂,树脂的具体参考性能见表1。大孔吸附树脂首先用无水乙醇浸泡24h,使树脂充分溶胀,然后洗至220nm处无吸收峰,再用去离子水洗净至无乙醇味,抽滤备用[11]。
1.2.2.2 大孔树脂条件的优化 于250mL锥形瓶中加入经过预处理后的2.5g不同种类的树脂,分别向其中浓度为25mg/mL的酶解液50mL,在摇床上震荡12h,使其充分吸附,用不同稀释度25%、50%、75%、100%的乙醇溶液对树脂进行静态解析,并测定溶液中肽的浓度及测定其脱盐效果。脱盐效果的测定用的是铬酸钾指示剂法测定肽液中Cl-浓度[12]。


1.2.2.3 DA201-C树脂静态吸附与解析实验条件优化
a.pH对DA201-C树脂吸附性能的影响:向5个250mL的锥形瓶中加入预处理好的2.5g的树脂,乙醇充分溶胀之后,用去离子水洗净乙醇,抽滤后备用。取5份浓度为15mg/mL的酶解液30mL,将pH分别调为4、5、6、7、8加入到锥形瓶中,置于25℃恒温震荡箱中,震荡12h。吸附后多肽含量用Foline-酚法测定[13]。
b.酶解物浓度对DA201-C树脂吸附性能的影响:向3个锥形瓶中加入预处理好的2.5g的树脂,乙醇充分溶胀之后,用去离子水洗净乙醇,抽滤后备用。向其中分别加入浓度为15、30、45、60mg/mL的酶解液20mL(pH均为4.5)。置于25℃恒温震荡箱中,震荡12h。多肽含量测定方法如上。
c.不同乙醇浓度对解吸特性的影响:向5个锥形瓶中加入预处理好的2.5g的树脂,乙醇充分溶胀之后,用去离子水洗净乙醇,抽滤后备用。加入底物浓度为60mg/mL酶解液20mL,pH4.5,置于25℃恒温震荡箱中,震荡12h。向其中分别加入浓度为0、25%、50%、75%和100%的无水乙醇溶液进行解吸。多肽含量测定方法如上。
解析率(%)=解析液多肽浓度×解析液体积/吸附量×树脂质量×100
d.DA201-C树脂对酶解液的动态解析特性研究:把预处理好的大孔吸附树脂装满1.5cm×60cm的层析柱,室温条件下,以1.5mL/min流速的酶解液经过层析柱,酶解液浓度为60mg/mL。用紫外检测器于220nm处测定吸光值,以A220nm=0.05为透过点,先用去离子水以同样的流速流经层析柱,每5min收集一管水洗脱液,当水洗脱液于去离子水的电导率相当时,用75%的乙醇对DA201-C树脂以同样的流速进行洗脱,每5min收集一管水洗脱液,并不断用紫外分光光度计进行监测。测定脱盐率及肽回收率。

1.3 数理统计
本实验数据采用Excel进行方差分析及多重比较。
2 结果与分析
2.1 五种不同大孔树脂的初步筛选
由图1,可以得出所对应的5种大孔树脂的吸附率分别为25.4%、32.33%、50.7%、35.97%、28.93%。经F检验p<0.05,各树脂间吸附率存在差异,接着进行了多重比较,得出各树脂之间差异显著,其中DA201-C的吸附率较其它树脂好,原因可能是该树脂属于非极性树脂,比表面积较大,当浓度一定时,比表面积越大,单位时间内吸附蛋白的量越大。碱性蛋白酶酶解物具有较多的疏水性氨基酸,疏水基团与非极性吸附剂间形成范德华力、氢键[14],起到了很好的吸附效果。

图1 5种大孔树脂的吸附率 Fig. 1 Adsorption rate of five macroporous resins
由图2结果可见当乙醇浓度为75%时,该列字母不同者为差异性显著。DA201-C树脂解析效果最好,且显著高于其他各组(p<0.05)。由于不同浓度的乙醇具有不同的极性,其吸附解析过程对蛋白具有不同的选择性。其实质是一种疏水性质的置换过程,乙醇能消弱蛋白质非极性侧链的排水倾向,从而使肽洗脱下来[15]。当乙醇浓度为100%时,酶解物的解吸率下降可能是由于相对分子质量较大的肽类在无水乙醇中溶解度较低导致的。

图2 5种大孔树脂的静态解析曲线 Fig. 2 Static adsorption curves of five macroporous resins to soybean peptides
不同树脂脱盐率见图3,由图可知,5种树脂平均值均在85%以上,其中DA201-C的脱盐率为92.9%,各树脂间脱盐率差异不显著(p>0.05),均具有较好的脱盐率,说明大孔树脂对于盐溶液不具有吸附性,在活性肽脱盐方面起到很好的效果。
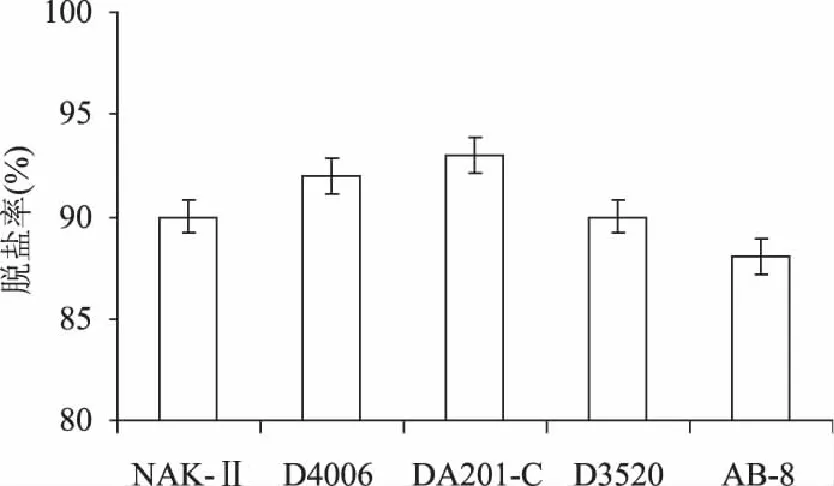
图3 不同树脂的脱盐率 Fig. 3 Desalination rates of different macroporous resins
根据不同树脂的静态吸附得出DA201-C大孔吸附树脂对大豆肽具有较好的吸附和解析性。本实验对DA201-C大孔吸附树脂静态吸附解析特性进行研究,并测其动态吸附解析实验。
2.2 DA201-C大孔吸附树脂对大豆肽的静态吸附与解析
2.2.1 pH对DA201-C吸附性能的影响 由图4看出,pH在4~6之间吸附量之间不存在显著差异,在酶解过程中需要把pH调为4.5沉淀大分子,直接用酶解液进行脱盐处理即可。此结论与张晓梅[16]在大豆活性肽的研究中报道相一致。当pH为8.0时,吸附量有所增加,可能是酶解物为两性的多肽混合物,其离子化程度的不同而使其发生变化。
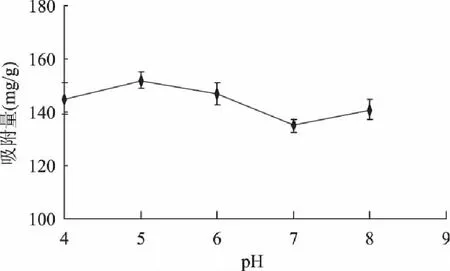
图4 不同pH条件下的吸附量 Fig. 4 Effect of different pH on adsorption capacity
2.2.2 不同酶解物浓度对吸附性能的影响 由图5我们可以看出,随着底物浓度的增加,大孔树脂对大豆肽的吸附量增加,大豆肽的底物浓度为60mg/mL时,树脂具有很好的吸附特性。在树脂吸附的同时也伴随着肽含量的损失,为了减少肽含量的损失,综合考虑,本实验选则浓度为60mg/mL的大豆肽进行吸附解析。
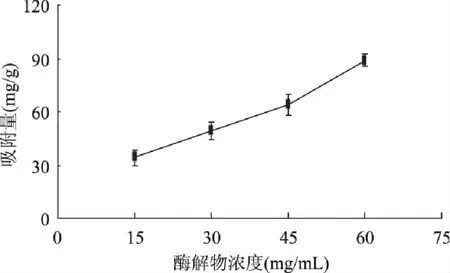
图5 不同大豆肽浓度的吸附量 Fig.5 Effect of diffent soybean peptide concentrations on adsorption capacity
2.2.3 优化条件下的吸附解析特性 在最优条件(pH4.5、底物浓度为60mg/mL)下,大孔树脂对酶解大豆肽的吸附解吸特性见图6。由图6可知,在吸附量较为接近的情况下,乙醇浓度为75%时,具有较好的解析率,解析率为85.5%。 通过条件的优化使得DA201-C大孔树脂的吸附率有所增加,减少了多肽含量的损失,为下一步实验奠定基础。

图6 优化条件下的吸附解吸情况 Fig.6 Effect of adsorption and desorption on the optimum condition
2.3 DA201-C大孔吸附树脂对酶解液的动态解析特性的影响
由图7看出,75%的乙醇在3h内能将大部分肽洗脱下来,在洗脱1h左右出现洗脱峰,在洗脱1.5~2h时洗脱曲线逐渐趋于平缓,肽的洗脱速率缓慢下降,可能由于一些相对分子质量较大的组分在75%的乙醇中溶解度较低不易被洗脱下来的缘故。洗脱下来的组分脱盐率达到93.23%,肽回收率为88.5%。
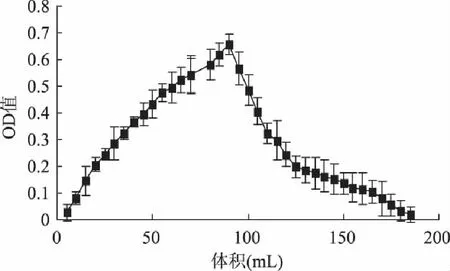
图7 DA201-C大孔吸附树脂 对大豆肽的动态解析特性曲线 Fig.7 Dynamic desorption curve of soybean peptides from DA201-C macroporous resins
3 结论
DA201-C、AB-8、D3520、D4006、NAX-Ⅱ5种大孔吸附树脂初步筛选,得出DA201-C大孔树脂吸附解吸效果最好,并确定其最佳条件为pH4.5,底物浓度为60mg/mL,洗脱剂为75%的乙醇,脱盐率和肽回收率都较高。大孔吸附树脂脱盐可以作为一种行之有效的方法,其操作简便、价格便宜、易于再生、减少生产成本,并对产品进行了初步的分离,为进一步的分离纯化和生物功能的检测奠定基础。
[1]雷鸣,李志忠. 大豆多肽制备中蛋白酶的选择[J]. 甘肃农业大学学报,2006,41(4):122-126.
[2]王莉娟. 大豆肽体外抗氧化活性研究[J]. 生物加工过程,2008,6(04):69-71.
[3]Dilshat Yimit M D. Effects of soybean peptide on immune function,brain function,and neurochemistry in healthy volunteers[J]. Nutrition,2012,28(2):154-159.
[4]Adler-nissen J. Enzymic hydrolysis of food proteins[M]. New York:Elsevier Applied Science Publisers,1986:122-123.
[5]Tang zhigang,Zhou Rongqi. Adsorption and desorption behaviour of taurine on macroporous adsorption resins[J]. Journal of Chemical Technology and Biotechnology,2001,76:752-756.
[6]陈季旺,孙勤. 鱼降压肽的大孔吸附树脂脱盐及理化性质[J]. 食品科学,2009,30(24):158-161.
[7]潘道东,林璐.DA201-C大孔吸附树脂静态吸附ACE抑制肽的研究[J]. 食品科学,2009,30(5):20-23.
[8]邓劲光,胡熙恩. 大孔吸附树脂对氢化可的松的吸附与洗脱性能研究[J].离子交换与吸附,2000,16(2):134-139.
[9]程云辉,许时婴. 大孔吸附树脂对麦胚肽的吸附特性研究[J]. 食品与机械,2005,21(6):7-12.
[10]MC Márquez. pH-Stat method to evaluate the heat inactivation of subtilis inhibitor in legumes[J]. Chem Biochem Eng Q,2002,16(1):31-35.
[11]卢蓉蓉,王新宝. 大孔吸附树脂对乳铁蛋白抗菌肽脱盐作用的研究[J]. 食品工业科技,2008,29(6):91-94.
[12]GB11896-89.铬酸钾指示剂法测定氯离子[S].
[13]赵一明,王璋. 大孔吸附树脂对酪蛋白非磷肽脱盐效果的研究[J]. 食品与发酵工业,2007,30(11):22-25.
[14]聂仁强,钱孟,冉启文. 大孔树脂在中药提取工艺中的应用[J]. 基层中药杂志,2002,16(6):59-60.
[15]Mishra A K,Ahluwalia J C. Alcohol induced conformational transitions of proteins and polypeptides[J]. International Journal of Peptide and Protein Research,1983,21(3):322-330.
[16]张晓梅. 降血压和降胆固醇醇大豆肽的分离纯化[D]. 无锡:江南大学,2006.

