125I测定低水平P-选择素平面位点密度新方法
凌颖琛,李趣欢,黄 冰,张金赫,方 颖
(1.华南理工大学 生物科学与工程学院,广东 广州 510006;2.广州军区广州总医院 核医学科,广东 广州 510010)
在感染部位或毒性刺激下,血液中的循环白细胞黏附在内皮细胞表面并迁移进入内皮下组织,从而实现杀灭病原体及组织修复的作用[1]。P-选择素为选择素家族中的一员,它通过与配体PSGL-1(P-selectin glycoprotein ligand)的相互作用,介导白细胞的初始拴缚(tether)和随后的滚动粘附(rolling)过程[2]。通常,人们利用平行平板流动腔(parallel plate flow chamber,PPFC)实验来体外模拟循环白细胞黏附,并测定黏附分子间的二维反应动力学参数[3-5]。在流动腔实验中,细胞流经铺有一定密度的P-选择素底板,并与之发生相互作用。二维逆反应速率可通过初始拴缚实验直接测量单分子键的生存时间(lifetime)而得到;分子间的正反应速率与受体、配体的浓度、细胞接触面积、分子扩散等因素相关[5-6]。因此,准确测定流动腔底部P-选择素的位点密度,是在分子水平上采用流动腔实验系统研究选择素介导的细胞黏附事件的关键的第一步。
1 放射性标记法与SPECT简介
通过荧光或125I放射性标记的方法,可获得细胞表面PSGL-1的位点密度。已有文献报道了白细胞和HL-60细胞表面的PSGL-1分子个数分别为11 000±2 000和18 000±2 000[7],其位点密度分别为49 sities/μm2和36 sites/μm2。然而,P-选择素铺于流动腔底部平面的玻璃板上,单黏附分子键介导的瞬时黏附实验要求位点密度小于10 sites/μm2[8],以致荧光检测方法的灵敏度难以满足实验要求;虽然125I放射性标记的敏感度较高,但传统的计数器一般只用于探测独立试管中溶液的放射量,而非一个平面或盖玻片上的放射量。
Infinia Hawkeye 4 ECT是一款多功能核素成像设备,它能执行单光子发射计算机断层扫描(single photon emisson computer Tomography,SPECT),是集SPECT/PET/CT三位一体的多功能分子影像设备,能完成100%的SPECT和90%的PET/CT功能,可进行影像的ECT和CT同机融合定位以及全能量范围核素衰减校正等功能[9],而且它还可同时对不同浓度的多个样品进行检测,大大缩短检测所需时间。因此,在本研究中,采用125I放射性标记方法,利用SPECT仪器,对平面吸附的P-选择素进行位点密度测定。通过对物理吸附于玻璃及聚苯乙烯(Polystyrene,PS)的P-选择素的位点密度进行测定,发现P-选择素的位点密度与吸附浓度呈线性关系,在玻璃上的吸附效率略高于聚苯乙烯;普通物理吸附后的P-选择素的方向是随机的,只有大约10%的P-选择素呈现易于与细胞表面PSGL-1结合的朝向,即结合位点暴露的头部向上。
2 材料与方法
2.1 IODOGEN法标记蛋白
实验中用于标记的蛋白有人类P-选择素/Fc嵌合体和鼠抗人P-选择素单克隆抗体9E1,均购自R&D system Inc,MN。进行碘化反应时,将40 ~ 150 μg蛋白(按150 kDa的IgG分量计算,106 kDa的P-选择素嵌合体则为30~100 μg)溶解在100 μL的Tris缓冲液(25 mmol Tris-HCl,pH 7.5,0.4 mol NaCl)中,置于带盖的EP管中。在pierce pre-coated iodination tube(购自Thermo Fisher Scientific Inc,IL)中加入1 mL的Tris缓冲液,润湿后倒掉,之后将100 μL高浓度Tris缓冲液(0.125 mol Tris-HCl,pH 6.8,0.15 mol NaCl)直接加入Iodination Tube的底部,并防止让溶液接触试管管壁。在通风橱中,将10 μL(1.0 μCi)的Na125I加入到iodination tube中,室温活化6 min,每30 s旋转试管1次。将活化后的碘化物加入到蛋白溶液中,室温反应6~9 min,每30 s轻轻晃动试管1次。最后,加入50 μL终止反应溶液(含10 g/L酪氨酸的Tris缓冲液,pH 7.4),混合并孵育5 min,在1 min和4 min时轻轻晃动试管1次。
2.2 标记蛋白纯化
实验前,用20 mL的Tris缓冲液对10 mL葡聚糖凝胶G-25填充的层析柱进行冲洗和平衡。将碘化反应的产物加入层析柱中,用Tris缓冲液对层析柱进行洗脱,每0.5~0.8 mL收集1管,共收集25管。用Infinia Hawkeye 4 ECT和Pierce BCA蛋白定量试剂盒(thermo fisher scientific inc,IL)分别测定放射量和蛋白量的比值。
2.3 测定P-选择素吸附的位点密度
研究中使用的吸附表面有聚苯乙烯(PS)和玻璃两种,其中以Costar 48-孔板(corning inc,NY)作为PS吸附材料,将玻璃盖玻片用玻璃胶固定在6-孔板内作为玻璃吸附材料。在2 mm厚的硅胶垫上裁剪8 mm×8 mm的正方形孔洞,让其紧贴在玻璃盖玻片上作为P-选择素吸附的区域。将130 μL(48-孔板)或102 μL(6-孔板)不同浓度的P-选择素或125I标记的P-选择素加入到吸附材料中,4 ℃下孵育16 h。将溶液吸出后,用含1%的牛血清白蛋白(BSA)的Hank’s平衡盐溶液(HBSS)洗3次,再加入1%的BSA HBSS,室温下孵育1 h。若吸附的是带标记的P-选择素,此时用SPECT进行放射性检测。若吸附的不是带标记的P-选择素,应将溶液吸出,再加入125I标记的P-选择素抗体,室温下孵育30 min。最后将溶液吸出,用1%的BSA HBSS洗3次,加入1%的BSA HBSS防止干燥,用SPECT进行放射性检测。若吸附材料为玻璃时,SPECT检测前需先将硅胶垫圈取出,防止结果受到硅胶吸附的影响。
2.4 SPECT放射性检测
将样品放置在GE Infinia Hawkeye 4的检测平台上对125I进行放射性检测。标记蛋白的层析样品检测时间一般为10 min,位点密度的检测时间按实际样品的放射量调整,约20~30 min。样品检测完毕后,对每个样品孔的放射量用配套软件进行具体分析。
3 结果
3.1 P-选择素和P-选择素抗体分子的标记
利用Iodogen法对人类P-选择素分子及鼠抗人P-选择素抗体9E1进行125I放射性标记,之后通过葡聚糖凝胶G-25层析获得标记蛋白洗脱液。图1(a)和图2(a)分别为SPECT上显示的检测图像,25管层析洗脱液按顺序放置在检测平台上,灰度代表放射性,颜色越深即代表放射性越强,每管所对应的放射性计数如图1(b)和图2(b)所示,图中横坐标为管编号(洗脱顺序)。两种样品的洗脱都大致呈现了2个峰,第1个峰为蛋白峰,大致在3~5号试管间,此后放射性大大减弱,之后又呈现一个比较宽而平缓的峰,为游离峰。2个峰之间的分界线比较明显,说明蛋白和游离125I的分离是比较成功的,标记蛋白的纯度较高。另一方面,第1个峰的峰值远高于第2个峰,说明了蛋白的标记是比较成功的,大部分的125I已经标记到目标蛋白上,只有少量的125I呈游离状态。
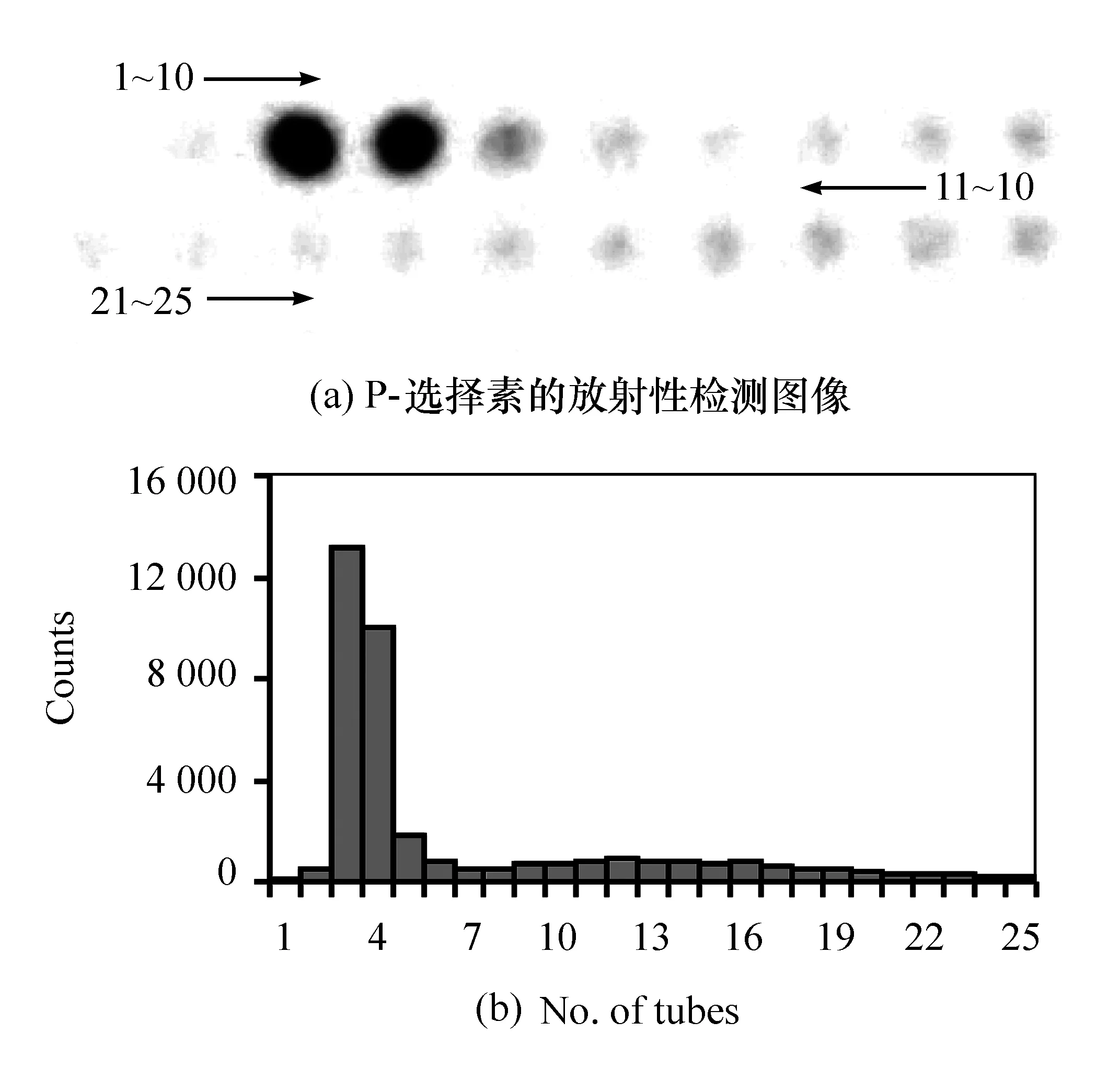
图1 葡聚糖凝胶G-25层析分离纯化125I标记P-选择素
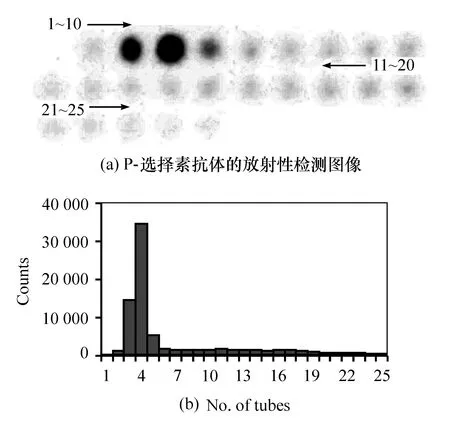
图2 葡聚糖凝胶G-25层析分离纯化P-选择素抗体
3.2 P-选择素分子在玻璃和PS上的吸附
为了对P-选择素进行标准化定量,需对收集纯化后的标记蛋白其进行蛋白定量,并计算出每个蛋白分子每秒的放射性计数。在实验中,我们收集到125I标记的P-选择素共5 mL,每秒钟的总放射量计数为63.61。利用Pierce BCA蛋白微量定量试剂盒测得其蛋白质量浓度为1.003 mg/L,按照P-选择素/Fc嵌合体分子量为106 kDa进行计算,纯化所得的每个125I标记的P-选择素分子每秒钟的放射性计数为2.23×10-12。
将125I标记P-选择素进行梯度稀释后,分别滴加到面积为8 mm×8 mm的玻璃上,4 ℃下吸附16 h。用含1%的BSA的HBSS清洗3次后在SPECT上进行放射性检测。图3(a)中显示的是SPECT检测20 min后的放射性计数图片,可看到随着P-选择素质量浓度的增加,125I标记P-选择素的吸附量也随之增加,放射性计数与P-选择素质量浓度之间呈线性关系(见图3(b))。在流动腔实验当中,HL-60细胞在P-选择素上进行初始拴缚(tether)和stop-go简单两步滚动(rolling)的P-选择素吸附浓度分别为30 μg/L和500 μg/L。根据P-选择素溶液浓度与位点密度(见图3(e))的关系,可计算出HL-60细胞初始黏附的P-选择素的位点密度为99 sites/μm2,而HL-60细胞两步滚动的位点密度则为1 662 sites/μm2。
图4为测得的P-选择素分子在PS材质上吸附结果。对应于细胞初始拴缚和滚动黏附的P-选择素质量浓度,其位点密度分别为69 sites/μm2和1140 sites/μm2,二者均低于P-选择素在玻璃材质上的吸附密度。二因素方差分析表明,这种影响十分显著(P=0.000 3≪0.01),即P-选择素分子在玻璃上的吸附要优于在PS材质上的吸附。
3.3 125I标记的P-选择素抗体分子检测P-选择素的吸附
已经知道P-选择素与其主要配体PSGL-1结合的部位位于N-端头部的lectin结构域上[10]。而在流动腔实验当中,需要根据有效的P-选择素位点密度来对分子反应动力学参数进行计算。由于普通的物理吸附的随机性,P-选择素并非均能呈现易于与其配体分子结合的朝向,而只有那些头部结合位点曝露、能与配体发生相互作用的分子才是真正需要考察的对象。然而,以上实验结果测定的是直接标记P-选择素所得的位点密度,即位点密度当中包含了各种朝向的P-选择素。为了获得有效P-选择素的位点密度,我们对P-选择素胞外区单克隆抗体9E1进行125I标记,然后使标记抗体与预先物理黏附在玻璃底板上的P-选择素结合,显然只有结合位点曝露在外的P-选择素才能与标记抗体结合,因此,最后测定的是有效P-选择素的位点密度。
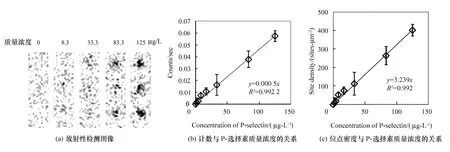
图3 P-选择素在玻璃上的吸附结果

图4 P-选择素在PS上的吸附结果
用Iodogen法对9E1进行125I标记,收集纯化后的标记蛋白并对其进行蛋白定量。在实验中,收集到125I标记的9E1共6.2 mL,每秒钟的总放射量计数为138.53。利用Pierce BCA蛋白定量试剂盒测得其蛋白浓度为16.625 mg/L,按照IgG分子量为150 kDa进行计算,纯化所得的每个125I标记的9E1分子每秒钟的放射性计数为2.07 × 10-12。
将不同浓度(0~1 μg/L)的P-选择素分别滴加到面积为8 mm×8 mm的玻璃片上,4 ℃下吸附16 h。用含1%的BSA的HBSS洗3次后,加入125I标记的单克隆抗体9E1,室温下孵育30 min。将溶液吸出,再用1%的BSA HBSS洗3次,用SPECT进行放射性检测,结果见图5。由图5(a)(25 min后的放射性计数图片)可知,随着P-选择素质量浓度的增加,125I-9E1的结合量也随之增加,P-选择素质量浓度与放射量、位点密度之间均为线性递增关系(见图5(b)、5(c))。介导HL-60细胞初始拴缚(30 μg/L)和滚动黏附(500 μg/L)的P-选择素浓度对应的位点密度分别为9 sites/μm2和148 sites/μm2。这2个值都远低于直接标记P-选择素所测得的位点密度(99 sites/μm2和1662 sites/μm2)。已有文献利用CRD序列的特异性抗体和荧光检测相结合的方法对不同吸附方式的P-选择素位点密度进行测定,发现位点密度的结果与P-选择素吸附后的分子朝向有密切联系[11]。因而,以上测定的实验结果说明了通过物理吸附吸附在载玻片上的P-选择素的方向是随机分布的,且头部位点暴露的P-选择素只为全部P-选择素的十分之一左右。
4 结束语

图5通过抗体结合测定P-选择素在玻璃上吸附结果
流动腔实验当中,准确测定底板上蛋白分子的位点密度是进一步通过模型计算其二维反应动力学参数的前提和重要保障。例如,通过平行平板流动腔实验测定HL-60细胞表面的PSGL-1与流动腔底板P-选择素之间的正反应速率就必须用到分子位点密度的数据。
综上所述,通过125I标记与SPECT检测相结合的方法测定平面内蛋白分子的位点密度是切实可行的新方法,对比传统的计数器检测方法可以更为快速直观的获得数据,且弥补了其不能测量平面的缺陷。新方法所测量的数据能够与平行平板流动腔实验相结合测得二维分子动力学的一系列参数,这将会为炎症、血栓等与细胞黏附相关疾病机理的明晰提供一定的帮助。
[1] McEver R P.P-selectin and PSGL-1:exploiting connections between inflammation and venous thrombosis[J].Thromb Haemost,2002,87(3):364-365.
[2] Ley K,Bullard D C,Arbones M L,et al.Sequential contribution of L-and P-selectin to leukocyte rolling in vivo[J].J Exp Med,1995,181(2):669-675.
[3] Li Q,Fang Y,Ding X,et al.Force-dependent bond dissociation govern rolling of HL-60 cells through E-selectin[J].Exp Cell Res,2012,318(14):1649-1658.
[4] Mehta P,Cummings R D,McEver R P.Affinity and kinetic analysis of P-selectin binding to P-selectin glycoprotein ligand-1[J].J Biol Chem,1998,273(49):32506-32513.
[5] Huang J,Chen J,Chesla S E,et al.Quantifying the effects of molecular orientation and length on two-dimensional receptor-ligand binding kinetics[J].J Biol Chem,2004,279(43):44915-44923.
[6] Thoumine O,Kocian P,Kottelat A,et al.Short-term binding of fibroblasts to fibronectin:optical tweezers experiments and probabilistic analysis[J].Eur Biophys J,2000,29(6):398-408.
[7] Skinner M P,Lucas C M,Burns GF,et al.GMP-140 binding to neutrophils is inhibited by sulfated glycans[J].J Biol Chem,1991,266(9):5371-5374.
[8] Alon R,Hammer D A,Springer T A.Lifetime of the P-selectin-carbohydrate bond and its response to tensile force in hydrodynamic flow[J].Nature,1995,374(6522):539-542.
[9] 黄熙.GE Infinia VC Hawkeye 的原理简介及维修实例[J].医疗卫生装备,2011,32(8):137-138.
[10] Ushiyama S,Laue T M,Moore K L,et al.Structureal and functional characterization of monomerica soluble P-selectin and comparison with membrane P-selectin[J].J Biol Chem,1993,268(20):15229-15237.
[11] Lee D,King M R.Microcontact printing of P-selectin increases the rate of neutrophil recruitment under shear flow[J].Biotechnol Prog,2008,24(5):1052-1059.

