注射用新藤黄酸包合物在大鼠体内药物代谢动力学研究
胡海霞, 王效山
(安徽中医药大学药学院, 安徽 合肥 230031)
注射用新藤黄酸包合物在大鼠体内药物代谢动力学研究
胡海霞, 王效山
(安徽中医药大学药学院, 安徽 合肥 230031)
目的 考察大鼠注射新藤黄酸包合物后的药动学行为。方法 两组大鼠分别单次注射新藤黄酸包合物 (受试样品) 及新藤黄酸 (参比样品), HPLC法测定不同时间的血药浓度, 采用 3p97 药动学软件拟合药动学参数。 结果 受试样品中新藤黄酸的 C0, T1/2, AUC0-80分别为 (1 502.2 ±283.8) mg/L、 ( 1.76 ±0.84) min、 ( 3 815.2 ±1 468.2)( mg/L·min) ; 参比 样 品 中 新 藤 黄 酸 的 C0, T1/2, AUC0-80分 别 为 ( 346.6 ±64.7 ) mg/L、 ( 2.32 ±1.16 ) min、(1 160.1 ±380.2) (mg/L·min)。 结论 注射新藤黄酸后大鼠血浆药时曲线符合一室模型。 建立的测定方法适用于体内新藤黄酸的定量测定及药动学研究。
药物代谢动力学;新藤黄酸包合物;高效液相色谱法
新藤黄酸 ( gambogenic acid, GNA) 是从中药藤黄中提取的抗肿瘤有效成分之一,体内外药理实验结果表明新藤黄酸有广谱抗肿瘤活性,高效低毒, 有望开发成优良的抗肿瘤药[1~3]。 新藤黄酸临床前研究中发现其冻干粉针有注射刺激性,为此本课题组制备了新藤黄酸 /羟丙基-β-环糊精 (新藤黄酸 /HP-β-CD) 包合物, 以改善其用药刺激性, 为新藤黄酸的临床应用提供更好的实验基础[4]。 为了评估新藤黄酸 /HP-β-CD包合物冻干粉针剂的临床应用前景,本实验采用 HPLC法测定了大鼠单次尾静脉注射包合物后血浆中的新藤黄酸,并应用药动学统计软件拟合了新藤黄酸/HP-β-CD包合物在大鼠体内的药动学过程并与新藤黄酸未包合制剂进行了比较[5-8]。
1 仪器、 试剂和实验动物
1.1 仪器 LC-20AB高效液相色谱仪, (日本岛津) 包括 SPD-M20A 紫外检测 器; KQ-300B超声清洗机 (昆山市超声仪器有限公司);AB135 电子天平 ( 德 国 METTLER TOLEDO公司); LC-4016型低速离心机 (安徽中科中佳仪器有限公司);XW-80A微型涡旋混合器 (上海沪西分析仪器厂有限公司); Anke TGL-16GB高速离心机 (上海安亭科学仪器厂)。
1.2 药品与试剂 新藤黄酸 (批号为 20120203,纯度94.8%)、 注射用新藤黄酸冻干粉针 (批号为20130209, 规格: 15 mg/支)、 注射用新藤黄酸包合物 冻 干 粉 针 ( 批 号 为 20130416, 规 格: 15 mg/支)、 新藤黄酸对照品 (批号为 20120408, 纯度 99.7%)、内标藤黄酸 (批号为 20121123, 纯度97.1%) 均由安徽中医药大学现代中药安徽省重点实验室提供; HPLC所用试剂均为色谱纯; 其他试剂均为分析纯。
1.3 动物及给药方式 SPF级 SD大鼠, 雌性,体质量 200 ~250 g, 由安徽医科大学实验动物中心提供,所有动物于本实验前禁食,自由饮水,室温(20 ±2) ℃。 实验采用单次尾静脉给药方式, 给药剂量为 2 mg/kg, 给药体积为 2 mL/kg,给药质量浓度为1 mg/mL。
2 方法与结果
2.1 色谱条件[9]Hypersil ODS2 C18色谱柱 (250 mm×4.6 mm,5 μm); C18保护柱 (10 mm×4.6 mm, 5 μm); 流动相为甲醇-0.1%磷酸水 (90 ∶10, V/V); 体积流量为 1.0 mL/min; 检测波长 358 nm; 柱温 25 ℃。
2.2 对照品溶液及内标溶液配制
2.2.1 对照品溶液的制备 取新藤黄酸对照品 10 mg, 精密称定, 置于 50 mL量瓶中用甲醇溶解并稀释至刻度,将对照品贮备液用甲醇稀释成质量浓度为 1.00、5.00、10.00、20.00、 50.00、 100.00 μg/mL的溶液备用。
2.2.2 内标溶液的制备 取藤黄酸 5 mg, 精密称定, 置于50 mL量瓶中用甲醇溶解并稀释至刻度,配置成质量浓度为 100.00 μg/mL的内标溶液。
2.3 血浆样品预处理 取大鼠全血 3 500 r/min 离心 20 min 制备血浆, 用微量进样器吸取 0.2 mL,置离 心 管 中, 加 甲 醇 和 内 标 藤 黄 酸 ( gambogic acid,GA)漩涡混合, 12 000 r/min 离心 10 min,分离上清液, 经 0.45 μm微孔滤膜过滤, 进样 20 μL测定。
2.4 方法学的验证 取大鼠空白血浆 20 μL, 按“2.3”项方法, 将一定浓度的新藤黄酸标准溶液和内标溶液加入空白血浆中;取大鼠尾静脉注射给药后收集的全血, 同法操作。 按照 “2.1” 项下的色谱条件进样分析,结果显示,空白血浆中内源性物质不干扰新藤黄酸和内标的测定,新藤黄酸的保留时间为 8.6 min, 藤黄酸的保留时间为 12.3 min,见图1。

图1 新藤黄酸及内标的色谱图Fig.1 HPLC chromatograms for gambogenic acid(1) and dexamethasone gambogic acid(2) in rat plasma
2.5 标 准 曲 线 绘 制 取 大 鼠 空 白 血 浆 200 μL 6份, 分别加入配置好的对照品溶液 50 μL, 质量浓度依 次 为 1、 8、 16、 40、80、 160、 800 μg/mL,加 600 μL的 甲 醇, 40 μL内 标 溶 液, 涡 流 振 荡1 min, 3 500 r/min 离 心 20 min, 上 清 液 用 0.45 μm有机膜过滤,弃初滤液,取续滤液 20 μL进样, 进行 HPLC分析。 以新藤黄酸与内标物峰面积比 Ri为纵坐标, 新藤黄酸质量浓度为横坐标, 求得标准曲线的方程为 Y=0.002 6X (r2=0.999 6),结果显示的线性范围为 1 ~800 μg/mL, 定量下限为 1 μg/mL(S/N>10)。
2.6 精密度试验 取大鼠空白血浆 100 μL 3份,分别加入新藤黄酸对照品高、中、低3个质量浓度 (分别为 3.02、 1.53、 0.43 μg/m L) ,按 “2.4” 项下方法处理后, 1 d 内分别测 5 次,计算日内精密度, 每次取 20 μL进样,用样品峰面积与内标峰面积比 Ri代入标准曲线, 计算得到的相应浓度, 3 份样品的 RSD值分别为3.04%、 2.66%和 3.48%。 同样的方法, 连续测定 3 d, 该 3份样品的日间精密度分别为3.44%、 3.59%和 3.58%。
2.7 提取回收率试验[10]取 5 份 100 μL大鼠空白血浆制得的上清液, 分别加20 μL不同质量浓度的新藤黄酸系列标准溶液, 加入甲醇溶液 300 μL及20 μL内标溶液, 混匀后进样, 记录样品峰面积与内标峰面积比值 Ri, 用 Ri与稀释后的样品质量浓度作直线回归,得到对照品的回归方程;另取离心管加大鼠空白血浆 100 μL, 加入 20 μL的不同质量浓度的新藤黄酸对照品溶液 (分别为 3.02、1.53、 0.43 μg/m L), 每一质量浓度进行 6 样本分析。 加入甲醇溶液 300 μL及 20 μL内标溶液,漩涡 5 min, 3 000 r/min 离心 15 min; 取上清液过滤后进样, 将样品峰面积与内标峰面积比值 Ri代入对照品的回归方程,得到相应质量浓度求得血浆中新藤黄酸的提取回收率。提取回收率=测得质量浓度/加入质量浓度 ×100%, 结果见表 1。

表1 大鼠血浆中新藤黄酸及内标的平均提取回收率Tab.1 M ean recoveries of gam bogenic acid and gambogic acid in rat p lasm a
2.8 血样采集及测定 取健康成年 SD大鼠 12只,雌性,随机分成2组,分别一次性尾静脉注射新藤黄酸冻干粉针和新藤黄酸包合物冻干粉针,给药剂量为 2 mg/kg, 给药体积为 2 mL/kg, 给药质量浓度为 1 mg/mL。 分别于给药前和给药后 1、 2、5、 7、9、12、20、 40、 60、 80 min 从眼眶静脉取血0.4 mL, 置于肝素化离心管中, 每取 4 个血样,给予大鼠生理盐水灌胃,以保持血容量。按“2.2”项进行血浆处理, 进样分析, 计算出各时间点血浆中的新藤黄酸的质量浓度。
2.9 参数分析 用 3p97 软件进行新藤黄酸及新藤黄酸包合物在大鼠体内的药代动力学模型的拟合。结果表明,新藤黄酸和新藤黄酸包合物在大鼠体内的药物动力学规律均符合一室模型。主要药动学参数见表2, 平均药时曲线见图 2。
3 讨论
本实验以甲醇-0.1%磷酸水 (90 ∶10,V/V)、检测波长 358 nm、 柱温 20 ℃测定大鼠血浆中新藤黄酸的质量浓度,新藤黄酸和内标的保留时间分别是 8.6 min 和 12.3 min, 本法具有分离度好、 保留时间合适等优点,可以为检测生物样品中的新藤黄酸含量提供参考。
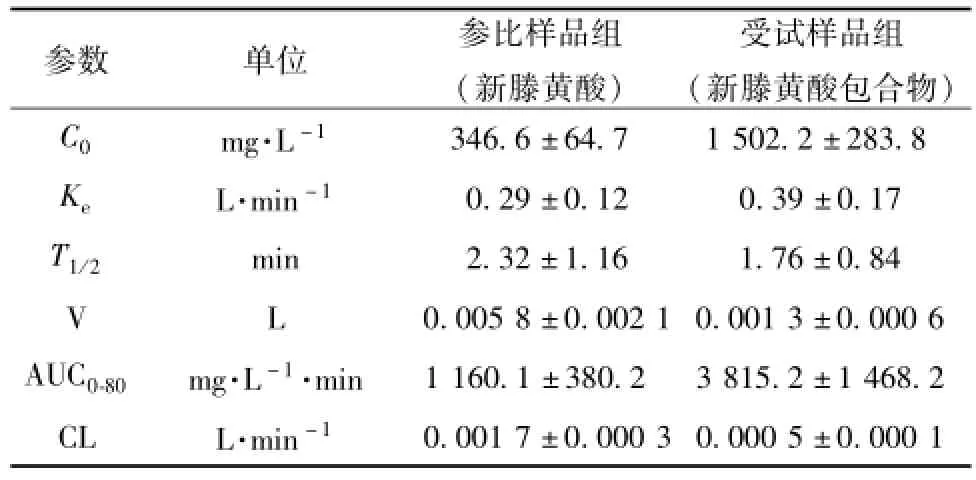
表2 单剂量注射新藤黄酸和新藤黄酸包合物后主要药动学参数Tab.2 Pharmacokinetic param eters of gambogenic acid after i.v.adm inistration of single dose of gambogenic acid and gambogenic acid inclusion com p lex
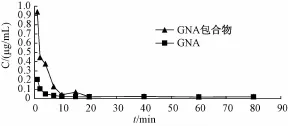
图 2 两组大鼠给药后体内新藤黄酸的平均血药浓度-时间曲线Fig.2 Cure of p lasma concentration and time of gambogenic acid and gambogenic acid inclusion in rats
实验数据表明新藤黄酸和新藤黄酸包合物在大鼠体内的药物动力学规律均符合一室模型,新藤黄酸在大鼠体内代谢迅速,新藤黄酸经包合后在一定程度上减慢了代谢。 经配对 t检验, 受试样品和参比样 品 的 C0和 AUC0-80均 有 显 著 性 差 异 ( P<0.05), 表明包合物与原料药在大鼠体内为生物不等效制剂。注射部位的生理切片观察发现包合物制剂没有注射刺激性。
[ 1 ] 晏烽根, 李庆林.新藤黄酸诱导人鼻咽癌细胞 CNE-1 凋亡以及对 p-p38 和 p-ERK1/2 蛋白的影响[ J] .中国药理学通报, 2011, 27(3): 355-359.
[2] 杨 莉,王 梅,程 卉,等.新藤黄酸诱导细胞凋亡抑制 A549 细胞裸鼠移植瘤增长的研究[J].中国中药杂志,2011, 36(9): 1217-1221.
[ 3 ] Li Qinlin, Cheng Hui, Zhu Guoqi, et al.Gambogenic acidinhibits proliferation of A549 cells through apoptosis-inducing and cell cycle arresting[ J] .Biol Pharm Bull, 2010, 33(3):415-420.
[4] 胡海霞,王效山,彭代银,等.新藤黄酸包合物冻干粉针制备及工艺优化[J].中草药, 2012, 43(1): 65-69.
[ 5 ] 李贵海, 刘逢芹, 孙付军, 等.注射用羟丙基 β-环糊精-新鱼腥草钠冻干粉针 Beagle犬体内的药代动力学[J].中成药, 2007, 29(12): 1751-1754.
[6] 严春临,张 季,张丹参,等.大黄酚包合物在家兔体内药物代 谢 动 力 学 研 究 [ J].中 成 药, 2011, 33(12):2072-2075.
[7] 王周丽,贝永燕,朱爱军,等.蛇床子素β环糊精包合物分散片的制备及大鼠体内药动学研究[J].中成药, 2012,34(10): 1887-1892.
[8] 魏 红,张 振,牛晓方.苦参碱微乳经皮给药在小鼠体内的药动学及组织分布研究[J].中国药学杂志, 2010,45(24): 1939-1943.
[ 9 ] 胡海霞, 王效山.HPLC法测定新藤黄酸 /羟丙基-β-环糊精包合物冻干粉中新藤黄酸的含量[J].安徽中医学院学报,2011, 30(3): 55-57.
[10] 李 晰, 王庆伟, 梁 力, 等.HPLC法测定大鼠血浆中根皮素及其药物代谢动力学研究[J].中成药, 2013, 35(3): 487-490.
Pharm acokinetics of gam bogenic acid inclusion comp lex in rats
HU Hai-xia, WANG Xiao-shan
(Pharmaceutical Department of Anhui University of Traditional Chinese Medicine, Hefei230031, China)
pharmacokinetics; gambogenic acid inclusion complex; HPLC
R969.1
: A
: 1001-1528(2014)03-0503-04
10.3969/j.issn.1001-1528.2014.03.012
2013-06-15
“重大新药创制” 科技重大专项 (2009ZX09103-399); 安徽省高校优秀青年基金项目 (2012SQRL106)
胡海霞 (1977—) , 女, 硕士, 副教授, 研究方向: 制剂工艺。 Tel: 13966777656, E-mail: huhx6262@126.com

