抑制TUBA1C的过表达在卵巢癌细胞株CAOV3、SKOV3细胞增殖侵袭中的作用机制探讨
江若安 叶枫 王新宇
抑制TUBA1C的过表达在卵巢癌细胞株CAOV3、SKOV3细胞增殖侵袭中的作用机制探讨
江若安 叶枫 王新宇
目的探讨抑制α-微管蛋白特异性1c链(TUBA1C)过表达对卵巢癌细胞株CAOV3、SKOV3细胞增殖、侵袭的影响,初步阐明TUBA1C在上皮性卵巢癌中的作用机制。方法 通过脂质体介导抑制TUBA1C基因的过表达质粒转染CAOV3、SKOV3细胞,CAOV3分为3组:CAOV3实验组、CAOV3空载体转染组和CAOV3空白对照组;SKOV3分为3组:SKOV3实验组、SKOV3空载体转染组和SKOV3空白对照组。采用RT-PCR法检测TUBA1C表达;CCK-8法及Transwell小室体外侵袭实验评价TUBA1C基因抑制后对卵巢癌细胞增殖、侵袭的影响。结果 靶向TUBA1C基因的siRNA明显、特异性地抑制TUBA1C mRNA的表达水平;培养72h CAOV3实验组细胞增殖能力较空载体转染组和空白对照组明显降低,差异有统计学意义(P<0.05);侵袭实验结果提示SKOV3实验组穿膜细胞数量为(0.95±0.12)个/视野,较空载体转染组降低,差异有统计学意义(P<0.01),CAOV3实验组穿膜细胞数量为(1.13±0.14)个/视野,较空白对照组降低,但差异无统计学意义(P>0.05)。结论 抑制TUBA1C基因过表达可抑制CAOV3、SKOV3细胞的增殖、侵袭能力,有望成为卵巢癌治疗的新靶点。
TUBA1C 卵巢肿瘤 小分子干扰RNA 细胞增殖 肿瘤侵袭
卵巢癌是女性生殖系统三大恶性肿瘤之一,约90%为上皮性卵巢癌[1],其中75%的病例在初诊时已有腹腔内广泛转移。肿瘤侵袭和转移与细胞运动能力密切相关,而决定细胞运动力的是由微管、微丝等构成的细胞骨架。微管是由α-微管蛋白和β-微管蛋白聚集而成的二聚体。既往较多研究集中于β-微管蛋白,且注重于其与紫杉醇的耐药相关性上,而少有α-微管蛋白的研究。近来有研究发现α-微管蛋白在乳腺癌组织中较正常和癌前病变组织中表达显著升高,并与患者的生存率相关[2]。已有少量前沿文献提示α-微管蛋白在乳腺癌及肺癌等肿瘤中作用,鲜有α-微管蛋白与妇科肿瘤侵袭转移相关性的研究。我们的前期研究中已确认在上皮性浆液性卵巢癌的蛋白质组学中发现α-微管蛋白特异性1c链(TUBA1C)在浆液性卵巢癌中表达上调[3],因此认为TUBA1C与卵巢癌发生、发展、转移关系密切。本文在此基础上,运用RNA干扰技术,抑制卵巢癌细胞株CAOV3、SKOV3中的TUBA1C过表达,探讨TUBA1C在上皮性卵巢癌转移中的作用机制。
1 材料和方法
1.1 细胞分组 卵巢癌细胞株CAOV3分为3组:CAOV3实验组、CAOV3空载体转染组和CAOV3空白对照组。卵巢癌细胞株SKOV3分为3组:SKOV3实验组、SKOV3空载体转染组和SKOV3空白对照组。
1.2 主要试剂和仪器 (1)试剂材料:真核过表达及siRNA质粒由上海生博医学生物工程科技有限公司提供;1640培养基、胰蛋白酶、胎牛血清、Gibco及 Lipofectamine2000(trizol)由上海普飞生物公司提供;质粒提取试剂盒、PCR产物纯化试剂盒(Qiagen)、一抗、二抗(Santa Cruz Biotechnology)由上海吉泰生物有限公司提供;E.coli DH-5α由浙江省女性生殖健康研究重点实验室提供;2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐(CCK-8)由上海生工提供;Taq酶、dNTP、sybrgreen和逆转录酶(takara)由杭州浩嘉代理提供。(2)实验室仪器:蛋白电泳仪及Real time PCR仪(CFX96)由美国bio-rad公司制造;流式细胞仪由美国BD公司制造;分光光度计(nanodrop 1000)由美国Thermo Fisher Scientific公司制造;CO2培养箱(MCO-17AIC)由日本三洋公司制造;超低温冰箱由美国NBS公司制造;高速冷冻离心机(5817R)及常温离心机(5814)由美国eppendorf公司制造;倒置显微镜由日本Olimpus公司制造;纯水仪由美国Millipore公司制造。
1.3 实验步骤和方法
1.3.1 细胞培养及转染 卵巢癌CAOV3、SKOV3细胞常规培养于RPMI 1640培养基中,置于37℃、饱和湿度5%CO2孵箱中无菌培养。转染前24h种板,待细胞融合度达90%~95%进行转染。转染前1~2h弃掉培养基,加入2ml不含血清的opti-MEM培养基(不含双抗)混悬Lipofectamine 2000及siRNA,转染4~6h后换成含双抗和血清的RPMI 1640完全培养基继续孵育;转染24h后加入最适筛选浓度的G418,每3d更换1次含有G418的完全培养基。培养10d后,使用G418的维持浓度继续培养15d。转染后以RT-PCR检测转染效果。
1.3.2 CCK-8法检测TUBA1C基因对CAOV3、SKOV3细胞增殖的影响 分组同1.1,处理同1.3.1。转染成功后,分别于24、48和72h终止培养,加入CCK-8(5mg/ ml)10μl,继续孵育0.5~4h后吸尽孔内液体,在450nm测定吸光度,读取各孔光密度(D)值并计算增殖抑制率,最后绘制增殖曲线图。增殖抑制率(%)=(各空白对照组D值-相应实验组D值)/相应空白对照组D值×100%。
1.3.3 Transwell法检测CAOV3、SKOV3细胞侵袭 分组同1.1,处理同1.3.1。以Matrigel胶均匀平铺于Transwell小室的聚碳酸酯微孔膜上模拟人工基底膜。转染后6h消化,离心重悬细胞待用。将已处理的各组细胞悬液接种至Transwell小室内,将小室放入含趋化因子及培养液的24孔板,37℃、5%CO2条件下孵育24h后显微镜下观察膜下不同的5个高倍视野,计数穿膜细胞数。
1.4 统计学处理 采用SPSS 19.0统计软件,计量资料以示,组间比较进行方差分析,进一步两两比较采用t检验。
2 结果
2.1 RT-PCR检测TUBA1C基因抑制效率 见表1。
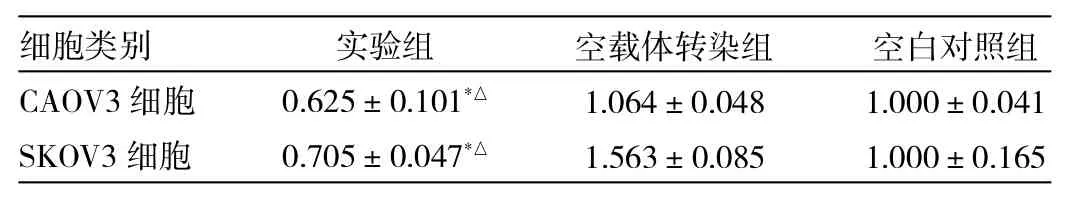
表1RT-PCR检测CAOV3、SKOV3中TUBA1C mRNA表达
TUBA1C基因干扰效率在CAOV3、SKOV3细胞中分别为58.8%及45.2%,CAOV3及SKOV3实验组基因表达分别与CAOV3、SKOV3空载体转染组及CAOV3、SKOV3空白对照组差异均有统计学意义(均P<0.05)。而空载体转染组和空白对照组相比,TUBA1C表达差异无统计学意义(P>0.05),可排除非特异性基因沉默。2.2 CCK-8法检测TUBA1C基因抑制后细胞增殖 见图1-2。
由图1可见,培养24h时CAOV3实验组细胞增殖率为0.180±0.003,CAOV3空载体转染组细胞增殖率为0.219±0.004,CAOV3空白对照组细胞增殖率为0.165± 0.002;培养48h时CAOV3实验组细胞增殖率为0.198± 0.002,CAOV3空载体转染组细胞增殖率为0.229±0.015,CAOV3空白对照组细胞增殖率为0.166±0.001;培养72h时CAOV3实验组细胞增殖率为0.208±0.011,而CAOV3空载体转染组及CAOV3空白对照组细胞增殖率分别为0.299±0.001及0.286±0.005,差异有统计学意义(P<0.05)。
由图2可见,培养24h时SKOV3实验组细胞增殖率为0.160±0.002,SKOV3空载体转染组细胞增殖率为0.163±0.005,SKOV3空白对照组细胞增殖率为0.168± 0.003;培养48h时SKOV3实验组细胞增殖率为0.203± 0.009,SKOV3空载体转染组细胞增殖率为 0.177± 0.002,SKOV3空白对照组细胞增殖率为0.181±0.001;培养72h时SKOV3实验组细胞增殖率为0.185±0.004,SKOV3空载体转染组细胞增殖率为 0.196±0.003,SKOV3空白对照组细胞增殖率为0.197±0.001。差异均无统计学意义(均P>0.05)。
2.3 Transwell小室体外侵袭实验检测TUBA1C基因抑制后各组细胞侵袭能力 见图3-4。
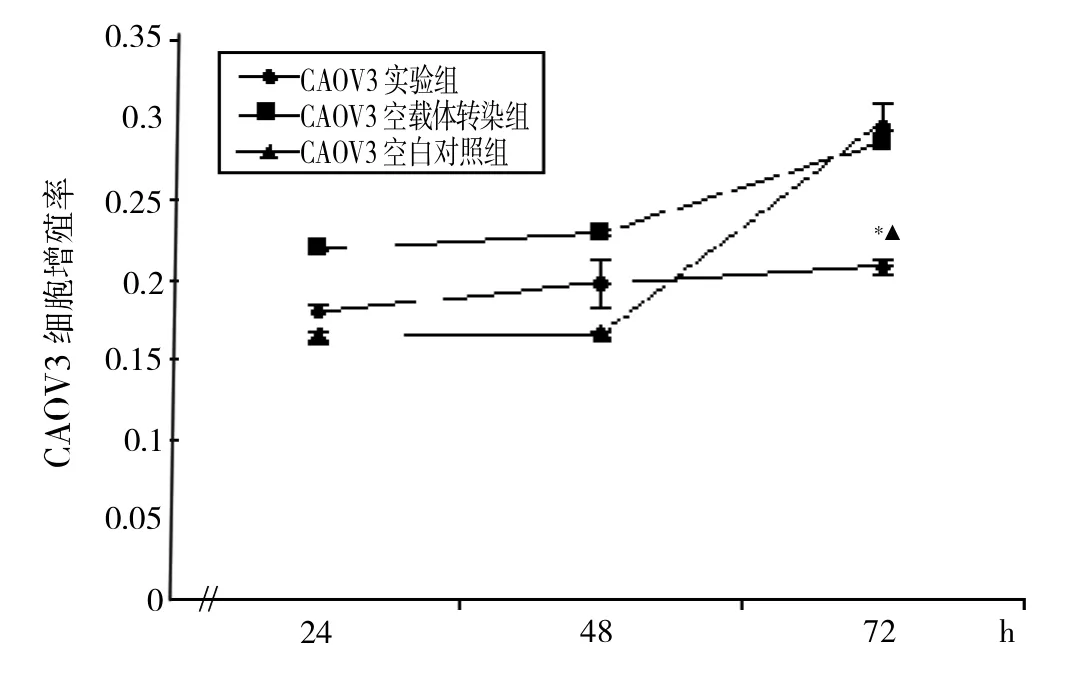
图1 TUBA1C抑制后CAOV3细胞增殖曲线(注:与空白对照组比较,*P<0.05;与空载体转染组比较,▲P<0.05)

图2 TUBA1C抑制后SKOV3细胞增殖曲线
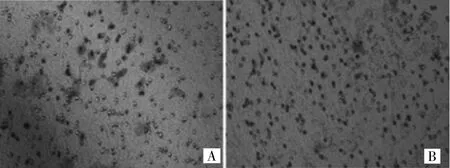
图3 Transwell侵袭小室检测 CAOV3细胞的侵袭能力(A:CAOV3空载体转染组;B:CAOV3实验组;HE染色,×200)
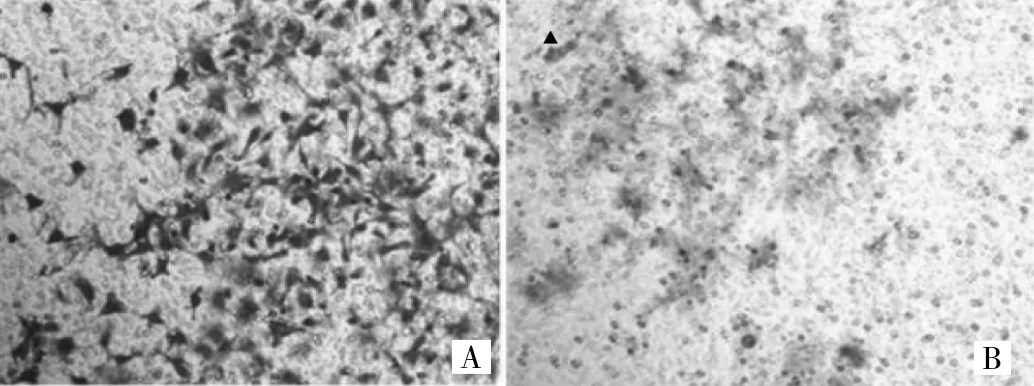
图4 Transwell侵袭小室检测 SKOV3细胞的侵袭能力(A:SKOV3空载体转染组;B:SKOV3实验组;HE染色,×200)
由图3可见,CAOV3实验组穿膜细胞数量为(1.13±0.14)个/视野,较CAOV3空载体转染组降低,但差异无统计学意义(P>0.05)。
由图4可见,SKOV3实验组穿膜细胞数量为(0.95±0.12)个/视野,较SKOV3空载体转染组降低,差异有统计学意义(P<0.01)。
3 讨论
对于微管蛋白的研究,既往较多研究集中于β-微管蛋白,发现多种肿瘤中β-微管蛋白的表达异常,并与抗肿瘤药物的耐受性有关。近年来逐渐有学者开始对α-微管蛋白在多种肿瘤发生机制进行研究。
应荣彪等[3]发现α、β-微管蛋白的表达在乳腺正常组织、乳腺非典型增生组织、乳腺导管内癌组织和浸润性癌组织中呈逐渐增高趋势,认为乳腺癌前病变中已有中心体α、β-微管蛋白的过表达,得出α、β-微管蛋白的过表达可能在促使细胞过度增殖恶性转化的过程中起到重要作用。陈清勇等[4]通过采用免疫组化及Western blot方法检测α-微管蛋白和多耐药基因1(MDR1)的在原发性非小细胞肺癌(NSCLC)中的表达,发现α-微管蛋白在Ⅰ~Ⅱ期与Ⅲ~Ⅳ期NSCLC中的阳性表达率差异有统计学意义(P<0.01),多因素生存分析认为α-微管蛋白(RR=3.287,P=0.006)可作为独立的预后指标,从而得出α-微管蛋白在肺癌的发生和恶性进展中有一定作用的结论。此外,吕玉宇等[5]通过探讨α、β、γ-微管蛋白在人鳞状上皮宫颈永生化细胞(H8细胞株)和癌细胞(Caski细胞株)的表达差异,发现α、β、γ-微管蛋白,Caski细胞中的表达量高于H8细胞,从而认为中心体α、β、γ-微管蛋白异常可能是宫颈癌细胞恶性表型的特征之一。
而对于TUBA1C的研究尚少,目前仅有少量文献报道其在骨肿瘤细胞中的相关研究。Li等[6]利用比较蛋白质组学分析法发现,与良性骨肿瘤相比,骨肉瘤组织有数个相关蛋白表达上调,其中就包括TUBA1C,表明这些被发现的蛋白包括TUBA1C在骨肉瘤的发生和治疗中可能是潜在的生物标记物,在骨肉瘤中异常表达的细胞骨架微管相关蛋白,通过影响微管的稳定性,影响肿瘤的浸润和转移,从而影响患者的预后。而Li等[7]首次报道在上皮性浆液性卵巢癌的蛋白质组学研究中发现TUBA1C在浆液性卵巢癌中表达上调,为研究TUBA1C在妇科肿瘤,特别是上皮性卵巢癌发生、发展过程中的机制开启了新的篇章。
肿瘤细胞运动能力增强可促进其穿过基底膜向邻近组织甚至远处转移,与肿瘤的恶性程度有关。本实验发现予TUBA1C抑制后,癌细胞株增殖及侵袭能力可能也受到影响,证实了TUBA1C的下调能降低卵巢癌细胞体外增殖能力及侵袭能力,抑制肿瘤细胞的恶性表型,TUBA1C有望成为卵巢癌抗肿瘤药物耐受、基因治疗的新靶点。
目前临床上对卵巢癌的诊治原则是早期发现,早期手术,辅以放化疗和综合支持治疗,晚期以改善患者的生存质量为首要目的。TUBA1C作为肿瘤转移机制的重要参与者,可以作为无损伤性肿瘤筛查的指标,在治疗方面,探讨TUBA1C与抗肿瘤药物之间的作用机制,从基因启动到信号转导途径进行干预,可能将有效地降低肿瘤的生物学恶性程度,延长患者的生存时间,提高其生存质量。
[1]Auersbergs N,Wong A S,Choi K C,et al.Ovarian surface epithelium:biology,endocrinology,andpathology[J].EndocrRev,2001, 22(2):255-288.
[2]Niu Y,Liu T,Tse G M,et al.Increased expression of centrosomal alpha,gamma-tubulin in atypical ductal hyperplasia and carcinoma of the breast[J].Cancer Sci,2009,100(4):580-587.
[3]应荣彪,冯俊,李建军,等.α、β-微管蛋白在乳腺癌变不同阶段的表达及意义[J].中国癌症杂志,2011,21(8):595-598.
[4]陈清勇,江中勇,吴丽君,等.α-微管蛋白和多药耐药基因1表达与肺癌生物学特性的相关性[J].中华肿瘤杂志,2010,32(4):278-282.
[5]吕玉宇,赵涌,巫静娴,等.宫颈永生化细胞和癌细胞的α、β、γ-微管蛋白比较分析[J].重庆医科大学学报,2008,33(12):1471-1474.
[6]Li Y,Liang Q,Wen Y Q,et al.Comparative proteomics analysis of human osteosarcomas and benign tumor of bone[J].Cancer Genet Cytogenet,2010,198(2):97-106.
[7]Li Y L,Ye F,Hu Y,et al.Identification of suitable reference genes for gene expression studies of human serous ovarian cancer by real-time polymerase chain reaction[J].Anal Biochem,2010,394 (1):110-116.
Silencing over-expression of TUBA1C inhibits proliferation and invasion of human ovarian carcinoma CAOV3,SKOV3 cells
ObjectiveTo investigate the effect of silencing the over-expression of alpha-tubulin specific 1c chain(TUBA1C)gene on the proliferation and invasion of human ovarian carcinoma CAOV3 and SKOV3 cells. Methods TUBAIC sequencing-targeting siRNA was transfected into human ovarian carcinoma CAOV3 and SKOV3 cells.The expressions of TUBAICmRNA was examined by RT-PCR,the proliferation and invasion ability of CAOV3 and SKOV3 cells were evaluated by CCK-8 assay and Transwell assay,respectively.Results The TUBA1C sequence-specific siRNA effectively and specifically down-regulated the expression of TUBA1CmRNA.The CCK-8 results showed that the proliferation of cultured CAOV3 cells in experimental was significantly inhibited compared with those in control and negative transfection groups(P<0.05).The penetrating capacity of SKOV3 cells in the experimental group(0.95±0.12 cells/field)was significantly inhibited compared with those in the negative group(P<0.01);however there was no significant differnce in CAOV3 cells between experimental group and negative group.Conclusion Silencing TUBA1C can effectively inhibit the proliferation and invasion of human ovarian carcinoma CAOV3 and SKOV3 cells,suggesting TUBA1C gene may be a potential new target for treatment of ovarian carcinoma.
TUBA1C Ovarian tumors Small interfering RNA Cell proliferation Neoplasm invasiveness

2013-05-20)
(本文编辑:杨丽)
浙江省卫生厅一般项目(2010KYA127)
310009 杭州,浙江大学医学院附属妇产科医院肿瘤科
王新宇,E-mail:Wangxy@zju.edu.cn
——水芹主要害虫识别与为害症状

