湖南民间酒酿中酵母菌多样性的研究
闫华文,陈 璐,姚淑敏*
(曲阜师范大学生命科学学院,山东 曲阜 273165)
酒酿(sweet ferment rice)为江、浙、沪一带的“白糟”,可习惯上称为“香糟”,其味甘、性温,可益气、生津、活血、散结、消肿[1]。酒酿富含碳水化合物、蛋白质、B族维生素、矿物质等人体必需的营养成分[2],具有健身、暖胃、维持肠道菌种平衡、美容等功效。其中B族维生素有促进乳汁分泌的作用,而少量的酒精具有促进血液循环,有助消化及增进食欲的功能[3]。酒酿种类繁多,其制作过程大致相同,都需要添加一种发酵剂,即酒曲。
近年来,随着人们对酒酿的认识的提高,在不同的地区都有了酒酿的制作,并且各大商场都有销售,即酒酿的制作有工业化的趋势。但因传统制酒酿条件简单,受环境影响很大,不同地区制得的酒酿营养成分、微生物的组成也有所不同,这样无法保证酒酿品质的稳定性,也无法保证酒酿中有效微生物的组成和数量,甚至可能含有害微生物[4],从而导致酒酿制造过程的不可控性和质量的不稳定性。酵母菌包括酿酒酵母和非酿酒酵母[5],是酒酿中主要的功能微生物之一。酒酿中酵母菌组成的研究,对提高酒酿的质量及进一步弄清其对酒酿品质的影响有重要意义。
酵母菌的常规鉴定主要依赖于形态和生理生化特征等表型特征,然而这些表型特征会随着环境的变化有所改变,从而造成菌株鉴定结果的不稳定。随着DNA分析技术的日渐成熟,利用rDNA鉴定菌种已经广泛被应用[6-8],特别是模式菌株的18S rDNA、26S rDNA的D1/D2区域很多已经被公布于GenBank/EMBL等国际核酸序列库,这使酵母菌的分类鉴定更加快捷和准确。26S rDNA的D1/D2区域位于大亚基的5′端,序列长度在600bp左右,扩增常用通用引物NL1:5′-GCATATCAATAAGCGGAGGAAAAG-3′和NL4:5′-GGTCCGTGTTTCAAGACGGG-3′。GUTEL LR R等[9]研究表明这段区域具有较高的变异率,可以用于亲缘关系较近的菌株之间的分类研究。对大量子囊菌酵母模式菌种的26S rDNA的D1/D2的序列分析发现,同种内不同菌株D1/D2区核苷酸替换率一般不超过1%,而不同种菌株其核苷酸替换率一般较大,因此可以作为酵母菌种级水平鉴定指标。本实验利用26S rDNA序列对所分离的酵母菌进行鉴定并结合生理生化特征探讨了酒酿中酵母菌的多样性,为酒酿的深加工提供理论依据。
1 材料和方法
1.1 材料与试剂
1.1.1 酒曲
酒曲:湖南韶山、湘潭、祁东民间酒曲。
1.1.2 培养基[10]
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:葡萄糖1%,酵母粉0.5%,蛋白胨1%,琼脂2%,用于分离酵母菌。
溶菌肉汤(lysogeny broth,LB)培养基:酵母粉0.5%,蛋白胨1%,NaCl 1%,用于分子生物学鉴定。
碳基础培养基:葡萄糖2%,KH2PO40.1%,MgSO4·7H2O 0.05%,酵母粉0.02%,(NH4)2SO40.5%,KNO30.78%,分装5mL/管。
氮基础培养基:(NH4)2SO40.5%,NaCl0.01%,MgSO4·7H2O 0.05%,KH2PO40.1%,CaCl2·2H2O 0.01%,酵母粉0.02%,碳源(葡萄糖、蔗糖、麦芽糖、乳糖、棉籽糖)0.5%,分装5mL/管。
醇类同化培养基:酵母膏0.01%,MgSO4·7H2O 0.025%,KH2PO40.05%,(NH4)2SO40.25%,分装5mL/管+2滴醇(山梨醇、乙醇、甘油、赤藓醇)。
糖发酵培养基:蛋白胨1%,NaCl 0.5%,1.6%溴甲酚紫乙醇溶液1~2mL,pH7.6,分装试管5mL/管+1mL糖(葡萄糖、乳糖、半乳糖、麦芽糖、蜜二糖、棉籽糖)+杜氏管。
1.1.3 其他
大肠杆菌DH5α:实验室保存;氨苄青霉素,TaqDNA聚合酶,Dntp,10×buffer,2 000bp Marker,引物(NL1和NL4):生工生物工程(上海)股份有限公司。
1.2 仪器与设备
HNY-1102C 恒温培养振荡器:天津市欧诺仪器仪表有限公司;DNP-9082型电热恒温培养箱:上海精宏实验设备有限公司;LDZX-50KBS 立式压力蒸汽灭菌器:上海申安医疗器械厂;A300型ArtGeneTM 基因扩增仪:杭州朗基科学仪器有限公司;StarPrep 胶回收试剂盒:北京康润诚业生物科技有限公司;DYY-6C 琼脂糖水平电泳板:北京六一仪器厂;Tanon 2500 凝胶成像系统:上海天能科技有限公司;SW-CJ-2F 洁净工作台:苏州安泰空气技术有限公司。
1.3 方法
1.3.1 酵母菌的分离纯化
采取梯度稀释的方法。取0.5g酒曲样品,倒入装有50mL灭菌蒸馏水的锥形瓶中,振荡20~30min,制成10-1浓度的稀释液。然后按10倍稀释法进行稀释分离,即用移液枪取0.5mL 10-2浓度稀释液加入到装有4.5mL灭菌蒸馏水的小试管中,充分混匀,制得10-3稀释液,采用同样方法依次获得10-3、10-4、10-5、10-6浓度的稀释液。分别将上述6个浓度的稀释液,用移液枪移取0.1mL于不同的YPD固体培养基上,用无菌涂布棒在超净工作台上将其涂布均匀,作标记,30℃恒温培养,12d后观察并记录,每个浓度设置3个重复。
1.3.2 形态观察
参照《酵母菌分类学鉴定标准方法》对供试菌株在形态上进行观察,进行初步鉴定[11]。
1.3.3 生理生化分析
将分离得到的9株菌株分别接种到糖发酵培养基、氮源同化培养基、碳源同化培养基和醇类同化培养基中,观察菌株的利用情况。
1.3.4 基因组总DNA的提取[12]
参照《基因工程实验指导》上介绍的酵母菌基因组提取方法,对筛选的酵母菌进行基因组的提取。
1.3.5 26S rDNA扩增及测序
以制备的酵母菌基因组为模板,以26S rRNA的通用引物,进行扩增。
NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)为上游引物。
NL4(5′-GGTCCGTGTTTCAAGACGG-3′)为下游引物。
PCR扩增产物切胶回收,与pMD-18T载体连接,转化入感受态大肠杆菌DH5α中,筛选阳性克隆,将具有阳性克隆的样品送至上海生物工程公司测序完成。将测序结果登录美国国立生物技术信息中心(national center of biotechnology information,NCBI)网站(http://www.ncbi.nlm.nih.gov/)用BLAST程序进行序列比对。比对之后用MEGA5建立系统进化树。以便确定分离菌株的种属。
2 结果与分析
2.1 酵母菌形态观察
经过分离,从湖南酒曲中共分离出35株酵母菌菌株,通过形态观察、生理生化分析和分子生物学鉴定,这35株酵母菌中有一些是序列相同的菌株,通过比对最终确定为9株菌株,分别为A、C、I、L、M、N、O、P、R。所分离的酵母菌的个体形态见图1。

图1 酵母菌个体形态Fig.1 Colonial individual form of yeast
2.2 酵母菌菌株的生理生化
经过对这9株酵母菌进行糖发酵、碳源同化、醇类同化、氮源同化的实验,结果见表1。从表1可以看出,这9株酵母菌的对糖、醇、醛及氮源的利用结果有所不同,这说明不同酒曲发酵的甜酒酿的口感和成分也不同,因此发酵后的酒酿的风味各有不同。后续工作将继续研究不同的酒酿中的非酵母菌菌株的多样性和酒酿中的蛋白质、多糖、灰分、氨基酸、有机酸等的不同之处,从而为工业发酵提供理论依据。
2.3 分子生物学鉴定
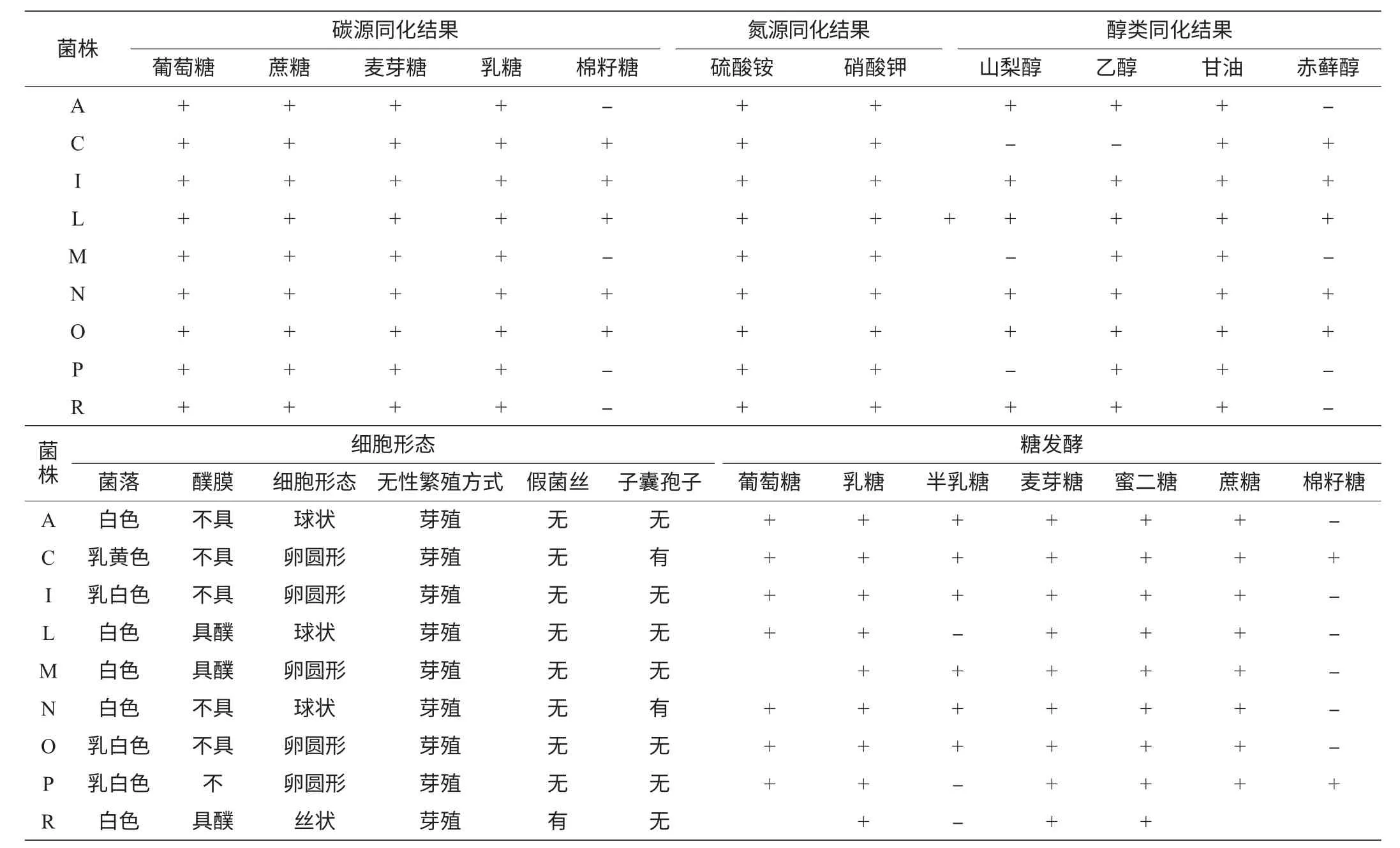
表1 酵母菌的形态和生理生化特征Table 1 Morphological,physiological and biochemical characteristics of yeast

图2 26S rDNA PCR结果Fig.2 PCR result of 26S rDNA
利用26S rDNA的通用引物通过PCR扩增出600bp左右的条带,结果见图2,将PCR产物割胶回收,与pMD-18T载体连接,转化到大肠杆菌DH5α中,筛选阳性克隆,将具有阳性克隆的样品送至上海生物工程公司测序,将所测的序列在NCBI上进行Blast比对,结果显示A与毕赤克鲁酵 母LY9AB499014.1 相 似 性 达 到99%,M 和P 菌 株 与LY9AB499014.1菌株的相似性分别为98%和97%,菌株R与毕赤克鲁酵母CEC RCS-0-9JX103190.1菌株相似性达99%。菌株O、I、C分别和酿酒酵母D3C JF715188.1、HA1835 AM262820.1、JN7N-19KC715802.1菌株相似度达到97%、98%、99%,而菌株N、L和酿酒酵母YJM789 JQ277730.1菌株相似度达到98%和99%,由此可见,从酒酿中分离的菌株多为酿酒酵母和毕赤酵母,利用MEGA5构建系统进化树结果见图3。
3 结论
对来自福建、江苏、湖南、上海、浙江等地的酒酿做了初步的菌种鉴定,从结果可以看出,在福建酒曲、苏州蜂蜜和安琪酒曲中的酵母菌主要是酿酒酵母和覆膜酵母[1],而在湖南酒曲中主要分离得到的酵母菌是酿酒酵母和毕赤酵母,由此可以了解在酒酿中其主要作用的是酿酒酵母,而非酿酒酵母在其中的作用有待进一步的实验验证。从实验中还分离得到一些霉菌,对这些菌株的验证正在进行中。接下来的工作重点将进行酵母菌发酵的条件优化,优势菌株的发酵机制以及酵母菌和其他非酵母菌之间发酵相关性的研究。

图3 酵母菌的系统进化树Fig.3 Phylogenetic tree of yeast
[1]姚淑敏,张 艳,秦宗艳,等.甜酒酿中酵母菌多样性的研究[J].中国酿造,2013,32(7):61-64.
[2]QUE F,MAO L C,ZHU C G,et al.Antioxidant properties of Chinese yellow wine,its concentrate and volatiles[J].LWT-Food Sci Technol,2006,39(2):111-117.
[3]SEO D H,JUNG J H,KIM H Y,et al.Identification of lactic acid bacteria involved in traditional Korean rice wine fermentation[J].Food Sci Biotech,2007,16(6):994-998.
[4]SUJAYA I N,ANTARA N S,SONE T,et al.Identification and characterization of yeasts in brem,a traditional Balinese rice wine[J].World J Microb Biot,2004,20(2):143-150.
[5]刘婧竞,乔发东.国内外甜酒曲研究进展[J].中国酿造,2010,29(9):21-25.
[6]孙家芳.关于大曲中有效菌种的培养及应用的探索[J].酿酒,2005,32(1):16-17.
[7]KURTZMAN C P,ROBNETT C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences[J].Anton Leeuw,1998,73(4):331-371.
[8]CADEZ N,RASPOR P,COCK A W A M,et al.Molecular identification and genetic diversity within species of the genera Hanseniaspora and Kloeckera[J].FEMS Yeast Res,2002,1(4):279-289.
[9]GUTELL R R,FOX G E.A compilation of large subunit RNA sequence presented in a structural format[J].Nucleic Acid Res,1988,16(supp):175-269.
[10]杨 革.微生物学实验教程[M].北京:科学出版社,2009.
[11]YARROW D,KURTZMAN C,FELL J W.The yeasts,a taxonomic study[M].America:Elsevier science,1998.
[12]朱旭芬.基因工程实验指导[M].北京:高等教育出版社,2006.
[13]JEYARAM K,SINGH W M,CAPECE A,et al.Molecular identification of yeast species associated with‘Hamei’-a traditional starter used for rice wine production in Manipur,India[J].Int J Food Microbiol,2008,124(2):115-125.
[14]兰景轩.醪糟的保健食疗[J].家庭医学,2005,20(1):49-50.
[15]樋口智子,大場孝宏.酒母からのLeuconostocmesenteroidesspp.mesenteroidesの分離[J].福岡県工業技術センター,2009,19:51-53.

