榆耳液体发酵菌丝体多糖提取方法的比较研究
郭海勇,邢晓瑞,何云亭,韩 育,李彬彬,鲍庆晗,孙文怡,于长春
(吉林师范大学生命科学学院,吉林 四平 136000)
榆耳(Gloeostereum incaratum),又称榆磨,是分布于中国东北部山区和日本北海道地区的一种稀有食药用真菌,近年来随着对榆耳多糖的深入研究,榆耳多糖的多种生物活性被发现,具有抗肿瘤、抗氧化、抗炎、免疫调节等功效[1-3].因其对人体正常细胞毒副作用很小,具有良好的提高机体免疫力的作用[4-5],并无毒副作用,可广泛应用于医药及保健食品领域,具有广阔的发展前景,因此有效提取榆耳多糖具有重要意义.
真菌多糖在细胞中一直作为能量存储分子和结构组成的角色,因其独特的功能和较低的毒性,已在抗肿瘤药、抗病毒药、抗衰老药等多个方面得到开发和应用[6],食药用真菌多糖的提取多见于水提和碱提法,而酶法和超声波法近年来也不断被应用.但是针对不同的食用菌,其有效的提取方法各不相同,因此本实验采用水法、酶法及超声波法对榆耳发酵菌丝体多糖的提取方法进行比较研究,为应用最佳提取方法的工艺优化研究和榆耳多糖免疫功能研究奠定基础.
1 材料与方法
1.1 材料
(1)菌种.榆耳 G105(Gloeostereum incarnatum S.Ito et Imai),购自吉林农业大学菌物研究中心.
(2)试剂.纤维素酶、中性蛋白酶由宁夏和氏璧生物技术有限公司生产.葡萄糖、三氯甲烷、正丁醇、乙醇、苯酚等试剂均为市售分析纯试剂.
(3)仪器设备.UV-4802型分光光度计,美国Unico公司;Vortex-Genie 2型旋涡混合仪,美国SI公司;RE52299型旋转蒸发仪,上海亚荣生化仪器厂;HH2S型恒温水浴锅,江苏省金坛市医疗仪器厂;JY92-IIDN超声波破碎仪,宁波新芝公司.
1.2 方法
(1)榆耳菌丝体发酵培养及菌丝体干粉的制备.将榆耳G105斜面试管菌种接种于PDB液体培养基,26℃、120 r/min培养7 d制成液体母种,以10%接种量接入液体摇瓶培养基中,26℃,120 r/min,培养7 d得到菌丝体.将菌丝体用4层纱布过滤,用蒸馏水反复洗涤3次,60℃恒温烘干,粉碎成干粉,备用.
(2)葡萄糖标准曲线的测定.分别吸取0.1mg/mL 的葡萄糖标准溶液 0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL、1.4mL、1.6mL,均以蒸馏水补至2.0mL.然后加入6%苯酚溶液1mL,在加入浓硫酸5mL,漩涡充分摇匀,沸水浴15min,冰浴5min,在波长490nm处测定吸光值A.并以A为纵坐标,溶液中葡萄糖含量为横坐标绘图,得标准曲线和回归方程.
(3)水提法提取榆耳菌丝体多糖.准确称取1.0 g榆耳菌丝干粉,料液比1∶30,80℃恒温水浴中浸提2.5 h,过滤,重复2次,合并上清液,减压蒸馏浓缩至原体积的1/10.冷却后Sevage法除蛋白:按多糖溶液体积加入比为5∶1的三氯甲烷和正丁醇混合液,剧烈振荡20min,弃去下层有机溶液层和中间变性蛋白质,重复2次.除蛋白后的提取液加入终浓度为3%的过氧化氢,在50℃下保温脱色20min,加入3倍体积无水乙醇,4℃静置过夜,4000 r/min离心15min,收集沉淀,60℃烘干至恒重,称重,采用苯酚–硫酸法测定榆耳发酵液中多糖含量,计算其得率,试验重复3次.

(4)酶法提取榆耳菌丝体多糖.准确称取1.0 g榆耳菌丝干粉,料液比1∶30,调节pH为4.5,加入3%的纤维素酶,40℃作用30min,再调pH至7.5加3%中性蛋白酶作用30min,升温至80℃灭酶30min,4000 r/min离心 15min,取上清液,沉淀反复洗涤2次,合并上清液,减压蒸馏浓缩至原体积的1/10.采用Sevage法除蛋白,脱色,醇沉,干燥,苯酚–硫酸法测定榆耳发酵液中多糖含量,计算其得率,试验重复3次.
(5)超声波法提取榆耳菌丝体多糖.准确称取1.0 g榆耳菌丝干粉,料液比1∶30,功率为600 W,超声时间为30min,4000 r/min离心15min,取上清液,沉淀反复洗涤2次,合并上清液,减压蒸馏浓缩至原体积的1/10.采用 Sevage法除蛋白,脱色,醇沉,干燥,苯酚–硫酸法测定榆耳发酵液中多糖含量,计算其得率,试验重复3次.
2 结果与分析
2.1 葡萄糖标准曲线方程的确定
精确量取葡萄糖标准溶液 0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL、1.4mL、1.6mL用蒸馏水分别补至2.0mL,按苯酚–硫酸法比色测定吸光度,以标准葡萄糖质量浓度(x,mg/mL)为横坐标、吸光度(y)为纵坐标,得到标准曲线(见图1),其回归方程为 y=12.70x - 0.0019,R2=0.9986.葡萄糖质量浓度在 0.00 ~0.10mg/mL 范围内线性关系良好.
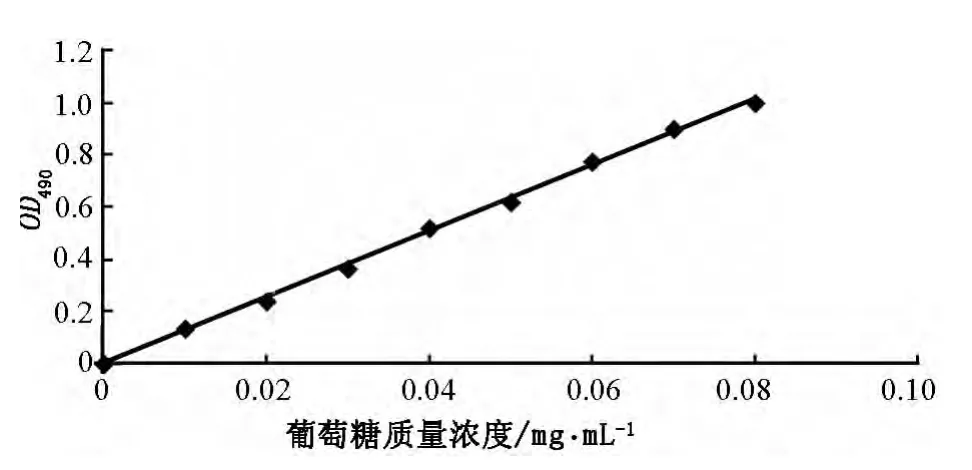
图1 葡萄糖的标准曲线
2.2 三种不同提取方法多糖提取率结果比较
采用水提取法、酶法提取法、超声波提取法3种方法对一定量的榆耳菌丝体进行多糖提取,其多糖提取率比较结果见图2.

图2 不同提取方法提取榆耳菌丝体多糖提取率的比较结果
从图2可以看出,酶法多糖提取率最高,达到4.70%,其次是超声波法,多糖提取率为3.92%,且用时最短.水提取法提取率最低,为3.47%,且操作时间最长,但超声波法与水提取法差异不显著.
3 结论
热水提取法是提取真菌多糖的传统方法,工艺简单,设备要求低,能够最大限度地保持多糖的结构和活性,但操作时间长,提取效低率.应用水提法提取榆耳菌丝体多糖,粗多糖得率为3.47%,低于张公亮等[6]水提醇沉法提取多糖的得率.超声波法是目前提取真菌多糖的最快速经济的方法,是利用超声波的空化作用及各种次级效应瞬时产生大量热能,加速有效成分溶出,提高多糖的提取率和纯度,缩短提取时间、降低能耗,并避免了高温对多糖结构和活性的影响,提取过程中需注意超声时间,过长会引起多糖的分解[7,8].但本研究采用超声波提取榆耳菌丝体多糖的效果并不理想,和水提法无明显差异且低于酶法的提取率.
复合酶法提取真菌多糖是近几年发展起来的一种新技术,针对真菌多糖分布部位及细胞结构特征的不同,恰当地利用各种酶的协同作用改变细胞壁的通透性,破坏菌体细胞结构,最大限度地提高多糖的得率,同时保持多糖的活性构象和药用功能,酶法技术应用于天然产物的提取制备操作简便,成本低廉。此方法已在真菌多糖提取中广泛应用,并取得较好的效果[10,11].本研究采用复合酶解法提取液态深层发酵培养获得的榆耳菌丝体多糖,得率高于传统的热水提取法和超声波提取法,与刘振春等[9]通过酶法提取榆耳菌丝体多糖的得率相似.本研究通过对三种不同提取榆耳菌丝体多糖的方法进行比较研究,确定酶法提取效果最好,榆耳菌丝体多糖提取率高于其他两种方法,为榆耳菌丝体多糖提取工艺优化及进一步研究榆耳多糖性质和功能奠定基础.
[1]柳洪芳,王新宇,吕金超,等.榆耳多糖的分离纯化、结构鉴定及抗肿瘤活性研究[J].中国生化药物,2010,31(5):293~296.
[2]李雨婷,宋 慧,李艳秋,等.榆耳深层发酵浸膏醇提物的抗氧化活性研究[J].菌物研究,2010,8(2):90~102.
[3]崔京春,郭海勇,邢效瑞,等.榆耳发酵液抑菌谱及抑菌作用稳定性研究[J].黑龙江畜牧兽医,2013,13:105~107.
[4]翁丽丽,翁 砚,邱金文.榆耳多糖对动物免疫功能的影响[J].吉林中医药,2009,29(7):626~627.
[5]崔京春,郭海勇,邢效瑞,等.榆耳发酵液多糖对小鼠免疫功能的影响[J].食品工业科技,2013,34(16):342-346.350.
[6]孙文怡,战 阳,等.盐析法纯化猴头菌多糖工艺条件的研究[J].吉林师范大学学报(自然科学版),2011,32(3):88~91.
[7]张公亮,王应男,刘 洋,等.榆耳菌丝体多糖提取及脱色条件的研究[J].食品科学,2012,33(24):147~151.
[8]薛 丹,黄豆豆,黄光辉,等.植物多糖提取分离纯化的研究进展[J].中药材,2014,37(1):159~163.
[9]Toma M,Vinatoru M,Paniwnyk L,et al.Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J].Ultrasonics Sonochemistry,2001,8:137 ~142.
[10]叶 敏,复合酶法提取红托竹荪多糖的工艺研究[J].吉林师范大学学报(自然科学版),2012,33(2):145~147.
[11]王云洁,闫洛攀,白福祖.敏法在中药提取中的应用进展[J].中国中医药信息杂志,2013,20(9):110~112.
[12]刘振春,蒋中华,李 慧,等.酶法提取榆耳菌丝体胞内多糖的工艺研究[J].食品科学,2009,30(13):201~204.

