小鼠肺癌细胞诱导分化后的力学特性比较
李建停,马德顺,牛庆元,张晶晶,纪珍玲
(沈阳大学 生命科学与工程学院,辽宁 沈阳 110044)
细胞牵引力在细胞的生长和发育过程中具有独特的作用[1],在细胞内肌动球蛋白的相互作用和肌动蛋白的聚合作用下而产生[2-4],并通过黏着斑施加给细胞外基质[5-7].它对细胞的伸展、拖曳、移动及信号传导具有重要影响[8-10].研究发现,α-SMA(平滑肌肌动蛋白)是细胞牵引力的重要调节因子,它的表达可调节细胞牵引力的变化[11-12],α-SMA 表达水平和细胞牵引力大小存在正相关性[13].细胞的癌变和转移与牵引力也有关系,Wottawah等学者在研究中发现细胞牵引力在肿瘤诊断方面具有重要意义[14],康奈尔大学的学者也发现在癌细胞转移前后牵引力有明显的变化[15],马德顺等学者发现人的干细胞经过分化后牵引力将减小[16],不同种类、不同形态、不同发育阶段的细胞其牵引力也不同[17-18].肿瘤细胞与正常细胞的牵引力不同,正常细胞癌变后牵引力会发生变化,有些药物和因子对细胞牵引力具有调节作用[19-21],现在很多学者采用诱导分化的方法对肿瘤细胞进行修复,但诱导分化剂对于细胞牵引力的影响还未见报道.本实验用肉桂酸做诱导分化剂对小鼠肺癌细胞进行处理,采用鬼笔环肽染色技术和免疫印迹技术观察了小鼠肺癌细胞诱导分化前后细胞内部构象和α-SMA蛋白含量变化, 并 用 CTFM (Cell Traction Force Microscopy,即显微镜追踪法测定细胞牵引力)法[3]2测定了小鼠肺癌细胞分化前后的细胞牵引力变化,旨在发现诱导分化对小鼠肺癌细胞的力学特性和细胞内部构象及α-SMA的影响[22].
1 材料与方法
1.1 Lewis肺癌细胞株和实验材料
Lewis肺腺癌细胞株(LLC,来源于C57BL/6小鼠的肺腺癌细胞)由中科院提供,DMEM(氨基酸和葡萄糖复配)培养液购于Invitrogen公司,犊牛血清购于德国Biochrom公司,抗体及鬼笔环肽购于Sigma公司,肉桂酸购于上海江莱生物科技有限公司.所有物品均经高压灭菌.
1.2 细胞培养
1.2.1 小鼠肺癌细胞的培养
取小鼠肺癌细胞株,放在含10%质量分数的FBS(牛胎血清)和200U/mL双抗的DMEM培养基中,置于5%体积分数的CO2,37℃培养箱中培养,以后每3~4d传代1次[23-26],100mL培养瓶传代为5×105个/mL[27].
1.2.2 实验分组
空白对照组:用上述培养基培养细胞,添加与实验组等量的氢氧化钠做对照组.
诱导剂实验组:由于肉桂酸对肺腺癌细胞具有诱导分化作用[28],故选肉桂酸做诱导剂.用等质量摩尔浓度氢氧化钠溶解肉桂酸为盐,制成终浓度为12mmol/L的原液.使用时按使用的质量摩尔浓度稀释在培养基(3mmol/L)中,取对数生长期细胞传代,待细胞贴壁后1d加入含诱导剂培养基,隔日换液.
1.3 鬼笔环肽染色
经过7d左右诱导后,分别收集对照组和实验组的细胞在盖玻片上培养至体积分数达70%~80%(盖玻片面积)后取出(约3~5d),用PBS(磷酸盐缓冲液)轻柔洗涤;3.7%质量分数的甲醛-PEMD固定10min,PBS洗去固定液,略干燥后滴 0.1%质量分数的 Triton X-100 处理 10 min,PBS洗涤,加入20mL,5μg/mL鬼笔环肽染液到清洁载玻片上,将盖玻片上细胞样品反扣其上,避光染色40min,取出后用PBS和蒸馏水冲洗,显微镜下观察.
1.4 免疫印迹技术检测α-SMA蛋白的变化
分别收2mL(约30万个细胞)的诱导分化前后小鼠肺癌细胞,用含1.5%质量分数的蛋白酶抑制剂的细胞裂解液(Sigma-Aldrich公司)处理细胞,制备电泳样本,用BCA(蛋白定量分析)试剂盒检测其浓度,取等量蛋白样本注入10%质量分数的聚丙烯酰胺凝胶,90V恒定电压电泳,用电转膜仪以70V电压转膜90min.用5%质量分数的奶粉PBS-Tween20缓冲液处理1h,用抗鼠α-SMA特异蛋白为一抗,用过氧化酶标记的羊抗鼠免疫球蛋白为二抗,用ECL蛋白检测试剂盒检测α-SMA.
1.5 细胞牵引力测算
1.5.1 CTFM 技术
CTFM基本原理是根据细胞基质弹性表面形变程度来测算细胞牵引力的一种技术.其简要操作步骤如下:制备相应硬度的弹性基质,掺入荧光微珠,先用普通光源拍摄细胞,再用绿色荧光拍摄有细胞的基质图片,加入2滴氢氧化钠c(NaOH)=1mol/L)杀死细胞后再拍摄一张基质图片,分别进行编号以进行分析.
1.5.2 细胞种植
分别取两组预测细胞,用胰酶处理后获得悬浮细胞,经离心弃胰酶溶液后加入新培养液,取50μL细胞液,约含1 500~2 000个细胞,种在弹性基质上,待细胞贴壁后补充3mL培养液,培养6h,测定细胞牵引力.
1.5.3 图像信息的分析处理
用MATLAB 7.0软件运行专用程序对图片进行比较分析,测算出各个细胞的牵引力及其相关参数.将实验数据用SPSS软件进行分析求出平均值和标准方差,并用k-s检验和t检验功能对数据进行验证.
2 结 果
2.1 微丝的变化
利用鬼笔环肽对小鼠肺癌细胞诱导分化前后分别进行染色观察,发现与对照组的小鼠肺癌细胞的微丝相比诱导组的细胞微丝明显变细,且分布比较规则有序;癌细胞微丝呈现不规则的分布,处于一种扭曲和包含能量的状态,而经过诱导分化后能量得到释放扭曲消失,形态和分布接近正常细胞(见图1).
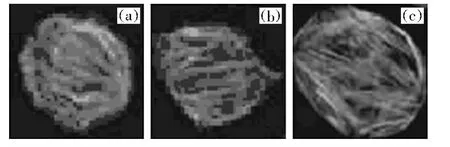
图1 小鼠肺癌细胞诱导分化前后微丝的变化Fig.1 The microfilament changes of themice's lung carcinoma cells before and after induced differentiation
2.2 免疫印迹法检测α-SMA蛋白的变化
经检测发现,小鼠肺癌细胞经诱导分化后α-SMA蛋白含量明显高于分化前的细胞,见图2.

图2 小鼠肺癌细胞诱导分化前后α-SMA蛋白表达变化Fig.2 Theα-SMA protein changes of the mice's lung carcinomacells before and after induced differentiation
2.3 细胞牵引力的变化
采用了CTFM法对小鼠肺癌细胞诱导分化前后的细胞及正常细胞牵引力进行测量.测得小鼠肺癌细胞分化后牵引力变大,平均值由281Pa增加到550Pa,增加大约一倍,经测算细胞投影表面积平均值由695μm2增加到955μm2,增加大约37%(见图3).细胞的最大牵引力由1.2kPa增加为1.7kPa(见图4).

图3 小鼠肺癌细胞诱导分化前后细胞牵引力和投影面积的比较(n=30,P<0.05)Fig.3 The comparison of cell traction force and projected area of mice's lung carcinoma cells before and after induced differentiation(n=30,P<0.05)

图4 小鼠肺癌细胞诱导分化前后牵引力的分布变化Fig.4 The changes of distribution on the cell traction force of mice’s lung carcinoma cells before and after induced differentiation
3 讨 论
细胞牵引力是由细胞内的肌动球蛋白的相互作用和肌动蛋白的聚合作用产生的应力,而且与细胞的状态及蛋白组成密切相关[29].当小鼠肺癌细胞经诱导分化以后,细胞内部的微丝骨架、形态、体积、α-SMA蛋白及细胞牵引力都恢复接近正常细胞状态.这一现象说明癌细胞的微丝骨架是扭曲的,即构成微丝、微管和中间纤维的蛋白的收缩程度与正常细胞是不同的,而这种状态直接影响细胞的外在形态,使癌细胞形成一个新的张力平衡,然而经过诱导分化后,细胞的内部构造逐步向正常细胞转变,使细胞的微丝构像趋于正常;小鼠肺癌细胞的α-SMA蛋白和细胞牵引力也随着分化而改变,α-SMA蛋白含量变化与细胞牵引力的变化趋势相吻合,说明平滑肌肌动蛋白的表达影响了细胞牵引力,和此前学者研究的小鼠髌腱干细胞得出的α-SMA蛋白减弱是导致细胞牵引力减弱的原因的结论相符,也验证了α-SMA蛋白的表达和细胞牵引力存在线性关系,而α-SMA蛋白含量变化与细胞微丝及形态的关系还有待于进一步研究.小鼠癌细胞分化后细胞牵引力的变化趋势与人的癌细胞变化趋势相反[30]这是一个非常有趣的现象,不同物种的细胞癌变后,细胞形态和部分蛋白的表达变化趋势都是有差异的甚至是相反的.
[1] Ananthakrishnan R,Ehrlicher A.The Forces behind Cell Movement [J]. International Journal of Biological Sciences,2007,3(5):303-317.
[2] Moustakas A,Souchelnytskyi S,Heldin C H.Smad Regulation in TGF-beta Signal Transduction[J].Journal of Cell Science,2001,114(24):4359-4369.
[3] Wang James H C,Lin Jeen-Shang.Cell Traction Force and Measurement Methods [J]. Bio-mechan Model Mechanobiol,2007,6(6):361-371.
[4] Munevar S, Wang Yuli,Dembo M.Traction Force Microscopy of Migrating Normal and H-ras Transformed 3T3Fibroblasts[J].Biophysical Journal,2001,80(4):1744-1757.
[5] Balaban N Q,Schwarz U S,Riveline D,et al.Force and Focal Adhesion Assembly:A Close Relationship Studied Using Elastic Micropatterned Substrates[J].Nature Cell Biology,2001,3(5):466-472.
[6] Beningo K A,Dembo M,Kaverina I,et al.Nascent Focal Adhesions are Responsible for the Generation of Strong Propulsive Forces in Migrating Fibroblasts[J].Journal of Cell Biology,2001,153(4):881-888.
[7] Geiger B,Bershadsky A.Assembly and Mechanosensory Function of Focal Contacts[J].Current Opinion in Cell Biology,2001,13(5):584-59.
[8] Galbraith C G,Yamada K M,Sheetz M P.The Relationship between Force and Focal Complex Development[J].Journal of Cell Biology,2002,159(4):695-705.
[9] Chen Jianxin,Li Hongxia,SundarRaj N,et al.Alpha-Smooth Muscle Actin Expression Enhances Cell Traction Force[J].Cell Motility and the Cytoskeleton,2007,64(4):248-257.
[10] Goffin J M,Pittet P,Csucs G,et al.Focal Adhesion Size Controls Tension-dependent Recruitment of Alpha-smooth Muscle Actin to Stress Fibers[J].Journal of Cell Biology,2006,172(2):259-268.
[11] Hinz B,Dugina V,Ballestrem C,et al.Alpha-smooth Muscle Actin is Crucial for Focal Adhesion Maturation in Myofibroblasts[J].Molecular Biology of the Cell,2003,14(6):2508-2519.
[12] Oliver T,Jacobson K,Dembo M.Traction Forces in Locomoting Cells[J].Cell Motility and the Cytoskeleton,1995,31(3):225-240.
[13] Kong H J,Polte T R,Alsberg E,et al.FRET Measurements of Cell-traction Forces and Nano-scale Clustering of Adhesion Ligands Varied by Substrate Stiffness[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(12):4300-4305.
[14] Wottawah F,Dietrich J,Schinkinger S,et al.Mechanical Properties of Cells as Diagnostic Marker for Oral Cancer[J].Journal of Biomechanics,2006,39(0):233-233.
[15] Bogatkevich G S,Tourkina E,Abrams C S,et al.Contractile Activity and Smooth Muscle Alpha-actin Organization in Thrombin-induced Human Lung Myofibroblasts[J].American Journal of Physiology-Cell Physiology,2003,285(2):334-343.
[16] 马德顺,高淑云,路春霞,等.前交叉韧带干细胞分化后其牵引力的变化[J].中国细胞生物学学报,2010,32(1):141-144.
(Ma Deshun,Gao Shuyun,Lu Chunxia.Cell Differentiation of Anterior Cruciate Ligament Stem after Traction Changes[J].Chinese Journal of Cell Biology,2010,32(1):141-144.
[17] Kawai-Kowase K,Sato H,Oyama Y,et al.Basic Fibroblast Growth Factor Antagonizes Transforming Growth Factor-beta1-induced Smooth Muscle Gene Expression through Extracellular Signal-regulated Kinase 1/2Signaling Pathway Activation[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2004,24 (8):1384-1390.
[18] 徐继,张岩,何治军.乳腺癌间质成纤维细胞α-SMA表达的意义[J].重庆医学,2010,39(23):3195-3199.
(Xu Ji,Zhang Yan,He Zhijun.The Significance ofα-SMA Expression in Interstitial of Breast Cancer[J].Chongqing Medicine,2010,39(23):3195-3196,3199.)
[19] 周治国,刘志文,范哲意.微悬臂梁阵列在细胞牵引力测量中的应用[J].生物医学工程研究杂志,2009,28(1):121-124.
(Zhou Zhiguo,Liu Zhiwen,Fan Zheyi.The Application of Microcantilever Array for Cell Traction Force Measurement[J].Journal of Biomedical Engineering Research,2009,28(1):121-124.)
[20] Zhang Y H,Zhao C Q,Jiang L S,et al.Substrate Stiffness Regulates Apoptosis and the mRNA Expression of Extracellular Matrix Regulatory Genes in the Rat Annular Cells[J].Matrix Biology,2011,30(2):135-144.
[21] Li B,Wang J H C.Application of Sensing Techniques to Cellular Force Measurement[J].Sensors,2010,10(11):9948-9962.
[22] Jemal A,Murray T,Ward E,et al.Cancer Statistics,2005[J].CA:A Cancer Journal for Clinicians,2005,55(1):10-30.
[23] 陆燕蓉,林苹,张洁,等.小鼠Lewis肺癌细胞株L3-8的建立及生物学特征[J].实用癌症杂志,1998,13(3):161-163.
(Chen Yanrong, Lin Ping, Zhang Jie, et al.Establishment of C57BL Mice Lewis Lung Carcinoma Cell Line(L3-8)and its Cellbiology Character[J].The Practical Journal of Cancer,1998,13(3):161-163
[24] 陈妹琼,陈芳芳,申洪.C57BL/6小鼠晚期Lewis肺腺癌化疗 疗 效 评 价 [J]. 广 东 药 学 院 学 报,2008,26(1):62-63.
(Chen Meiqiong,Chen Fangfang,Shen Hong.Assessment of the Use of Paclitaxel and Cisplatin in Advanced Lewis Lung Carcinoma in C57BL/6Mice[J].Journal of Guangdong Pharmaceutical University,2008,26(1):62-63.)
[25] 刘馨,伍治平,左曙光,等.小鼠Lewis肺癌原位模型的构建[J].中国肺癌杂志,2010,13(1):42-47.
(Liu Xin,Wu Zhiping,Zuo Shuguang,et al.Establishment of Orthotopic Lewis Lung Cancer Model in Mouse[J].Chinese Journal of Lung Cancer,2010,13(1):42-47.)
[26] 彭鹏.小鼠Lewis肺癌胸腔移植模型的建立[J].东南大学学报:医学版,2008,27(5):340-343.
(Peng Peng, Du Xiuping, Song Yuhua. The Establishment of Lewis Lung Cancer in Mice[J].Journal of Southeast University,2008,27(5):340-343.)
[27] 郑金旭,黄振杰,汤艳,等.构建原代分离培养与鉴定小鼠肺泡Ⅱ型上皮细胞的方法及模型[J].中国组织工程研究与临床康复周刊杂志,2010,14(15):2761-2764.
(Zheng Jinxu, Huang Zhenjie, Tang Yan,et al.Construction Method of Cultivation and Identification of Mouse Alveolar Type Ⅱ Epithelial Cells Primary Separation and Model[J].Chinese Journal of Clinical Rehabilitative Tissue Engineering Research,2010,14(15):2761-2764.)
[28] 王涛,金戈.肉桂酸对人肺腺癌细胞诱导分化的实验研究[J].癌症,2000,19(8):782-785.
(Wang Tao,Jin Ge.Effects of Cinnamic Acid on Differentiation of Human Lung Adenocarcinoma Cells[J].Cancer,2000,19(8):782-785.)
[29] 周历,马德顺,杨毓,等.Pinch-3蛋白对细胞形态及牵引力的影响[J].沈阳大学学报:自然科学版,2012,24,(1):45-47.
(Zhou Li,Ma Deshun,Yang Yu,et al.Effect of Pinch-3 Protein on Cell Morphology and Traction[J].Journal of Shenyang University:Natural Science,2012,24(1):45-47.)
[30] Valastyan S, Weinberg R A. Tumor Metastasis:Molecular Insights and Evolving Paradigms[J].Cell,2011,147(2):275-292.

