血栓烷A2
——新型抗缺血性脑卒中药物治疗靶点*
周祎,方伟蓉,李运曼
中国药科大学生理教研室,南京 210009
血栓烷A2
——新型抗缺血性脑卒中药物治疗靶点*
周祎,方伟蓉,李运曼**
中国药科大学生理教研室,南京 210009
血栓烷A2(TXA2)是血小板聚集和释放的强诱导剂,促进血栓形成;TXA2也可以引起动脉血管收缩,调节血管张力。近年来,越来越多的研究证实了TXA2诱导缺血性脑卒中发生和促进其进展的作用。这提示,TXA2可成为新型抗缺血性脑卒中药物治疗靶点。本文主要探讨了TXA2参与缺血性脑卒中发生与发展的机制,并对以TXA2为靶点防治缺血性脑卒中的药物进行综述。
血栓烷A2;缺血性脑卒中;环氧合酶抑制剂;血栓烷合成酶抑制剂;血栓烷A2受体拮抗剂
缺血性脑卒中是由于脑血流量降低引起的脑组织代谢或功能障碍。血栓烷A2(thromboxane A2,TXA2)具有强烈的血小板聚集和缩血管作用,能促进血栓形成,影响脑血流量。近年来,越来越多的研究发现,TXA2具有诱导缺血性脑卒中发生和促进其发展的作用。TXA2通过诱导颈部或头部血管粥样硬化,引发缺血性脑卒中;当脑缺血发生时,花生四烯酸(arachidonic acid,AA)代谢途径被激活,导致TXA2过量生成,加重缺血性脑卒中损伤[1]。这提示,TXA2是潜在的预防及治疗缺血性脑卒中的新靶点,使用药物减少TXA2的生成,或者抑制血栓烷受体(thromboxane receptor,TP)的激活,能达到防治缺血性脑卒中的作用。本文主要讨论TXA2在缺血性脑卒中发生和发展中的作用及机制,并对以TXA2为靶点防治缺血性脑卒中的药物进行综述。
1 TXA2的生物合成及受体激活效应
1.1 TXA2的生物合成
TXA2是血栓烷合成酶(thromboxane synthetase,TXS)作用于前列腺素环状内过氧化物产生的花生四烯酸代谢物质。花生四烯酸存在于细胞膜上,当磷脂酶A2(phospholipase A2,PLA2)被激活时,能刺激膜磷脂释放花生四烯酸,花生四烯酸在环氧合酶(cyclooxygenase,COX)作用下,生成前列腺素G2(prostaglandin G2,PGG2)、前列腺素H2(prostaglandin H2,PGH2)。前列腺素H2在前列环素合成酶(prostacyclin synthase,PGIS)作用下则生成前列环素(prostaglandin,PGI2),前列环素半衰期3 min,快速水解为6-keto-PGF1α;前列腺素H2被血栓烷合成酶催化生成TXA2,TXA2半衰期约30 s,迅速转化成无活性的血栓烷B2(thromboxane B2,TXB2),此过程不需要酶催化。TXA2的生物合成及药物干预靶点见图1。
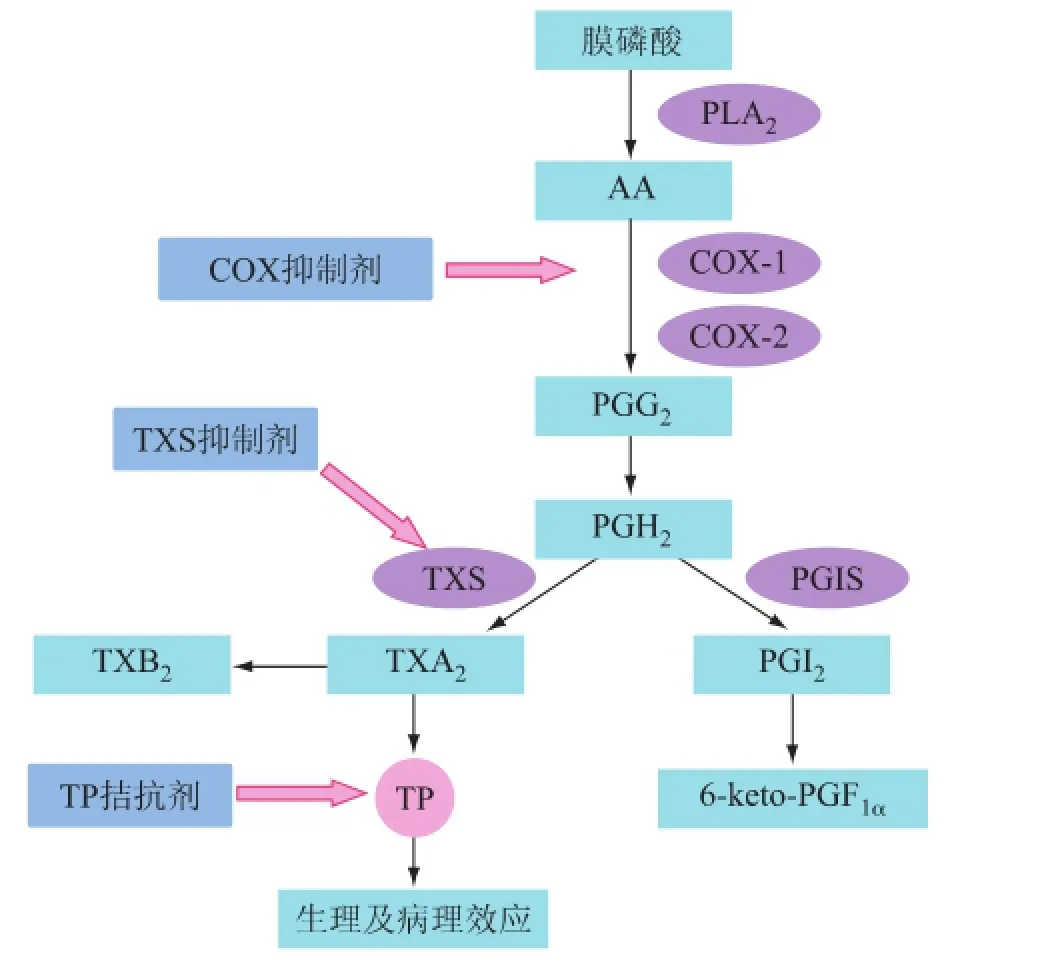
图1 TXA2生物合成及药物干预靶点
TXA2的生成依赖环氧合酶和血栓烷合成酶,这两种酶是药物干预TXA2生物合成的两个重要靶点。环氧合酶有三种亚型:COX-1、COX-2、COX-3。COX-1在体内普遍表达,参与正常生理过程,血小板是TXA2的主要来源细胞,生理状态下仅表达COX-1;COX-2则主要在特定的病理状态下诱导产生,参与病理状态下的炎症;COX-3是近来被发现的COX的另一种亚型,主要存在于星形胶质细胞、内皮细胞、周细胞,其作用仍存争议,有待进一步研究。环氧合酶的三种亚型中,对花生四烯酸诱导的血小板TXA2生物合成起关键作用的是COX-1,而COX-2的贡献不足血小板TXA2合成量的2%[2],前列环素的生成主要是依赖COX-2[3]。血栓烷合成酶最初在血小板中被发现,被认为是微粒体酶类,后来在其他组织如肾、肺等也检测到血栓烷合成酶的表达。
1.2 血栓烷受体及激活效应
由于TXA2半衰期短,极容易转化为无活性的血栓烷B2,因此TXA2是通过自分泌或旁分泌形式,作用于合成TXA2的细胞或临近细胞。TXA2与血栓烷受体结合发挥生物学作用。血栓烷受体存在于多种组织及细胞中,在血管、肠平滑肌细胞、内皮细胞、血小板、中枢及外周神经系统等都检测到了其信使核糖核酸的表达,这预示着TXA2具有广泛的生物学活性。
血栓烷受体是一种特异性G蛋白偶联受体,具有7次跨膜结构。TXA2与血栓烷受体的胞外N端结合后,可偶联G蛋白,引发信号级联放大。人血栓烷受体有两种表型:α型血栓烷受体(TPα)与β型血栓烷受体(TPβ),前者以人胎盘为来源克隆得到,后者以内皮细胞为来源克隆得到。研究尚未发现这两种血栓烷受体与配基的结合或与G蛋白的偶联有任何不同,两者的差异仅表现在羧基尾部。目前已发现的与TXA2偶联的G蛋白,包括Gq蛋白家族、G12蛋白家族、Gi、Gs、Gh、Gβγ[4]。
血栓烷受体与Gq蛋白偶联,引发TXA2最主要的生理活性,即致平滑肌细胞收缩与血小板聚集。Gq蛋白是一种热源三聚体,受到刺激时,可使磷酸脂酶C(phospholipase C,PLC)活化,肌醇三磷酸(inositol triphosphate,IP3)和二酰甘油(diacylglycerol,DAG)蓄积,随即引发胞内储存Ca2+的释放和蛋白激酶C(protein kinase C,PKC)激活。G12蛋白家族包括G12和G13蛋白,引发的生理效应包括胞质分裂、细胞收缩、细胞增殖与凋亡等。目前普遍认为,血栓烷受体偶联激活的G蛋白主要是Gq和G13。缺乏Gq和G13的血小板对TXA2无应答,这表明Gq和G13的激活是TXA2致血小板活化的必要因素。Gβγ的激活引发磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)和磷酸脂酶C的活化。Gi和Gs分别对腺苷酸环化酶有抑制和激动作用,两者都可调节环腺苷酸水平。Gh引发的下游效应与Gq类似。因此,TXA2的生理作用取决于不同的组织和细胞,并且与偶联激活的G蛋白类型有关。
2 TXA2与缺血性脑卒中
2.1 TXA2诱导缺血性脑卒中的发生
缺血性脑卒中是脑血流量的降低引起的脑组织代谢或功能障碍,大多数是由颈部或头部血管狭窄引起,最普遍的原因是该处血管粥样硬化。当脑血管变得过于狭窄时,血细胞容易在该处募集形成血栓,这些血栓可在形成部位堵塞血管,或随着血液流动到远端或更小的血管处形成阻塞,临床上称为局灶性脑血栓或脑梗死。缺血性脑卒中的另一种类型是栓塞性脑卒中,也是由脑血管堵塞引起,不同的是阻塞血管的血凝块或栓子是在外周血管中形成的,多数情况下来源于心脏,随着血液进入脑血管引起堵塞。此外,缺血性脑卒中其他发病原因还包括颈部血管的挫伤,血液凝固功能的紊乱等。
TXA2通过诱导脑部血管的粥样硬化及继发的血栓形成,影响缺血性脑卒中的发生。TXA2与前列环素是一对重要的活性物质,具有相反的生理活性,两者共同调节心脑血管系统的正常生理[5]。TXA2主要由血小板合成,有强烈的缩血管和促血小板聚集作用;前列环素主要由血管内皮细胞和平滑肌细胞产生,能舒张血管和抑制血小板聚集[6]。当血管内皮损伤时,血小板易黏附在损伤处并相互聚集,生成并释放大量的TXA2。TXA2进一步促进聚集和血栓形成,并且其强烈的缩血管作用可引起周围组织坏死,促进内膜增生,加剧动脉粥样硬化的形成和发展。研究发现,在动脉粥样硬化的早期和进展期,TXA2生成增加,血管产生前列环素能力下降,前列环素生成减少。TXA2和前列环素的失衡是脑部或颈部血管粥样硬化形成导致血管狭窄、引起缺血性脑卒中的病因之一,使用药物调节两者的平衡可能成为缺血性脑卒中有效的预防措施。
2.2 TXA2促进缺血性脑卒中的发展
缺血性脑卒中发生时,脑组织缺乏足够的血液灌注,缺血、缺氧导致高能量代谢途径衰竭,细胞进行厌氧性糖酵解、酸中毒,Na+-K+-ATP酶离子泵失效,胞内Ca2+、Na+、Cl-浓度升高,Ca2+依赖的磷酸酯酶A2激活,从而刺激膜磷脂释放花生四烯酸,启动TXA2生物合成途径。研究发现,脑梗死患者血清中TXA2含量明显高于正常对照组[7]。脑缺血状态下,TXA2大量生成,作用于血栓烷受体,激活下游通路,加重脑损伤。
过量生成的TXA2与脑部血管平滑肌细胞血栓烷受体结合后,分别通过对Gq蛋白和细胞膜离子通道的活化,刺激肌浆网Ca2+释放和促进胞外Ca2+内流,进而增加血管平滑肌细胞胞质游离Ca2+水平,引起平滑肌痉挛,导致脑血流进一步降低,加剧脑组织损伤。
TXA2对血脑屏障的破坏也是其促进脑缺血进展的一个因素。血脑屏障由三层结构组成,即脑毛细血管内皮细胞、基底膜及神经胶质细胞。生理状态下,血脑屏障保持着完整性,是脑组织内环境稳定的基本条件,可阻止炎性分子黏附或跨内皮穿过进入脑组织。脑血管内皮细胞表达血栓烷受体,TXA2与之作用,可引起一些炎性分子表达的上调,例如白细胞介素-8(interleukin-8,IL-8)、胞间黏附分子(intercellular adhesion molecule,ICAM)、血管细胞黏附分子(vascular cell adhesion molecule,VCAM)等,增加内皮细胞的通透性,造成血脑屏障破坏[8]。
此外,研究还发现,TXA2能促进血小板对内皮细胞的黏附,加重神经血管的炎症[9],损伤血脑屏障,进而促进缺血性脑卒中的发展。
3 以TXA2为靶点治疗缺血性脑卒中的药物
TXA2诱导缺血性脑卒中的发生,并且促进缺血性脑卒中的发展,大量的研究关注于将TXA2作为新的药物设计靶点,防治缺血性脑卒中。目前以TXA2为作用靶点的药物主要是通过抑制TXA2的生成和拮抗血栓烷受体发挥作用,根据机制可分为三类:(1)环氧合酶抑制剂;(2)血栓烷合成酶抑制剂;(3)血栓烷受体拮抗剂。
3.1 环氧合酶抑制剂
由于TXA2生成的主要来源是血小板,依赖于COX-1;前列环素的生成主要来自血管内皮细胞,依赖于COX-2。因此,选择性抑制COX-1能有效地减少TXA2生成,调节TXA2与前列环素的平衡。此外,选择性抑制COX-1能减轻中枢炎症,其作用机制与对前列腺素类物质生成的调节有关[10-11]。阿司匹林是临床上经典的环氧合酶抑制剂,近年来已开发出一些新的选择性COX-1抑制剂,包括吲哚布芬、三氟柳等。
3.1.1 吲哚布芬吲哚布芬是可逆性、选择性COX-1抑制剂[12],化学结构见图2。吲哚布芬最早由意大利Farmfalia Carlo Erba开发研制,于1984年在该国首先上市,此后陆续在英国、奥地利等10余个欧盟国家上市。我国卫生部于1993年批准Farmitalia Carlo Erba公司在中国销售其片剂,2005年我国本土药企也开始生产销售吲哚布芬。
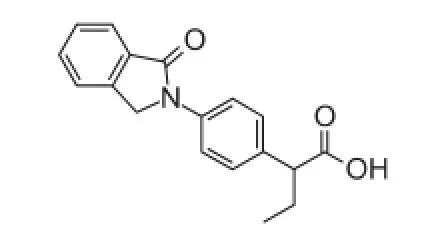
图2 吲哚布芬化学结构
通过对吲哚布芬多年的临床研究,证明其疗效确切,副作用小。一项评定吲哚布芬在短暂性脑缺血发作(transient ischemic attack,TIA)二级预防疗效的研究表明,研究者将84例既往椎基底动脉系统TIA的患者随机分为口服吲哚布芬(200 mg·d-1)治疗组或者不服用吲哚布芬对照组,结果二级缺血事件(卒中、心肌梗死、TIA、血管性死亡)的发生率,吲哚布芬组显著低于未服药对照组(9.5%vs 28.6%,P<0.025)[13]。在另一项包含55例缺血性脑血管病患者的随机双盲临床试验表明,研究者探讨了吲哚布芬抗血小板疗效及安全性,结果显示,与临床上常用的抗脑缺血药物盐酸噻氯匹定(250 mg·d-1)相比,吲哚布芬(200 mg,bid)的疗效相当,不良反应少且轻微。一项超过5000例的上市后监测研究表明,动脉粥样硬化患者口服吲哚布芬,疗程超过2个月,耐受性良好。不良反应发生率为3.9%,其中胃肠道症状占78%,包括消化不良、腹痛、便秘、恶心和呕吐等;其他依次与止血和凝血功能不良、皮肤及中枢神经系统相关[14]。
3.1.2 三氟柳(triflusal)三氟柳不可逆、特异性抑制COX-1,阻断TXA2形成[15],化学结构见图3。三氟柳抑制内皮细胞环氧合酶的抑制作用极弱,因此对前列环素生成的影响很小。三氟柳于20世纪70年代由西班牙一公司开发上市,已成为其在世界25个国家销售较好的产品之一,目前该药在我国还没有上市。
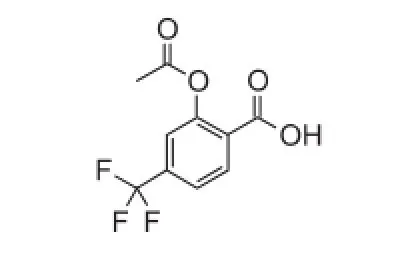
图3 三氟柳化学结构
2008年,欧洲卒中组织(European Stroke Organization,ESO)在脑卒中防治指南中,首次推荐将三氟柳合用阿司匹林与双嘧达莫,或者单用氯吡格雷对动脉粥样硬化血栓形成型脑卒中二级预防的替代用药。这项提议主要是基于名为TACIP和TAPIRSS的两项临床研究。TACIP是一项随机、双盲、多中心临床试验,包含2113名缺血性脑血管病患者,比较了三氟柳(600 mg·d-1)和阿司匹林(325 mg·d-1)对卒中及TIA患者血管事件的预防作用,联合终点事件包括非致死性缺血性脑卒中、非致死性心肌梗死及血管性疾病死亡的发生率,结果两组的联合终点发生率、各个终点事件发生率和存活率均无显著性差异,而三氟柳组出血性副作用低于阿司匹林组[16]。TAPIRSS试验病例数为431例,结果与TACIP试验一致,三氟柳与阿司匹林效果相当,出血性事件发生率明显低于阿司匹林[17]。
3.2 血栓烷合成酶抑制剂
血栓烷合成酶是TXA2生物合成的另一个关键酶,催化前列腺素H2向TXA2的转化。与环氧合酶抑制剂相比,血栓烷合成酶抑制剂直接抑制TXA2的生成,对前列环素生成的影响更小,因此血栓烷合成酶抑制剂防治缺血性脑卒中也许更具潜力。
目前临床上用于缺血性脑卒中的血栓烷合成酶抑制剂的代表药物是奥扎格雷,其化学结构见图4。奥扎格雷于1992年在日本上市,最初治疗哮喘,后来应用于临床治疗缺血性脑卒中,能减轻急性血栓性脑梗死和脑梗死所伴随的运动障碍。在一项包含3000名急性缺血性脑卒中患者的临床试验中,奥扎格雷能有效改善患者的神经功能,关于降低死亡率和致残危险性的评价还有待长期、进一步增大样本的研究[18]。另一项对奥扎格雷治疗进展性脑梗塞的疗效和安全性研究中,奥扎格雷能够有效抑制血管收缩和血小板聚集,疏通梗塞血管,恢复患者神经功能。此外,文献调研结果显示,在国内共包含690项病例的7个临床研究中,与阿司匹林相比,奥扎格雷可更有效地改善脑卒中患者的神经功能缺损症状[19],这与临床实际工作中观察到的及奥扎格雷钠在作用机制上与阿司匹林相比的优点是一致的,但是要得到更加确切的结论,仍需要更多的临床证据支持。
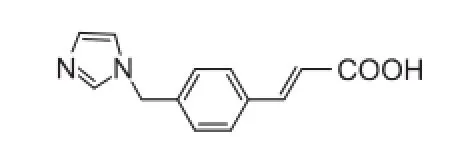
图4 奥扎格雷化学结构
本实验室研究的咪唑乙基香草酸醚(N2),是新开发的血栓烷合成酶抑制剂,化学结构与奥扎格雷类似,见图5。不同的是,临床上奥扎格雷经静脉给药,经过化学改造,N2通过口服给药,提高了患者服药的顺应性。目前的临床前研究结果表明,N2预防及治疗给药,对多种模型所致的大鼠脑缺血损伤均有明显的保护作用,包括神经保护、改善运动功能、保护血脑屏障、降低梗死率等,这可能与N2的抗凝血、抗血小板聚集、改善脑循环和抗血栓活性以及对内皮细胞和神经元的保护作用相关。本研究旨在将N2开发成为用于防治缺血性脑卒中的新型口服药物。
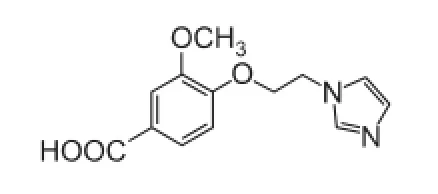
图5 N2化学结构
3.3 血栓烷受体拮抗剂
研究发现,血栓烷受体拮抗剂能减缓心脑血管疾病中的内皮损伤,抑制血栓形成,减轻炎症反应[20];防止动脉粥样硬化形成、逆转斑块和改善血管内皮功能[21]。近年来数个强力、口服、长效的血栓烷受体拮抗剂已经进入临床研究[22],其中特鲁曲班(Terutroban)是近年来研究的热点。
特鲁曲班从磺曲苯中得到,是一种口服的非前列腺素类可逆的血栓烷受体拮抗剂,化学结构见图6。临床前研究中,特鲁曲班能提高自发性高血压脑卒中大鼠的存活率,药效优于阿司匹林和瑞舒伐他汀,作用机制与抗炎和改善内皮功能有关[23-24]。一项包含30例患者的随机、双盲临床试验中,外周动脉疾病患者口服特鲁曲班,剂量为10、30 mg·d-1时,能在1 h内起效,抑制TXA2类似物U46619诱导的血小板聚集,并且未监测出不良反应的发生[25]。一项包含48名患者的随机、双盲临床研究中,探讨了特鲁曲班对脑缺血或颈动脉狭窄的病人脑卒中二级预防的作用,结果特鲁曲班抗血栓作用优于阿司匹林,与氯吡格雷-阿司匹林合用相当,且耐受性良好[26]。
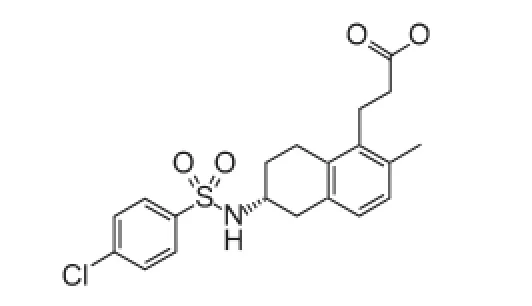
图6 特鲁曲班化学结构
另一项包含19120名血栓性脑缺血患者的临床研究,比较了特鲁曲班(30 mg·d-1)与阿司匹林(100 mg·d-1)对卒中二级预防的作用,主要终点事件包括致死或非致死缺血性脑卒中、致死或非致死性心肌梗死,以及出血性死亡的血管性疾病。结果两种药的主要终点事件发生率相似,两者的安全性无显著性差异,特鲁曲班出血副反应轻微高于阿司匹林[27-28]。
4 展望
TXA2促进缺血性脑卒中的发生和发展,其机制包括:①TXA2诱导脑部及颈部血管粥样硬化,引发缺血性脑卒中;②TXA2强烈的缩血管、促血小板聚集和血栓形成作用,加重缺血性脑卒中损伤;③TXA2上调炎性蛋白的表达,加剧炎症程度,破坏血脑屏障。因此,使用药物抑制缺血性脑卒中状态下TXA2的过度生成,或拮抗血栓烷受体过度激活,能减轻脑缺血损伤。大量的研究已经证实了环氧合酶抑制剂、血栓烷合成酶抑制剂、血栓烷受体拮抗剂对缺血性脑卒中的防治作用。开发如咪唑乙基香草酸醚(N2)等,以TXA2为靶点的新药,对于防治缺血性脑卒中有着重要的意义和价值,进一步的研究工作正在积极展开。
[1] Cameron R,Savita K.Significance of brain tissue oxygenation and the arachidonic acid cascade in stroke[J].Antioxid Redox Sign,2011,10(14):1889-903.
[2] Riondino S,Trifirò E,Principessa L,et al.Lack of biological relevance of platelet cyclooxygenase-2 dependent thromboxane A2production[J].Thromb Res,2008, 122(3):359-65.
[3] Yu Y,Ricciotti E,Grosser T,et al.The translational therapeutics of prostaglandin inhibition in atherothrombosis[J].J Thromb Haemost,2009,7(1):222-6.
[4] Nakahata N.Thromboxane A2:Physiology/pathophysiology,cellularsignaltransductionandpharmacology[J].Pharmacol Therapeut,2008,118(1):18-35.
[5] Yuhki K,Kashiwagi H,Kojima F.Roles of prostanoids in the pathogenesis of cardiovascular diseases[J].Int Angiol,2010,29(2):19-27.
[6] Yuhki K,Kojima F,Kashiwagi H.Roles of prostanoids in the pathogenesis of cardiovascular diseases:Novel insights from knockout mouse studies[J].Pharmacol Ther,2011,129(2):195-205.
[7] 朱玉萍,傅毅,刘桂冬,等.血栓素A2含量与脑梗死的相关性分析[J].上海交通大学学报,2009,29(9):1077-80.
[8] Su-Ryun K,Soo-Kyung B,Hyun-Joo P,et al.ThromboxaneA2increasesendothelialpermeabilitythrough upregulation of interleukin-8[J].Biochem Bioph Res Co,2010,397(3):413-9.
[9] Harald FL,Triantafyllos C.Platelets and neurovascular inflammation[J].Thromb Haemost,2013,110(2):1-6.
[10] Saba A,Francesca B.Targeting cyclooxygenases-1 and-2 in neuroinflammation:Therapeutic implications [J].Biochimie,2011,9(1):46-51.
[11] Rosa C,Maria P,Maria C,et al.Novel selective COX-1 inhibitors suppress neuroinflammatory mediators in LPS-stimulated N13 microglial cells[J].Pharmacol Res,2012,65(1):137-48.
[12] 吴昊,毕齐.吲哚布芬在抗血小板治疗中的临床应用[J].中国卒中杂志,2013,8(9):773-6.
[13] 张栩,孙兆林.辛贝-吲哚布芬片抗血小板聚集作用的研究[J].湖南中医药大学学报,2010,30(10):12-4.
[14] 马捷,姜文清,曹国颖.辛贝[J].中国新药杂志,2006,15(16):1406-8.
[15] 杨明山.抗血小板聚集药物防治缺血性卒中研究进展[J].医药导报,2009,28(2):140-5.
[16] Culebras A,Rotta-Escalante R,Vila J,et al.Triflusal vs aspirin for prevention of cerebral infarction:a randomizedstrokestudy[J].Neurology,2004,62(7): 1073-80.
[17] Matías-Guiu J,Ferro JM,Alvarez-Sabín J,et al. Comparison of triflusal and aspirin for prevention of vascular events in patients after cerebral infarction: the TACIP Study:a randomized,double-blind,multicenter trial[J].Stroke,2003,34(4):840-8.
[18] Félétou M,Vanhoutte PM,Verbeuren TJ.The thromboxane/endoperoxide receptor(TP):the common villain [J].J Cardiovasc Pharmacol,2010,55(4):317-32.
[19] 王文浩.奥扎格雷钠与阿司匹林治疗急性脑梗死疗效比较的meta分析[D].石家庄:河北医科大学,2010.
[20] Carter PR,McElhatten RM,Zhang S.Thromboxaneprostanoid receptor expression and antagonism in dextran-sodium sulfate-induced colitis[J].Inflamm Res, 2011,60(1):87-92.
[21] Malloy RJ,Kanaan AO,Silva MA,et al.Evaluation ofantiplateletagentsforsecondarypreventionof stroke using mixed treatment comparison meta-analysis [J].Clin Ther,2013,35(10):1490-500.
[22] Davì G,Santilli F,Vazzana N.Antiplatelet agents[M]. Springer:Berlin,2012:261-86.
[23] Paolo G,Rossana B,Cristina B,et al.Terutroban,a thromboxane/prostaglandin endoperoxide receptor antagonist,increases survival in stroke-prone rats by preventingsystemicinflammationandendothelialdysfunction:comparison with aspirin and rosuvastatin[J].J Pharmacol Exp Ther,2010,334(1):199-205.
[24] Giannarelli C,Zafar MU,Badimon JJ.Prostanoid and TP-receptors in atherothrombosis:is there a role for their antagonism[J].Thromb Haemost,2010,104(5): 949-54.
[25] Gaussem P,Reny JL,Thalamas C,et al.The specific thromboxane receptor antagonist S18886:pharmacokineticandpharmacodynamicstudies[J].JThromb Haemost,2005,3(7):1437-45.
[26] Bal Dit Sollier C,Crassard I,Simoneau G,et al.Effect of the thromboxane prostaglandin receptor antagonist terutroban on arterial thrombogenesis after repeated administration in patients treated for the prevention of ischemic stroke[J].Cerebrovasc Dis,2009,28(5): 505-13.
[27] BousserMG,AmarencoP,ChamorroA,etal. Terutroban versus aspirin in patients with cerebral ischaemic events(PERFORM):a randomised,doubleblind,parallel-group trial[J].Lancet,2011,377(9782): 2013-22.
[28] MengL,BruceO.Vasculareventsafterstroke: terutroban fails to PERFORM[J].Lancet,2011,377 (9782):1980-2.
Thromboxane A2-a New Target of Drugs against Cerebral Ischemic Stroke*
ZHOU Yi,FANG Wei-rong,LI Yun-man**
Department of Physiology,China Pharmaceutical University,Nanjing 210009,China
Thromboxane A2(TXA2),a product in arachidonic acid(AA)metabolism,is synthesized by thromboxane synthetase from prostaglandin endoperoxides.TXA2elicits strong effects in platelet aggregation and vascular smooth muscle contraction,further plays a role in thrombus formation and vascular tense regulation.Based on these biological effects,TXA2is involved in the pathology of cerebral ischemic stroke, and studies have proved the benefits of TXA2-targeting agents in the prevention and treatment of cerebral vascular disease.This review is to investigate the mechanism in which TXA2affects cerebral ischemic stroke,and then to introduce and summarize TXA2-targeting agents that protect against cerebral ischemia.
Thromboxane A2;Cerebral ischemic stroke;Thromboxane synthetase inhibitor;Cyclooxygenase inhibitor;TXA2receptor inhibitor
R743.3;973+.2
A
1673-7806(2014)03-246-05
国家“重大新药创制”科技重大专项(No.2012ZX094)
周祎,女,硕士生 E-mail:zg.zhouyi@163.com
**通讯作者 李运曼,女,教授,博士生导师,研究方向:药理学
E-mail:yucaoren@sina.com
2014-02-20
2014-03-07

