超声复合酶法提取大蒜多糖的工艺优化
贯云娜 吴 昊 杨绍兰 王成荣
GUAN Yun-na WU Hao YANG Shao-Lan WANG Cheng-rong
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
(College of Food Science and Engineering,Qingdao Agricultural University,Qingdao,Shandong 266109,China)
大蒜为百合科葱属植物蒜的鳞茎,含有多种营养物质,具有药、食、保健等多种功效,大蒜多糖是其主要活性成分之一[1]。近年来国内外研究[2,3]表明,大蒜多糖具有抗菌消炎、抗血凝、降血脂、防止动脉粥样硬化、保护肝脏、抗肿瘤、调节机体免疫力和抗衰老等作用。大蒜中多糖含量较高且较稳定,中国具有丰富的大蒜资源,因此采用合适的提取方法提取大蒜多糖具有非常重要的意义。
目前,大蒜多糖的提取方法多为传统热水浸提法[4,5],此法虽然操作简单,但存在提取时间长、提取温度高等缺点[6]。近年来,用于植物活性物质提取的绿色新技术包括超临界流体萃取[7]、微波辅助提取[8]和超声波辅助提取[9-11]等。与前两种提取方法相比,超声波能够产生和传递强大的能量,加速物质中分子的运动[12],可以在较低的温度下作用,有利于植物细胞中有效成分的转移和扩散;与传统热水浸提法相比,有提取时间短、提取效率高、能耗低和环保等优势[13],近年来已被广泛用于多糖提取。另一方面,细胞壁降解酶类具有水解原果胶、纤维素和糖蛋白的作用[14],复合酶提取由于其具有反应条件温和、提取时间短、成本较低等优势也被逐渐应用到多糖的提取[15,16]。
陈瑞平[15]等曾研究了复合酶提取大蒜多糖的工艺条件,并确定的最佳酶配比为纤维素酶∶木瓜蛋白酶∶果胶酶=1∶60∶5。但目前未见针对超声波与复合酶同时作用于大蒜多糖提取的研究报道。本试验在前期预试验(确定复合酶配比:果胶酶22.5 U/g、木瓜蛋白酶160 U/g、纤维素酶96 U/g)的基础上,拟以大蒜多糖得率为指标,利用响应面分析法优化超声辅助复合酶法提取大蒜多糖的工艺条件。
1 材料与方法
1.1 试剂与材料
大蒜:购于青岛城阳大润发超市;
果胶酶:3万U/g,天津利华酶制剂技术有限公司;
木瓜蛋白酶:20万U/g,天津利华酶制剂技术有限公司;
纤维素酶:4万U/g,天津利华酶制剂技术有限公司;
葡萄糖、无水亚硫酸钠、苯酚、酒石酸钾钠、氢氧化钠:浓硫酸、丙酮、无水乙醇、95%无水乙醇:均为国产分析纯;
3,5-二硝基水杨酸:化学纯,天津市巴斯夫化工有限公司;
透析袋:截留分子量8 000~14 000,北京博奥拓达科技有限公司。
1.2 仪器与设备
电子分析天平:AR2410型,奥豪斯国际贸易(上海)有限公司;
组织捣碎匀浆机:JJ-2(2003-61)型,常州国华电器有限公司;
恒温超声提取仪:SY-1000E型,北京弘祥隆生物技术开发有限公司;
紫外-可见分光光度计:745型,上海光谱仪器有限公司;
离心机:TDL-5000B型,上海安亭科学仪器厂;
旋转蒸发仪:RE-52AA系列,上海亚荣生化仪器有限公司;
循环水式多用真空泵:SHB-Ⅲ型,郑州长城科工贸有限公司;
电热恒温水浴锅:DK-S28型,上海市精宏实验仪器有限公司;
电热恒温鼓风干燥箱:DHG-9036A型,上海市精宏实验仪器有限公司;
真空冷冻干燥机:ALPHA1-2LDplus型,德国 Christ公司。
1.3 超声复合酶法提取大蒜多糖的工艺流程
大蒜瓣→去皮、去蒂、打浆→转入超声波萃取釜(添加复合酶搅拌均匀,按液料比补足水)→超声波复合酶法提取大蒜多糖→灭酶(提取液在90℃水浴中处理30 s)[17]→过滤→4 000 r/min离心15 min→50℃旋转蒸发浓缩(至原来体积的1/3)→4倍体积无水乙醇沉淀→依次用质量分数为95%乙醇、丙酮和无水乙醇洗涤沉淀[18]→加水复溶、透析袋透析48 h→真空冷冻干燥→大蒜粗多糖
1.4 热水浸提法提取大蒜多糖工艺及参数
新鲜大蒜→脱脂→破碎→热水浸提(温度83.57℃、料水比1∶6.97(m∶V)、时间205.48 min[19])→过滤→滤液离心→上清液浓缩
1.5 试验设计
1.5.1 单因素试验设计
(1)超声功率对大蒜多糖得率的影响:准确称取5份100 g新鲜去皮大蒜,加入适量水打浆,按液料比为6∶1(V∶m)补足水,按最佳复合酶配比加入复合酶,设定得超声温度为50℃,提取时间为20 min,采用5个超声功率(300,400,500,600,700 W)提取大蒜多糖,经灭酶、过滤、离心后测定大蒜多糖含量,计算多糖得率。
(2)超声温度对大蒜多糖得率的影响:准确称取5份100 g新鲜去皮大蒜,加入适量水打浆,按液料比为6∶1(V∶m)补足水,按最佳复合酶配比加入复合酶,设定超声波功率为400 W,提取时间为20 min,采用5个超声温度(40,45,50,55,60℃)提取大蒜多糖,经灭酶、过滤、离心后测定大蒜多糖含量,计算多糖得率。
(3)液料比对大蒜多糖得率的影响:准确称取5份100 g新鲜去皮大蒜,加入适量水打浆,按最佳复合酶配比加入复合酶,设定超声功率为400 W,超声温度为50℃,提取时间为20 min,采用5个液料比(4∶1,6∶1,8∶1,10∶1,12∶1(V∶m))补足水提取大蒜多糖,经灭酶、过滤、离心后测定大蒜多糖含量,计算多糖得率。
(4)提取时间对大蒜多糖得率的影响:准确称取5份100 g新鲜去皮大蒜,加入适量水打浆,按液料比为8∶1(V∶m)补足水,按最佳复合酶配比加入复合酶,设定超声波功率为400 W,超声温度为50℃,采用5个提取时间(5,10,15,20,25 min)提取大蒜多糖,经灭酶、过滤、离心后测定大蒜多糖含量,计算多糖得率。
1.5.2 响应面试验设计 在单因素试验结果的基础上,以多糖得率为指标,以超声功率、超声温度、液料比和提取时间4个因素为自变量,试验设计和数据处理使用Design-Expert 8.0.5软件,采用BBD试验设计,设计四因素三水平共29个试验点的响应面分析试验。
1.6 大蒜多糖的质量测定
采用苯酚-硫酸法[20]测定总糖质量,3,5-二硝基水杨酸法[21]测定还原糖质量,按式(1)计算大蒜多糖质量:

式中:
m1—— 多糖质量,mg;
M1—— 总糖质量,mg;
M2—— 还原糖质量,mg。
1.7 大蒜多糖的得率测定

式中:
R—— 多糖得率,%;
m1—— 多糖质量,mg;
m2—— 原料质量(鲜重),mg。
2 结果与分析
2.1 响应面优化试验
2.1.1 响应面优化试验方案 在单因素试验结果的基础上,采用四因素三水平的Box-Behnken设计试验方案,因素及水平见表1。
2.1.2 响应面试验结果与分析 为研究各工艺参数之间的交互作用对大蒜多糖得率的影响,按照表2的试验方案设计进行试验,结果见表2。
以大蒜多糖得率为响应值,经回归拟合后,各试验因子对响应值的影响用下列函数表示:
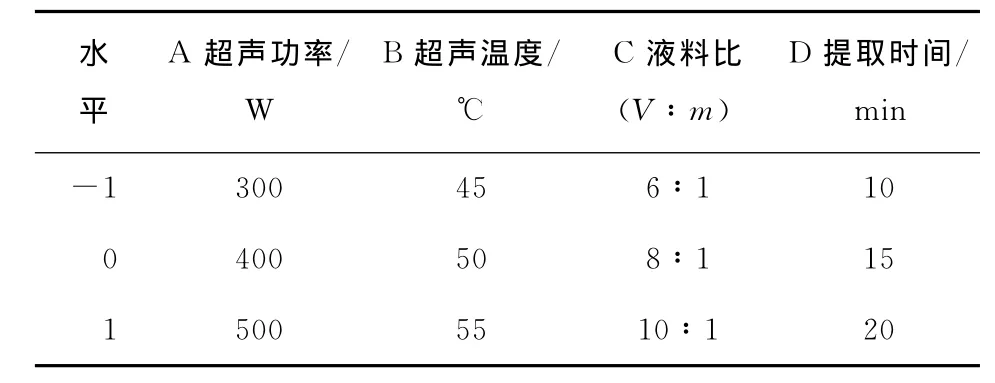
表1 Box-Behnken设计因素水平表Table 1 Factors and levels in BBD

表2 43中心组合试验设计及结果Table 2 43 Box-Behnken design and experimental data for the responses

对回归方程进行方差分析,结果见表3。
表3 方差分析Table 3 Analysis of variance for quadric regression model
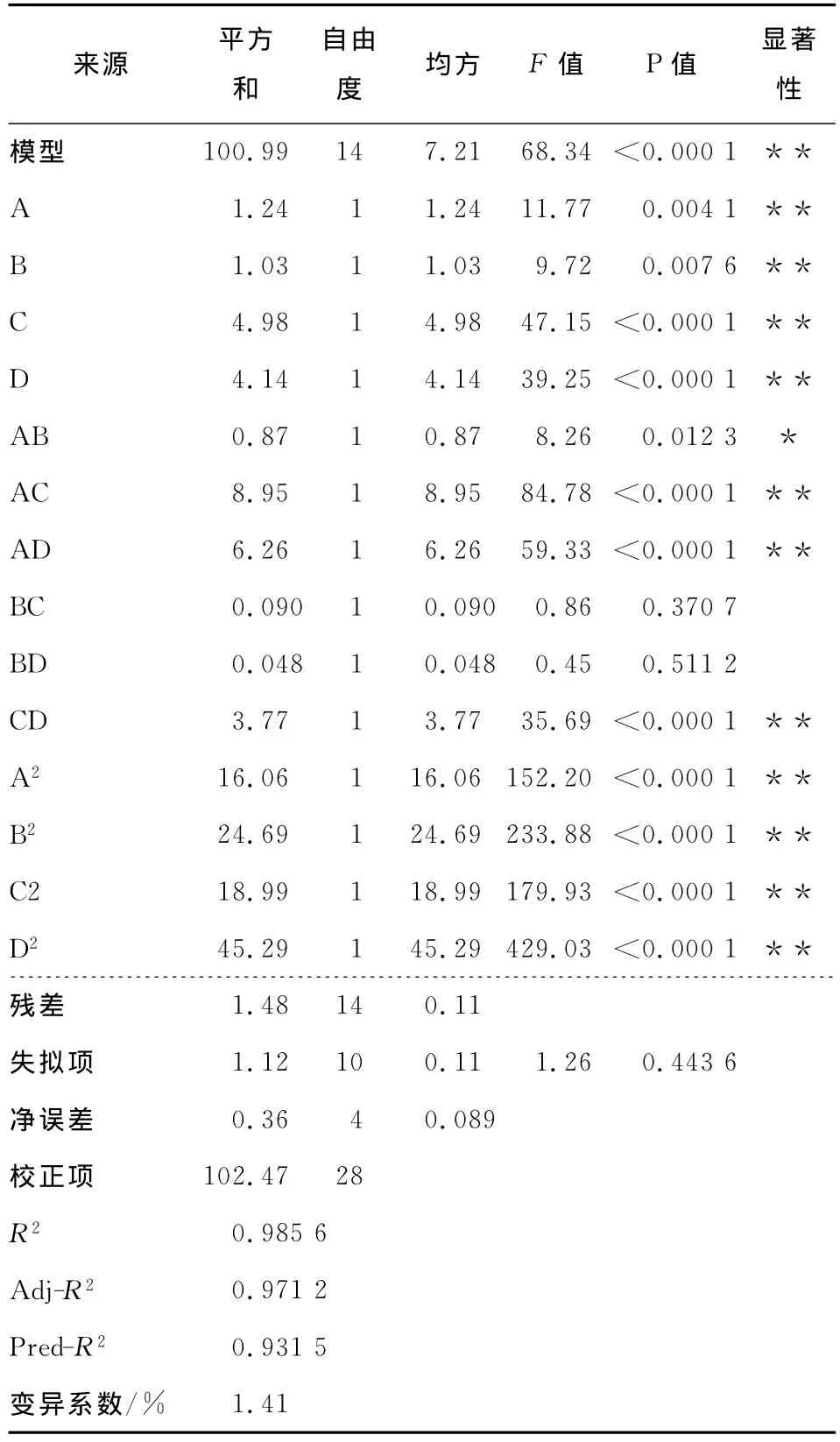
表3 方差分析Table 3 Analysis of variance for quadric regression model
Prob>F<0.01极显著**;Prob>F<0.05显著*。
来源 平方和自由度 均方 F值 P值 显著性模型 100.99 14 7.21 68.34 <0.000 1 **A 1.24 1 1.24 11.77 0.004 1 **B 1.03 1 1.03 9.72 0.007 6 **C 4.98 1 4.98 47.15 <0.000 1 **D 4.14 1 4.14 39.25 <0.000 1 **AB 0.87 1 0.87 8.26 0.012 3 *AC 8.95 1 8.95 84.78 <0.000 1 **AD 6.26 1 6.26 59.33 <0.000 1 **BC 0.090 1 0.090 0.86 0.370 7 BD 0.048 1 0.048 0.45 0.511 2 CD 3.77 1 3.77 35.69 <0.000 1 **A 2 16.06 1 16.06 152.20 <0.000 1 **B2 24.69 1 24.69 233.88 <0.000 1 **C2 18.99 1 18.99 179.93 <0.000 1 **D2 45.29 1 45.29 429.03 <0.000 1 **残差 1.48 14 0.11失拟项 1.12 10 0.11 1.26 0.443 6净误差 0.36 4 0.089校正项 102.47 28 R 2 0.985 6 Adj-R 2 0.971 2 Pred-R 2 0.931 5变异系数/% 1.41
由表3可知,模型R2=0.985 6,表明方程的自变量A、B、C、D与响应值Y之间线性关系拟合性较好。本试验所建模型中各单因素的一次项、二次项、交互项中AB、AC、AD、CD均达到显著水平(P<0.05),其中 C、D、A2、B2、C2、D2、AC、AD、CD 达 到 极 显 著 水平(P<0.000 1)。(Adj-R2-Pre-R2)<0.2,说明此模型准确度高[23],变异系数(C.V.)<5%说明此模型的重现性较好[18]。综合来看采用此回归模型是合理的,可以用该方程预测不同提取条件下的大蒜多糖得率。
2.1.3 模型分析 通过响应面三维图可直观地反映4个因素(超声功率、超声温度、液料比和提取时间)的交互作用对大蒜多糖得率的影响,固定其中2个因素,绘制其余2个因素对响应值影响的等高线图和响应面图,见图1~6。
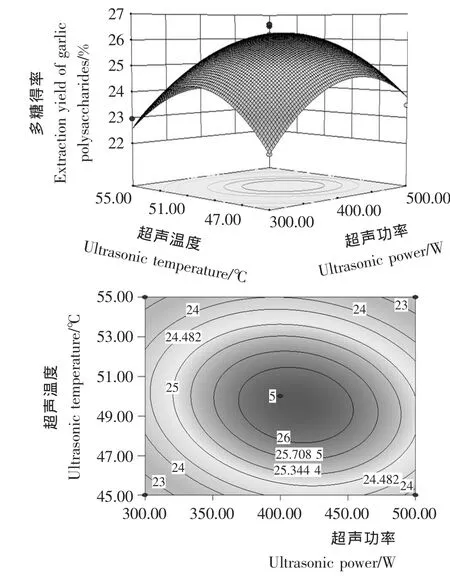
图1 超声功率与超声温度的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 1 Response surface diagram and contour plot of correlative effects of ultrasonic power and ultrasonic temperature on garlic polysaccharides

图2 超声功率与液料比的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 2 Response surface diagram and contour plot of correlative effects of ultrasonic power and liquid to solid ratio on garlic polysaccharides
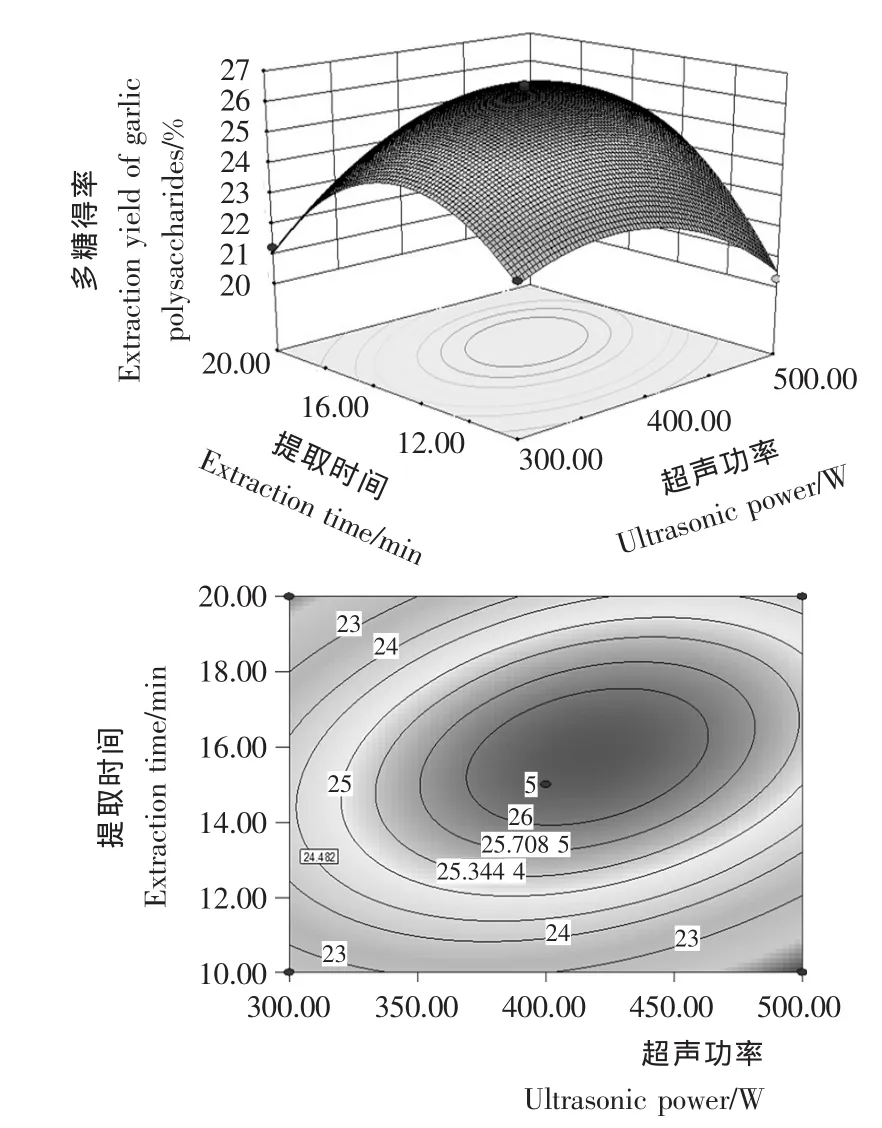
图3 超声功率与提取时间的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 3 Response surface diagram and contour plot of correlative effects of ultrasonic power and extraction time on garlic polysaccharides
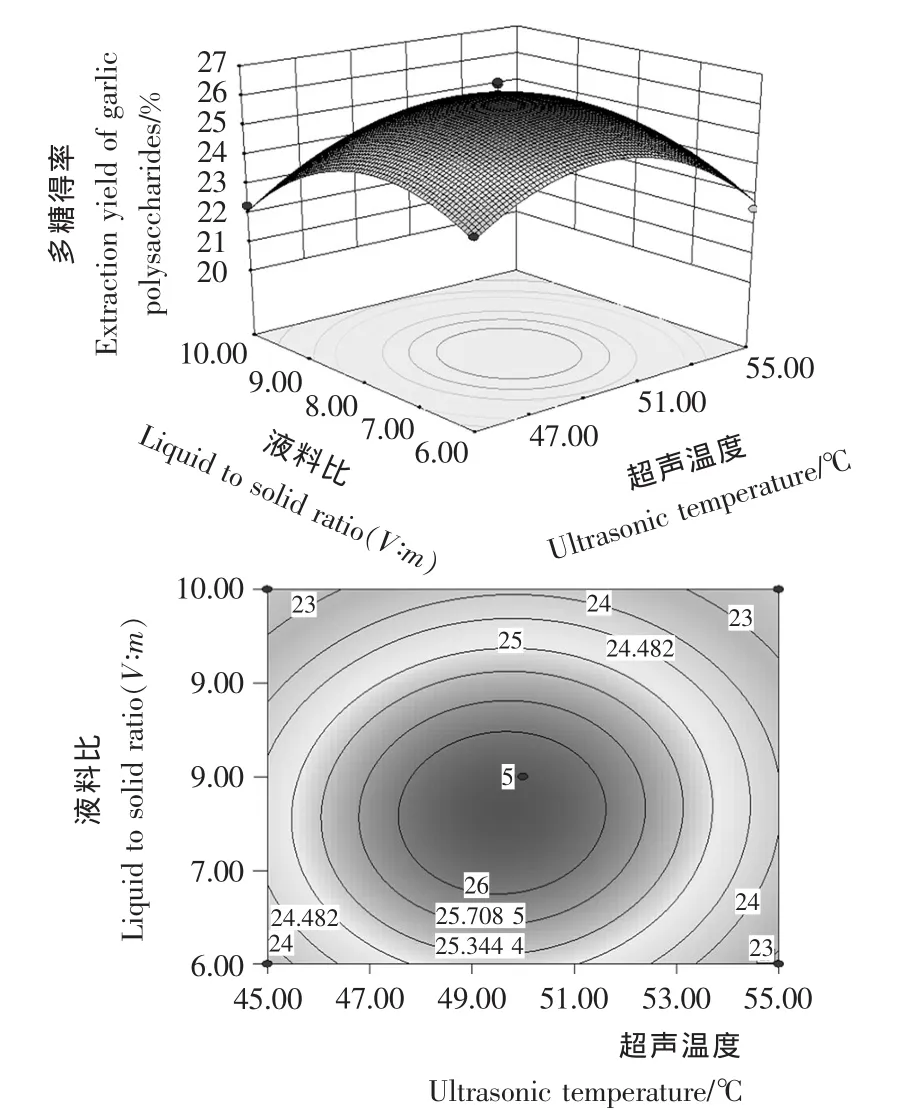
图4 超声温度与液料比的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 4 Response surface diagram and contour plot of correlative effects of ultrasonic temperature and liquid to solid ratio on garlic polysaccharides
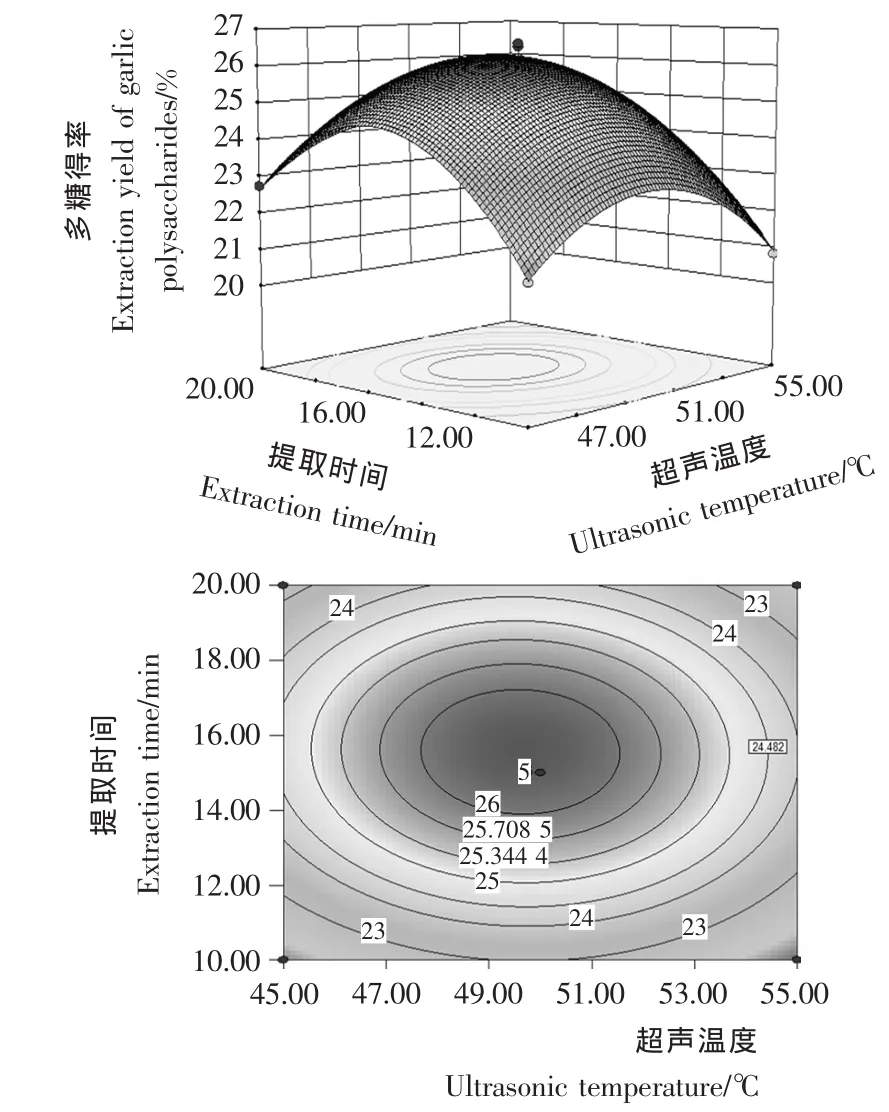
图5 超声温度与提取时间的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 5 Response surface diagram and contour plot of correlative effects of ultrasonic temperature and extraction time on garlic polysaccharides
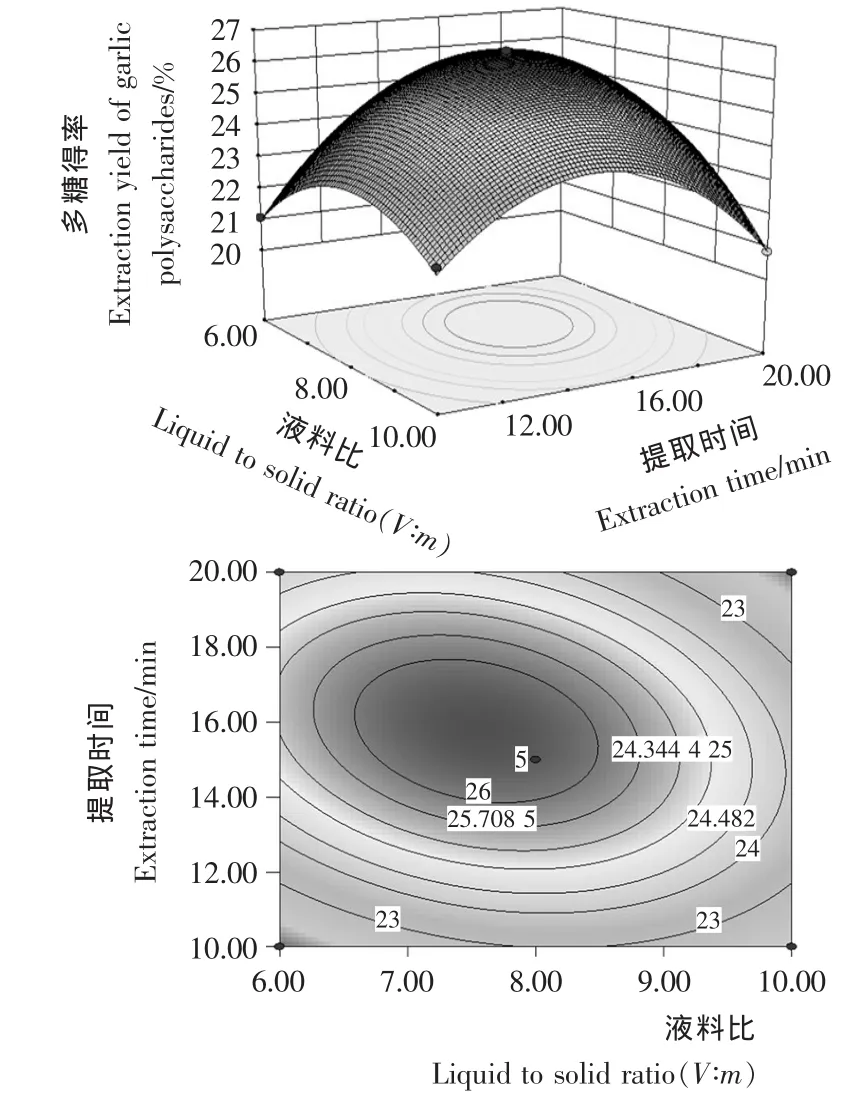
图6 液料比与提取时间的交互作用对大蒜多糖得率影响的响应面图和等高线图Figure 6 Response surface diagram and contour plot of correlative effects of liquid to solid ratio and extraction time on garlic polysaccharides
由图1~6可知,在所选的两因素范围内响应面图存在最高点,即大蒜多糖得率极值。
2.2 优化工艺参数的验证
据所建立的数学模型进行参数最优化分析,得到预测最佳工艺条件:超声功率408.92 W,超声温度49.51℃,液料比7.6∶1(V∶m),提取时间15.86 min,此时大蒜多糖的得率为26.39%。由于试验条件无法完全按照优化条件进行,故稍加修改:超声功率400 W,超声温度49.5℃,液料比7.6∶1(V∶m),提取时间16 min,重复验证实验3次,此时大蒜多糖的平均得率为26.12%。在显著性水平P<0.05前提下,预测值与实际值无显著性差异。预测值和真实值之间有很好的拟合性,说明了此模型的可靠性。
3 结论
本试验利用响应面Box-Behnken设计优化了超声复合酶法提取大蒜多糖的最佳工艺条件,建立了提取大蒜多糖的参数方程,由响应面试验确定的较适宜提取工艺为超声波功率400 W,超声温度49.5℃,液料比7.6∶1(V∶m),提取时间16 min,在此优化工艺条件下多糖得率为26.12%,与模型预测值基本一致,比传统热水提取多糖得率[19](鲜蒜的多糖得率15.05%)提高了74%,大大缩短了提取时间(传统热水浸提法为205.48 min,本试验仅为16 min)。
此外,本试验将超声波与复合酶共同作用应用到大蒜多糖的提取,结果显示大蒜多糖得率明显高于传统水提法和复合酶提取法,但其机理尚不明确,目前报道的也只是一些猜测性的理论[24,25],需要进行研究和论证。
1 王文玲,黄雪松,曾莉莎.大蒜多糖的研究综述[J].广州食品工业科技,2001,20(4):144~146.
2 Bianchini F,Vainio H.Allium vegetables and organosulfur compounds:do they help prevent cancer?[J].Environ Health Prespect,2001,109(9):893~902.
3 刘紫全,黄群莲,何光风.大蒜的药用研究[J].食品与药品,2006,8(8):24~26.
4 Lai L S,Yang D H.Rheological properties of the hot-water extracted polysaccharides in Ling-Zhi(Ganoderma lucidum)[J].Food Hydrocolloids,2007,21(5~6):739~746.
5 Zhu M Y,Wang C J,Gu Y,et al.Extraction,characterization of polysaccharides from Morinda officinalis and its antioxidant activities[J].Carbohydrate Polymers,2009,78(3):497~501.
6 Wang Y J,Cheng Z,Mao J W,et al.Optimization of ultrasonicassisted extraction process of Poria cocos polysaccharides by response surface methodology[J].Carbohydrate Polymers,2009,77(4):713~717.
7 Turner C,King J W,Mathiasson L.Supercritical fluid extraction and chromatography for fat-soluble vitamin analysis[J].Journal of Chromatography A,2001,936(1):215~237.
8 Wang J,Zhang J,Zhao B,et al.A comparison study on micro-wave-assisted extraction of Potentilla anserina L.polysaccharides with conventional method:Molecule weight and antioxidant activities evaluation[J].Carbohydrate Polymers,2010,80(1):84~93.
9 Lai F,Wen Q,Li L,et al.Antioxidant activities of water-soluble polysaccharide extracted from mung bean(Vigna radiata L.)hull with ultrasonic assisted treatment[J].Carbohydrate Polymers,2010,81(2):323~329.
10 Ying Z,Han X,Li J.Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J].Food Chemistry,2011,127(3):1 273~1 279.
11 杨国伟,危晴,刘卉,等.超声波辅助提取锁阳多糖的工艺研究[J].食品与机械,2013,29(3):141~144.
12 Zhang Ying,Wang Zhenyu,Chen Xiaoqiang.Ultrasound associated extraction of seed oil of Korean pine[J].Journal of orestry Research,2005,16(2):140~142.
13 马亚琴,叶兴乾,吴厚玖,等.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010,31(21):459~462.
14 王洪伟,崔崇士.南瓜多糖复合酶法提取及纯化的研究[J].食品科学,2007,28(8):247~249.
15 陈瑞平,陈瑞站,张敏,等.复合酶法提取大蒜多糖及其抗氧化活性研究[J].分子科学学报,2012,28(1):47~52.
16 杨蓉生,陈炼红,唐俊妮,等.复合酶法提取红雪茶粗多糖工艺优化研究[J].食品工业科技,2012,33(12):285~287.
17 Yang Y-C,Li J,Zu Y-G,et al.Optimisation of microwave-assisted enzymatic extraction of corilagin and geraniin from Geranium sibiricum Linne and evaluation of antioxidant activity[J].Food Chemistry,2010,122(1):373~380.
18 Zhang Q A,Zhang Z Q,Yue X F,et al.Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder[J].Food Chemistry,2009,116(2):513~518.
19 蒋秋燕.大蒜中性多糖的提取、纯化及其性质研究[D].泰安:山东农业大学,2003.
20 王瑞海,柏冬,刘丽梅.比色法测定大蒜多糖提取物中总多糖含量[J].中国实验方剂学杂志,2012,18(10):158~161
21 李宏高,魏利军.南瓜多糖测定方法的探讨[J].陕西科技大学学报,2010,28(12):59~61.
22 Khizar H,Sarfraz H.Optimized microwave extraction of phenolic acids from citrus mandarin peels and evaluation of antioxidant activity in vitro[J].Separation and Purification Technology,2009(70):63~70.
23 Erbay Z,Icier F.Optimization of hot air drying of olive leaves using response surface methodology[J].Journal of Food Engineering,2009,91(4):533~541.
24 刁文超,王然,王凤舞,等.超声波协同复合酶法提取南瓜多糖工艺优化[J].食品科学,2012,33(18):14~20.
25 黄秀香,覃玥,黄艳梅.半枝莲多糖提取工艺优化[J].食品与机械,2013,29(2):126~129.

