食品中亚硝酸盐检测方法研究进展
刘晓军 蔡玉文 胡 强 郑冬云
LIU Xiao-jun CAI Yu-wen HU QiangZHENG Dong-yun
(中南民族大学生物医学工程学院,湖北 武汉 430074)
(College of Biomedical Engineering,South-central University for Nationalities,Wuhan,Hubei 430074,China)
亚硝酸盐是许多国家允许使用的食品添加剂,不但能使食品的色泽鲜艳,还能防腐。但长期大量食用含有亚硝酸盐的食物,可对人体的健康构成潜在的威胁,可引起食管癌、胃癌、肝癌和大肠癌。此外,许多研究[1-3]表明:亚硝酸盐可能与人类先天畸形的发生有关,特别是中枢神经系统先天畸形高发的重要原因之一。而中国是出生缺陷高发国家,中国北方广大地区是属于世界上神经管畸形发生率最高的地区,而这些高发地区与该地区食物中较高的亚硝酸盐含量密切相关[4-6]。因此,实现食品中亚硝酸盐含量的准确测定是一个备受关注的研究课题。
1 亚硝酸盐的检测方法
由于亚硝酸盐在碱性环境中容易被氧化,在酸性介质中易形成HNO2,再进一步分解。并且它既具有氧化性又具有还原性,在检测过程如果遇到氧化还原性物质可能形成干扰,这就对检测方法的选择性和灵敏度提出了不小的挑战。目前根据NO、NO、NO等含氮化合物之间可发生的反应和相互转化(见图1)[7],探究出了许多亚硝酸盐的检测方法,常见的有紫外光度法、荧光光度法、高效液相色谱法、离子色谱法、毛细管电泳法、电化学法等。

图1 含氮化合物之间相互转化常见的反应途径Figure 1 The common reactions between nitrogen compounds
1.1 光度法
1.1.1 紫外可见光度法 Griess反应分析法[8]是目前国内外普遍使用也是最早发现的检测亚硝酸盐的方法。Griess反应分析法是在酸性条件下,将NO与Griess试剂中的对氨基苯磺酸反应,生成重氨盐(见图1中路线②),然后再与N-(1-萘基)-乙二胺偶联生成红色染料(见图2)。该染料在543 nm处有最大吸收,可以用光度法进行测定。Griess法的检测限可达到0.02~2μM,而且具有很高的灵敏度。然而,该反应所需试剂本身都是毒性很大的致癌物质,并且显色反应的稳定性比较差,同时测定 Cu2+、Fe2+、S2-、I-等都有干扰。该方法的优点是回收率高,重现性好,而且操作简便,适应于生产单位常规测定,但在复杂介质中测定会受到影响。

图2 紫外可见光度法检测亚硝酸盐Figure 2 The detection of nitrite use ultraviolet-visible spectrophotometry
张妮[9]根据Fe2+可以被亚硝酸盐显著氧化的特性,利用紫外可见分光光度法建立了一种可测定香肠中亚硝酸盐的催化动力学的新方法。该方法测定的最优化条件:Fe2+初始浓度0.002 mol/L,Cl-浓度0.04 mol/L,苯酚初始浓度0.064 mol/L,测 定 波 长 480 nm,p H 值 2.5,反 应 时 间50 min,反应温度25℃。此条件下,该方法的线性范围为0.1~1.2μg/m L,回收率为95%~98.5%。结果表明,该方法选择性、准确度和精密度比较高,干扰比较小,可准确的测定香肠中亚硝酸盐的含量。
1.1.2 荧光光度法 该法是通过检测各种能与亚硝酸根反应,形成一种具有荧光发光性质的化合物,来检测亚硝酸盐。据Lapat等[10]报道,2-氨基-4-氯-6-磺酸苯酚和4-氨基荧光素均能与亚硝酸根反应,生成具有荧光发光性质的化合物(见图3)。该化合物可在608 nm(495 nm激发)和518 nm(492 nm激发)下有强烈的荧光发光信号。该方法的优点是灵敏度高、取样量少、线性范围宽,可以有效地检测NO,且不受检测液本身颜色和浑浊的干扰,也不受样品稀释度的影响,但是操作较为复杂,对环境因素敏感,适用范围窄。
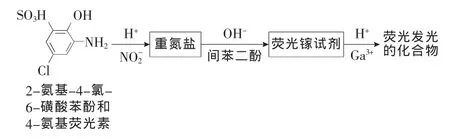
图3 荧光光度法检测亚硝酸盐Figure 3 The detection of nitrite use fluorescence spectrophotometry
黄克靖等[11]以石墨烯为吸附剂,制备固相萃取柱,建立了一种测定亚硝酸盐的新型荧光光谱法。该方法以8-(3′,4′-二氨基苯)-二氟化硼-二吡咯甲烷为荧光探针,在温度为30℃的酸性条件下,与亚硝酸根反应15 min后,生成了荧光衍生产物。经固相萃取该衍生产物后,采用荧光光度法测定。该法的线性范围在0.2~200 nmol/L。当信噪比等于3时,该方法的检出限为0.08 nmol/L。将该方法用在肉类和蔬菜中测亚硝酸盐含量,加标回收率为94.0%~110.4%。该方法具有选择性好,灵敏度高,检测快速等优点。
1.2 色谱法
1.2.1 高效液相色谱法 该法是以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,各成分在柱内被分离后,进入检测器进行检测,从而达到对试样的分析。高效液相色谱法具有高效、高速、灵敏度高、操作方便等优点。吴富忠等[12]建立了一种蔬菜、水果及其制品中亚硝酸盐与硝酸盐的高效液相色谱同时测定的方法。该方法通过样品中亚硝酸盐与硝酸盐用超纯水浸提,经活性炭脱色后过滤,滤液经0.45μm水相膜过滤后进样,在Phenomnenex SAX色谱柱上,以0.01 mol/L磷酸二氢钾为流动相进行分离,205 nm检测,外标法定量。该方法最低检出量分别是亚硝酸盐氮0.1 mg/kg,硝酸盐氮0.07 mg/kg。样品加标回收率,亚硝酸盐为91.0%~101.9%,硝酸盐为94.7%~106.0%,RSD<5%。该方法速度快,干扰少,结果准确,操作较简单,灵敏度高,可用于蔬菜、水果及其制品中亚硝酸盐与硝酸盐的测定。
1.2.2 离子色谱法 该法是液相色谱法的一种,主要是将试样进行沉淀,再采取相应方法进行提取和净化,利用离子交换原理,连续对各种离子进行定量和定性的分析。蔡荟梅等[13]建立了一种离子色谱法测定茶叶中硝酸盐和亚硝酸盐的分析方法。该方法是将样品通过超声提取后,用PVPP吸附和固相萃取柱净化的方法进行前处理,经高容量阴离子交换柱分离,用抑制型电导检测器进行检测。该方法样品中硝酸盐和亚硝酸盐的回收率范围分别为88.6%~107.5%和89.3%~101.2%,相对标准偏差(RSD)为1.67%和1.13%。该方法测定硝酸根和亚硝酸根具有操作简便、准确性高、测定快捷的优点。
目前几乎所有的色谱方法都已被用于研究亚硝酸盐的检测。通过对样品的预处理后,再进行直接检测或是将样品衍生化后间接测定,这是色谱分析方法检测硝酸盐的主要思路。还有一种常用的样品衍生化方法是用过氧化氢将NO氧化成NO,然后再与含活性芳环的试剂如2,4-二甲基苯酚[14]和1,3,5-三甲氧基苯[15]等进行硝基化反应把NO转化成亲电的NO来进行检测。另一种方法是通过卤代烷烃的亲核取代反应将亚硝酸根转化成硝基化合物。五氟溴苯(PFB)即可将亚硝酸根转化成相应的硝基化合物[16]。GCMS结果显示(见图4),既能看到NO的分子离子峰,又能看到微弱的甲基-硝基键的断裂。除了与质谱联用,将色谱分离技术与紫外[17]、荧光[18]、电化学分析[19]等 检测手段联用,均可达到有效检测亚硝酸根的目的。
1.3 毛细管电泳法
与上述方法相比,毛细管电泳法的突出优势在于可以实现自动化控制的快速、同时检测并且试剂用量比较少,分析化合物种类广泛。Merusi等[20]建立了一种可以同时测定硝酸根、亚硝酸根和草酸根的新型毛细电泳法。该方法采用烙融石英毛细管柱(75μm ×32.5 cm,有效长度为21.5 cm)作为分离通道,以50μM磷酸盐(p H=2.5)作为运行缓冲液,毛细管柱温25℃,运行电压25 k V,检测波长214 nm,进样压力3.5 k Pa,外标法定量测定。该方法亚硝酸盐、硝酸盐和草酸盐的检测限分别为0.8,0.3,4.5 mg/L,相关系数均大于0.999。该方法适用于测定蔬菜硝酸根、亚硝酸根和草酸根的含量。

图4 通过五氟溴苯的亲核取代反应来检测亚硝酸盐的GC-MS方法Figure 4 The detection to nitrite method of GC-MS through five fluorine bromobenzenenucleophilic substitution reaction
姜廷福等[21]在测定腌菜中的硝酸根和亚硝酸根时,是以溴离子为内标,建立了一种毛细血管离子电泳同时测定的方法。讨论了缓冲溶液的p H值、样品和缓冲溶液NaCl浓度、分离电压对分离的影响。该方法在缓冲溶液为p H=3.5作为背景电解质条件下,硝酸根和亚硝酸根的检出限分别为0.01,0.03 mg/kg。
1.4 电化学传感法
1.4.1 电位型传感器 电位型传感器是将溶解在电解质溶液中的离子作用于离子电极而产生的电动势作为检测对象,从而实现对离子的检测。目前研究最多的是离子选择性电极,它能以电极电位形式指示溶液中特定离子的活度。因其具有结构简单、灵敏度好、选择性高、响应速度快、易于携带等特点,可以有效地检测低浓度的亚硝酸盐。从早期的PVC膜[22]到现在广 泛 使 用 的 TDABr膜[23]、TDAN 膜[24]均 可 以作为离子交换膜,与可作为增塑剂的二丁基邻苯二甲酸盐(DBP)、o-硝基苯辛基醚(o-NPOE)[25]结合使用可以制得性能优良的亚硝酸根离子选择性电极。
1.4.2 电流型传感器 电流型传感器是保持电极和电解质溶液的界面为一恒定电位,将被测物质直接氧化或者还原,检测流过外电路的电流从而实现对亚硝酸盐的检测。早在20世纪初人们便广泛地研究不同材料的电极对亚硝酸根的响应,如铜电极、铂电极、金电极、银电极、玻碳电极、铅电极等等。但由于在这些裸电极上电子传递速度慢[26],氧化亚硝酸根所需的过电势较高,大大影响了传感器的选择性和灵敏度。
随着化学修饰电极的问世,人们研究了各种可以有效地电催化氧化亚硝酸根的电极表面修饰方法。采用合适的金属离子如 Cu(II)、Cu/Cd合金[27]等电沉积到电极表面,可以增大电极的活性表面积,降低反应所需的过电势。这种方法的最大优点是可以不依赖于原先的电极材料而使得亚硝酸根在沉积的金属层表面发生氧化还原。很多复杂的金属配合物也作为电极修饰材料被应用于亚硝酸的电化学催化[28]。冯 珍 鸽 等[29]根 据 此 制 备 了 基 于 磷 钨 杂 多 酸 盐(Na3PW12O40)的多层膜电化学传感器,实现其对腌制食品中亚硝酸盐含量的快速检测。该方法用层接层法(layer-bylayer)将 Na3PW12O40和 PAH 交 替 沉 积 于 以 (PEI/PSS/PAH)为底层的ITO电极上,制得多层膜亚硝酸盐传感器,分析该传感器的电化学性质,并利用其在溶液中对亚硝酸根的安培传感,测定腌制食品中亚硝酸盐含量。该方法制备的传感器在亚硝酸盐浓度为1.67×10-8~3.23×10-6mol/L时 呈 现 良 好 的 线 性 关 系,I(μA)= 0.125+ 0.630c(μmol/L),R =0.999 2(n=10),响应电流达到95%时所需时间小于3 s。
采用生物催化剂,如还原酶等修饰电极可以显著地提高电极的选择性和灵敏度,检测时间也较短。Zhao等[30]制得的基于硝化杆菌制备的生物传感器可以在含氧的环境下完成对亚硝酸盐的检测。然而,此类传感器生产成本较高,制备过程复杂,不适宜广泛地开发使用。
近些年来,有机染料修饰电极也被用于检测亚硝酸盐。Zuther等[31]利用在玻碳电极表面电聚合灿烂甲酚蓝的方法制备的修饰电极可以在9×10-7~1.49×10-5mol/L浓度范围内对亚硝酸盐进行检测,检测限达1.0×10-8mol/L。将该传感器应用于肉类、腌菜中亚硝酸盐的检测也取得了令人满意的效果。
2 总结与展望
食品中亚硝酸盐的检测方法种类繁多,各有利弊。通过对比笔者认为,电化学传感法具有更广阔的发展前景。因为它不仅具有仪器简单,操作方便,分析速度快等优点,而且具有灵敏度高,便于与计算机联机自动化等特点。它不受检测溶液颜色的影响,克服了光度法的一些不足,且稳定性较好,加之新型纳米复合材料的修饰使亚硝酸盐电极的电流响应成千上万倍的提高,还有酶的修饰显著地提高了电极的选择性,增强了其传感器的综合性能。但目前这些电化学传感器应用在测定亚硝酸根的研究还处在探索改进阶段,测量食品中的亚硝酸盐电化学传感器的研究现在还存在线性范围窄、离子干扰等问题,尤其是化学修饰电极的研究还处在试验阶段。相信通过科学工作者的努力,深入研究电化学传感器测定亚硝酸根的机理,将会研究出更多选择性更好,检测精密度和准确度更高的电化学传感器。
1 Groen L A,Todoroff K,Shaw G M.Maternal exposure to nitrate from drinking water and diet and risk for neuraltue defects[J].Am.J.Epidemiol,2001(153):325~331.
2 Cedergren M I,Selbing A J,Lofman O,et al.Chlorination by products and nitrate in drinking water and wisk for congenital cardiac defects[J].Environ Res.,2002(89):124~130.
3 Brender J D,Olive J M,Felkner M,et al.Dietary nitrites and nitrates,nitro-stable drugs,and neural tube defects[J].Epidemiology,2004(15):330~336.
4 孙震,钱和,蒋将.蔬菜中硝酸盐与亚硝酸盐检测方法的研究进展[J].食品与机械,2006(5):123~124
5 姜晓坤.蔬菜中硝酸盐与亚硝酸盐的污染状况与防治措施[J].吉林农业科技学院学报,2007(4):18~19
6 陈有容,杨凤琼.降低腌制蔬菜亚硝酸盐含量方法的研究进展[J].上海水产大学学报,2004(1),68~70
7 M J Moorcroft,J Davis,R G Compton.Detection and determination of nitrat and nitrite:a review[J].Talanta,2001,54(5):785~803.
8 刘素纯,罗晓敏,胡铮,等.黄菜亚硝酸盐含量的降低及其安全性评价研究[J].食品与机械,2008,24(2):90~92.
9 张妮.一种测定香肠中亚硝酸盐含量的催化动力学新方法[J].化学工程师,2012(3):23~26.
10 I Hornyák,L Kozma,A Lapat,et al.Spectrofluorimetric determination of diethazine and promethazine in pharmaceutical preparations[J].Biomed.Chromatogr,1997,11(2):99~101.
11 黄克靖,孙俊永,吴莹莹.荧光光度法结合固相萃取测定亚硝酸盐[J].信阳师范学院学报:自然科学版,2012,25(1):99~102.
12 吴富忠,土恒.蔬菜、水果及其制品中亚硝酸盐与硝酸盐的HPLC法测定[J].中国卫生检验杂志,2010,20(11):2 741~2 743.
13 蔡荟梅,侯如燕,高柱,等.离子色谱法测定茶叶中的硝酸盐和亚硝酸盐[J].茶叶科学,2012,32(2):95~99.
14 D Tsikas,F M Gutzki,J C Frlich.Analysis of nitrite and nitrite as 1-nitro-2,4,6-trimethoxybenzene derivatives by reversed-phase HPLC with UV-detection[J]Fres.J.Anal.Chem.,1992,342(1~2):95~97.
15 D Tsikas,R H Bger,S M Bode-Bger,et al.Quantification of nitrite in human urine and plasma as pentafluorobenzyl derivatives by gas chromatography-mass spectrometry using their 15N-labelled analogs[J].J.Chromatogr.B,1994,661(2):185~191.
16 S A Everett,M F Dennis,G M Tozer,et al.Nitric oxide in biological fluids:analysis of nitrite and nitrate by high-performance ion chromatography[J].J.Chromatogr.A,1995,706(1~2):437~442.
17 M A Kamyabi,F Aghajanloo.Electrocatalytic oxidation and determination of nitrite on carbon paste electrode modified with oxovanadium (IV)-4-methyl salophen[J].J.of Electroanal.Chem.,2008,614(1~2):157~165.
18 N G Carpenter,D Pletcher.Amperometric metod for the determination of nitrate in water[J].Anal.Chim.Acta.,1995,317(1~3):287~293.
19 CM N Azevedo,K Araki,L Angnes,HE Toma.Electrostatically assembled films for improving the properties of tetraruthenated porphyrin modified electrodes[J].Electroanal,1998,10(7):467~471.
20 Merusi C,Corradini C,Cavazza A,et al.Determination of nitrates,nituites and oxalates in food products by capillary eletrophoresis with p H-dependent electroosmotic flow reversal[J].Food Chem.,2010,120(2):615~620.
21 姜廷福,李菊白,李辰,等.毛细管离子电泳法同时测定腌菜中硝酸根和亚硝酸根[J].分析实验室,2004,23(5):34~36.
22 S H Lee,L R Field.Postcolumn fluorescence detection ofnitrite,nitrate,thiosulfate,and iodide anions in high-performance liquid chromatography[J].Anal.Chem.,1986,56(14):2 647~2 653.
23 V Rizzo,L Montalbetti,A L Rozza,et al.Nitrite/nitrate balance during photoinduced cerebral ischemia in the rat determined by high-performance liquid chromatography with UV and electrochemical detection[J].J.Chromatogr.A,1998,798(1~2):103~108.
24 M I H Helaleh,T Korenaga.Ion chromatographic method for simultaneous determination of nitrate and nitrite in human saliva[J].J.Chromatogr.B,2000,744(2):433~437.
25 L Campanella,C Colapicchioni,G Crescentini,et al.Sensitive membrane ISFETs for nitrate analysis in waters[L].Sens.and Actuators.B,1995,27(1~3):329~335.
26 I Isildak,A Asan.Simultaneous detection of monovalent anions and cations using all solid-state contact PVC membrane anion and cation-selective electrodes as detectors in single column ion chromatography[J].Talanta,1999,48(4):967~978.
27 C I Gonzalez,J L F C Lima,M C B S M Montenegro,et al.Determination of nitrate in carbon black by flow injection analysis(FIA)with potentiometric detection[J].Analusis,1997,25(2):32~35.
28 Z M Liu,X D Xi,S J Dong,et al.Liquid chromatography-amperometric detection of nitrite using a polypyrrole modified glassy carbon electrode doped with tungstodiphosphate anion[J].Anal.Chim.Acta.,1997,345(1~3):147~153.
29 冯珍鸽,蔡慧农,工力,等.腌制食品中亚硝酸盐的电化学检测[J].中国食品学报,2011,11(2):192~195.
30 Z F Zhao,X H Cai.Determination of trace nitrite by catalytic polarography in ferrous iron thiocyanate medium[J].J.Electroanal.Chem.,1988,252(2):361~370.
31 F Zuther,K Cammann.A selective and long-term stable nitrate sensor[J].Sens.and Actuators.B,1994,19(1~3):356~358.

