由蛇纹石制备高纯氧化铁的研究
肖景波,夏娇彬,陈居玲
(南阳东方应用化工研究所,河南南阳 473000)
由蛇纹石制备高纯氧化铁的研究
肖景波,夏娇彬,陈居玲
(南阳东方应用化工研究所,河南南阳 473000)
以蛇纹石酸浸出液净化过程所获铁铝沉淀物为原料,采用氧化沉淀及煅烧法工艺制备了高纯氧化铁。通过对铁铝沉淀物精制、铁沉淀物的酸解、酸解液中三价铁的还原、铁溶液的净化、氧化铁前驱物α-FeOOH的制备与煅烧过程的研究,确定了优化工艺条件。实验结果表明,在优化工艺条件下,铁收率为99.9%,氧化铁纯度达99.8%,符合软磁铁氧体用氧化铁的质量要求。
蛇纹石;氧化铁;软磁铁氧体
中国蛇纹石资源储量十分丰富,已探明的总储量超过50亿t,居世界第三位[1]。蛇纹石矿含有硅、镁、铁、铝、镍、钴等有价元素,具有可观的综合利用价值。
高纯氧化铁是现代电子工业生产彩色电视机玻壳的重要原料之一,亦是生产软磁铁氧体所需的一种重要原材料。其制备方法可分为干法和湿法[2]:干法主要包括焙烧法、热分解法、鲁式法等;湿法主要包括溶胶凝胶法、空气氧化法、水解法、沉淀法等,其中湿法工艺的改进方法有水热法、催化法和包核法,还有超临界流体干燥法和微波辐射法等。
为了综合利用蛇纹石中的铁资源,寻找一种制备高纯氧化铁新途径,笔者提出了由湿法冶金工艺综合利用蛇纹石过程所获得的铁铝沉淀物制备高纯氧化铁的方法,并进行了实验研究。
1 实验部分
1.1 实验原料、试剂与仪器
原料与试剂:实验所用铁铝沉淀物由南阳蛇纹石综合利用产业化实验基地提供,其w(Fe2O3)=71.62%,w[Al(OH)3]=15.10%;氢氧化钠;复合溶液,实验室配制;硫酸、还原铁粉、氟化钠、硫化钠、双氧水、氨水,均为分析纯;纯水,电阻率为16.5MΩ·cm。
仪器:BS423S型电子天平、025-2F型电动搅拌机、HH-4型数显恒温水浴锅、SHB-ⅢA型循环水式多用真空泵、HG101型电热恒温鼓风干燥箱、XKMF-2000A型马弗炉。
1.2 实验方法
1.2.1 铁铝沉淀物精制
蛇纹石中含有铁、铝等元素。由于Fe3+和Al3+沉淀的pH相近,且有一个交叉区,在以氧化沉淀法沉淀蛇纹石酸解液中的Fe3+时,Al3+也共同沉淀。因此所获沉淀物为铁与铝,即α-FeOOH和Al(OH)3的混合物。
实验称取一定量的铁铝沉淀物置于烧杯中,加水并打制成浆,再加氢氧化钠,调整氢氧化钠用量、反应时间、反应温度,将铁铝沉淀物中的铝离子转化为可溶性铝盐进入液相,再经分离、洗涤得到除铝后的铁沉淀物。
1.2.2 α-FeOOH制备
将一定量的除铝后铁沉淀物置于烧杯中,加水并打制成浆,加硫酸使铁沉淀物分解并生成硫酸铁。反应完全后加入还原铁粉使酸解液中的Fe3+还原为Fe2+,并以高锰酸钾溶液做定性实验,至溶液中无Fe3+为止。加适量氟化钠去除溶液中的钙离子、镁离子,反应完全后再加硫化钠去除其中的重金属离子[3-4]。反应完成后过滤得到相对纯净的硫酸亚铁溶液。以氨水为pH调节剂调整溶液的pH,使溶液中的Al3+及残留的Fe3+转化为氢氧化物沉淀,经过滤得到纯净的Fe2+溶液。向Fe2+溶液中加双氧水,将Fe2+氧化为Fe3+,再以纯水为底液,以氨水为pH调节剂,采用并流的方式将Fe3+溶液和pH调节剂加入到底液中。过程中控制反应温度、反应时间和反应终点的pH,使Fe3+转化为α-FeOOH沉淀。将沉淀分离,洗涤,脱水制得中间产品α-FeOOH。
1.2.3 α-Fe2O3制备
将所制得的α-FeOOH在马弗炉中煅烧,调整煅烧温度和时间,制得α-Fe2O3产品。
1.3 分析方法
铁的测定采用重铬酸钾滴定法;钙、镁的测定采用EDTA滴定法;铝的测定采用乙酸锌反滴定法。
2 结果与讨论
2.1 铁铝沉淀物精制
从蛇纹石酸解液沉铁过程中所获得的沉淀物是由α-FeOOH和Al(OH)3组成的混合物。要实现对蛇纹石中铁元素的综合利用,制备出高纯度的氧化铁产品,首先要实现沉淀物中铁与铝的分离,以获得化学组成较为单一的铁源。实验以氢氧化钠为净化剂,考察了配料固液比、氢氧化钠加入量、反应温度和反应时间对铁铝沉淀物中铝离子去除率的影响。
2.1.1 配料固液比
较高的配料浓度有利于提高反应速率,促使反应向右进行,但配料浓度过高又会对反应物的分散性产生影响,使反应速率和反应的完全程度受到限制,同时对后期固液分离不利。实验在反应温度为80℃、反应时间为60min、氢氧化钠加入量为理论量3倍的条件下,考察了配料固液比(铁铝沉淀物的质量与水的体积比,g/mL,下同)对铝离子去除率的影响,结果见表1。
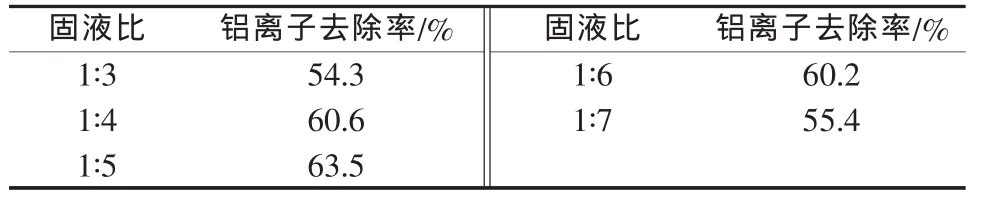
表1 配料固液比与铝离子去除率关系
由表1可以看出,铝离子去除率随固液比增大先升高后降低,在固液比为1∶5时,铝离子去除率最高。因此,实验确定适宜的固液比为1∶5。
2.1.2 氢氧化钠加入量
氢氧化钠为实验室复配的铝离子去除剂,其加入量的变化会对铝离子的去除率造成影响。实验在配料固液比为1∶5、反应温度为80℃、反应时间为60min的条件下,考察了氢氧化钠加入量对铁铝沉淀物中铝离子去除率的影响,结果见图1。由图1可以看出,铝离子去除率随氢氧化钠加入量增加而升高,当氢氧化钠加入量为理论量5倍时,再继续增加氢氧化钠用量铝离子去除率几乎不变。因此,实验确定氢氧化钠的最佳加入量为理论量的5倍,此时铝离子的去除率为79.56%。
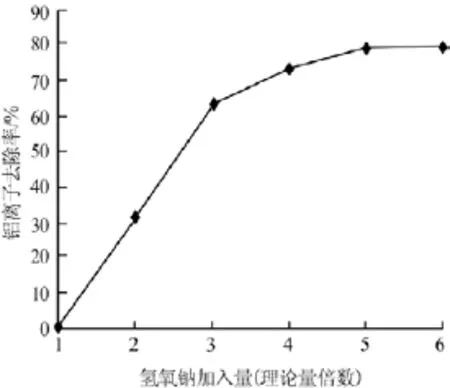
图1 氢氧化钠加入量与铝离子去除率的关系
2.1.3 反应温度
反应温度对铝离子去除率有明显影响,实验在配料固液比为1∶5、氢氧化钠加入量为理论量的5倍、反应时间为60min的条件下,考察了反应温度对铁铝沉淀物中铝离子去除率的影响,结果见图2。
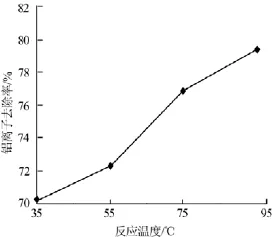
图2 反应温度与铝离子去除率的关系
由图2可以看出,铝离子去除率随反应温度升高而升高,在反应温度为95℃时,铝离子去除率达到最大(79.58%)。因此,实验确定的适宜的反应温度为95℃。
2.1.4 反应时间
在配料固液比为1∶5、氢氧化钠加入量为理论量的5倍、反应温度为95℃的条件下,考察了反应时间对铁铝沉淀物中铝离子去除率的影响,结果见图3。由图3可以看出,铝离子去除率随反应时间增加而升高,当反应时间增加至40min时,再继续延长反应时间铝离子去除率几乎不变。因此,实验确定最佳反应时间为40min,此时铝离子去除率为79.69%。
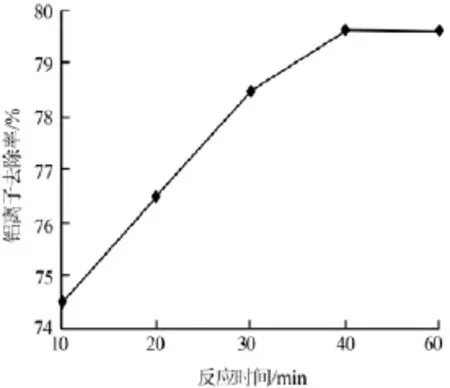
图3 反应时间与铝离子去除率的关系
2.2 铁沉淀物的酸解
将精制过的铁沉淀物酸解制得含铁溶液是制备高纯氧化铁的基础工序之一。实验考察了硫酸用量、反应温度和反应时间对铁沉淀物分解率的影响并确定了优化工艺条件。
2.2.1 硫酸用量
在反应温度为80℃、反应时间为60min的条件下,考察了硫酸加入量对铁沉淀物分解率的影响,结果见图4。
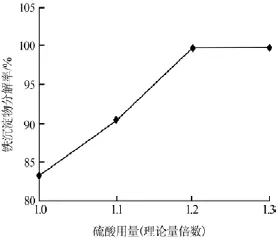
图4 硫酸用量与铁沉淀物分解率的关系
由图4可以看出,加酸量为理论量1.2倍时铁沉淀物基本分解完全,继续增加硫酸用量铁沉淀物分解率几乎没有变化。因此,实验确定了铁沉淀物酸解过程硫酸的适宜用量为理论量的1.2倍,此时铁沉淀物分解率为99.8%。
2.2.2 反应温度
在硫酸加入量为理论量1.2倍、反应时间为60min的条件下,考察了反应温度对铁沉淀物分解率的影响,结果见图5。

图5 反应温度与铁沉淀物分解率的关系
由图5可以看出,铁沉淀物分解率随反应温度的升高而升高,在反应温度为70℃时分解率达到99.9%,继续升高反应温度已无实际意义。因此,实验确定适宜的反应温度为70℃。
2.2.3 反应时间
反应时间不足铁沉淀物分解率较低,反应时间过长不仅会增加能耗,而且还会对工业化过程的生产能力造成影响。在硫酸加入量为理论量1.2倍、反应温度为70℃的条件下考察了反应时间对铁沉淀物分解率的影响,结果见图6。
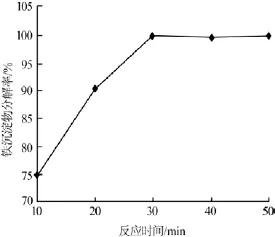
图6 反应时间与铁沉淀物分解率的关系
由图6可以看出,铁沉淀物分解率随反应时间的延长而升高,当反应时间为30min时,铁沉淀物已基本分解完全。因此,实验确定最佳的反应时间为30min,此时铁沉淀物分解率为99.9%。
2.4 铁沉淀物酸解液的还原与净化
铁沉淀物酸解后生成的溶液主要成分为Fe3+和少量Al3+,同时还含有微量的Mg2+、Ca2+、Ni2+、Mn2+、Pb2+等杂质。要制得高纯氧化铁就必须将上述杂质去除以获得纯净的铁溶液。实验首先去除溶液中的Al3+,再去除Mg2+、Ca2+,最后去除Ni2+、Mn2+、Pb2+等重金属。
2.4.1 Fe3+的还原
查阅文献可知,Fe3+开始沉淀的pH为1.5,沉淀完全后pH为4.1;而Al3+开始沉淀的pH为3.3,沉淀完全后pH为5.2。Fe3+与Al3+沉淀的pH接近并且存在一个交叉区。此外,Fe2+开始沉淀的pH为7.1,沉淀完全后pH为9.1。由此可以判断,通过调整pH,会使Al3+沉淀时体系内的Fe3+共沉淀,造成铁资源的损失。因此,要达到既要去除溶液中的Al3+,又不造成铁损失的目的,首先要改变铁离子的价态,将溶液中的Fe3+还原为Fe2+。
实验以铁粉为还原剂将Fe3+还原为Fe2+。通过多次实验确定的优化工艺条件:还原铁粉用量为理论量1.3倍、反应温度为60℃、反应时间为30min。在此条件下Fe3+的还原率为99.8%。
2.4.2 Mg2+、Ca2+的去除
实验采用氟化法去除溶液中的Mg2+、Ca2+。通过实验确定的优化工艺条件为氟化钠用量为理论量的15倍、反应温度为80℃、反应时间为30min。在此条件下Mg2+、Ca2+的去除率均为100%。
2.4.3 重金属离子的去除
实验采用硫化法去除溶液中的重金属离子。通过实验确定的优化工艺条件:硫化钠用量为理论量的10倍、反应温度为80℃、反应时间为30min。在此条件重金属离子的去除率为99.6%。
2.4.4 溶液中Al3+的去除
去除钙镁和重金属离子后的溶液中含有少量的Al3+,采用氧化水解法将其去除。实验向溶液中滴加稀氨水将pH调整至5.2~5.5,使其中的Al3+转化为氢氧化铝沉淀,经过滤获得纯净的硫酸亚铁溶液。实验确定的最佳工艺条件:氨水质量分数为6%、反应温度为50℃、反应时间为20min。在此条件下溶液中Al3+的去除率为98.08%。
综上所述,在优化工艺条件下对铁沉淀物进行酸解、还原与净化制得了高纯度的硫酸亚铁溶液,从而为α-FeOOH的制备提供了优质铁源。
2.5 α-FeOOH的制备
2.5.1 铁离子价态调整
实验采用廉价且不引入杂质的双氧水为氧化剂将体系中的Fe2+氧化为Fe3+,以制备高纯氧化铁的前驱物α-FeOOH,并确定了最佳工艺条件:双氧水加入量为理论量的1.3倍、反应温度为40℃、反应时间为30min。在此条件下反应,以高锰酸钾溶液做定性实验,溶液中无Fe2+。
2.5.2 α-FeOOH的制备
实验采用了氧化沉淀法工艺,即以实验室配制的复合溶液为底液,以氨水为pH调节剂,在一定温度条件下将氧化充分的Fe3+溶液和pH调节剂加入底液中,使溶液中的Fe3+转化为α-FeOOH沉淀,再经过滤、漂洗、脱水制得α-FeOOH。实验考察了沉淀过程反应终点pH、反应温度和反应时间对Fe3+沉淀率的影响并确定了最佳工艺条件。
1)反应终点pH。Fe3+开始沉淀的pH为1.5,沉淀完全后pH为4.1,反应终点pH直接影响着Fe3+的沉淀率。在反应温度为90℃、反应时间为60min的条件下,考察了反应终点pH对Fe3+沉淀率的影响,结果见图7。从图7可以看出,随着反应终点pH的升高,Fe3+的沉淀率逐渐上升;在pH=3.5时Fe3+基本沉淀完全,再继续升高pH则Fe3+沉淀率基本无变化。因此,确定适宜的反应终点pH为3.5,此时的Fe3+沉淀率为99.4%。
2)反应温度。在反应终点pH为3.5、反应时间为60min的条件下,考察了反应温度对Fe3+沉淀率的影响,结果见图8。从图8可以看出,随着反应温度的升高,Fe3+沉淀率逐渐上升;在85℃时Fe3+基本沉淀完全,再继续升高温度则Fe3+沉淀率变化不大。因此,实验确定适宜的反应温度为85℃,此时的Fe3+沉淀率为99.6%。
3)反应时间。在反应终点pH=3.5、反应温度为85℃的条件下,考察了反应时间对Fe3+沉淀率的影响,结果见图9。从图9可以看出,在反应时间为30min时,Fe3+基本沉淀完全;继续延长反应时间,Fe3+沉淀率变化不大。因此,实验确定适宜的反应时间为30min,此时的Fe3+沉淀率为99.7%。

图7 反应终点pH与Fe3+沉淀率的关系
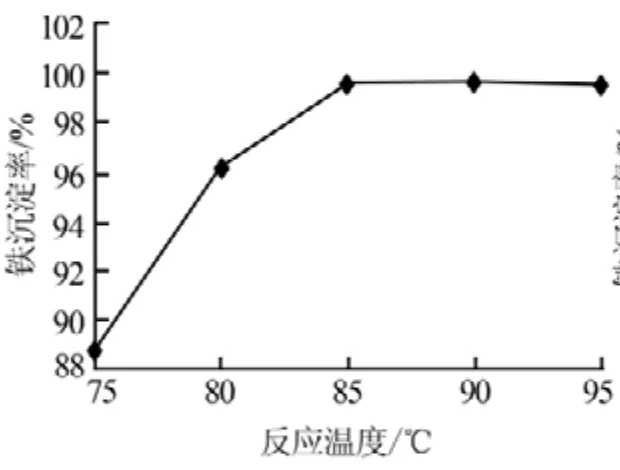
图8 反应温度与Fe3+沉淀率的关系
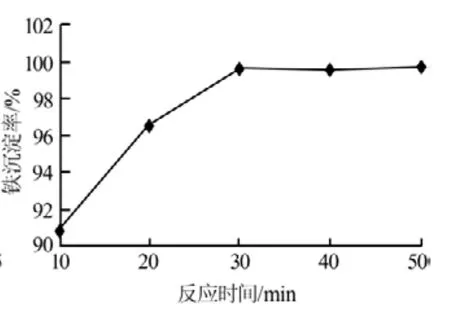
图9 反应时间与Fe3+沉淀率的关系
2.6 α-Fe2O3的制备
α-FeOOH经过高温煅烧制得α-Fe2O3,煅烧温度的高低及煅烧时间的长短对产物纯度及能源消耗有着直接影响。实验考察了煅烧温度和煅烧时间对产物纯度的影响,结果见图10和图11。由图10可以看出,在控制煅烧时间为240min的情况下,α-Fe2O3含量随着煅烧温度的升高而升高;当煅烧温度为700℃时,α-Fe2O3的质量分数为99.68%,继续升高煅烧温度则α-Fe2O3含量基本无变化。因此,实验确定适宜的煅烧温度为700℃。由图11可以看出,在煅烧温度为700℃条件下,α-Fe2O3含量随着煅烧时间的延长而升高;当煅烧时间达到180min时,α-Fe2O3的质量分数达到99.8%,继续延长煅烧时间则α-Fe2O3含量基本无变化。因此,实验确定适宜的煅烧时间为180min。
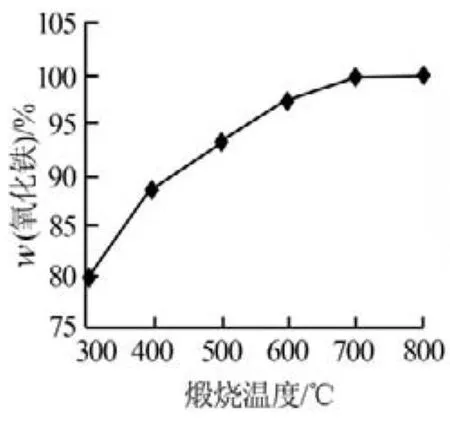
图10 氧化铁含量与煅烧温度的关系
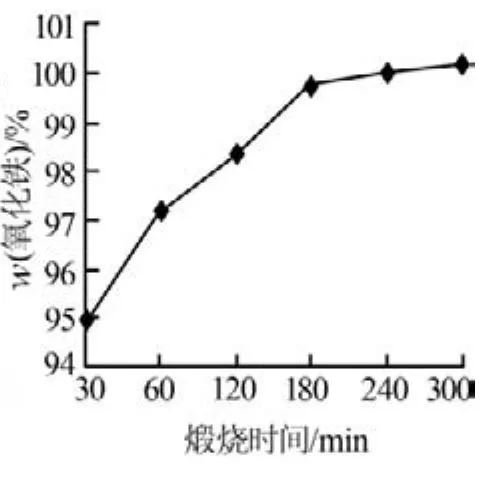
图11 氧化铁含量与 煅烧时间的关系
综上所述,由α-FeOOH制备α-Fe2O3的优化工艺条件:煅烧温度700℃、煅烧时间180min。在此条件下制得的α-Fe2O3质量分数为99.8%。经分析,其他杂质含量(质量分数):SiO2,0.005%、CaO,0.01%、Al2O3,0.01%、MnO,0.25、MgO,0.01%。该组成符合SJ/T 10383—1993《软磁铁氧体用氧化铁》[5]中的相关要求。
3 结论
实验以蛇纹石为铁源制备出了符合软磁铁氧体用氧化铁质量要求的高纯氧化铁,并确定了优化工艺条件。在优化工艺条件下将蛇纹石加工过程所得铁铝沉淀物进行精致、洗涤、酸解、还原、净化、氧化、沉淀、煅烧制得高纯氧化铁产品,主含量达到99.8%(质量分数),其他杂质指标符合软磁铁氧体用氧化铁标准要求。该工艺具有操作简单、铁转化率高、产物纯度高等特征,从而为蛇纹石的综合利用及高纯氧化铁的制备开辟了一条新途径。
[1]杨杰茹,于少明,左鹏.由蛇纹石制取镁、硅系列产品的研究进展[J].化工矿物与加工,2007,36(10):25-29.
[2]何苏萍,高倩,余晓婷,等.氧化铁红的制备方法及其在涂料中的应用[J].化工生产与技术,2011,18(1):29-32.
[3]马红钦,李玉培,娄红斌,等.盐矿卤水中钙镁离子的深度净化研究[J].中国井矿盐,2005,36(6):8-11.
[4]李秀芬.硫化钠从稀土矿淋出液中除重金属离子[J].矿产综合利用,2000(3):46-47.
[5]SJ/T 10383—1993.软磁铁氧体用氧化铁[S].
联系方式:nypengmei@126.com
一种废石膏制备纳米碳酸钙浆料的方法
本发明公布了一种以废弃石膏为碳源制备纳米碳酸钙浆料的方法。具体步骤:1)将石膏浆料与氨水混合并搅拌;2)连续搅拌条件下注入二氧化碳,直到石膏中的硫酸钙完全转化为纳米碳酸钙;3)过滤后,将滤饼在水中分散,形成纳米碳酸钙浆料。该工艺操作简单、成本低廉、分散温度较低,便于推广和使用。
US,8846562
Preparation of high purity ferric oxide from serpentine
Xiao Jingbo,Xia Jiaobin,Chen Juling
(Nanyang Oriental A pplication Chemical Research Institute,Nanyang 473000,China)
Iron oxide with high purity was prepared by oxidation precipitation and calcination method.The Fe-Al precipitate formed in the purification process of acid leaching solution of serpentine was adopted as raw material.By some detailed investigation,such as the refined preparing of Fe-Al precipitate,the acid hydrolysis of iron-based precipitate,the reducing of Fe3+in the acid hydrolysis solution,the purifying of iron solution,the preparation of iron oxide precursor(α-FeOOH)and the study of the calcination process,the optimum conditions were confirmed.Moreover,the corresponded experimental results indicated that the yield of iron and the purity of iron oxide could be up to 99.9%and 99.8%,respectively,which met with the quality requirements of ferrite iron applied in soft ferrite.
serpentine;iron oxide;soft ferrite
TQ138.11
A
1006-4990(2014)11-0030-05
2014-05-21
肖景波(1962— ),男,高级工程师,主要研究方向为湿法冶金、工业废弃物及非金属矿综合利用,已公开发表论文10篇。
——以准噶尔盆地高探1井为例

