在线净化液相色谱-串联质谱法快速测定牛奶中的6种孕激素
段永生, 王炳玲, 艾连峰*, 郭春海, 葛世辉, 张婧雯, 徐牛生
(1.河北出入境检验检疫局,河北 石家庄050051;2.赛默飞世尔科技(中国)有限公司,上海201206)
孕激素是维持妊娠所需要的二十一碳类固醇激素,包括天然化合物和人工合成化合物。这些物质一般都较稳定,不易降解,在人体内具有一定的生物活性,长期食用含孕激素的食品会严重影响人体的正常生理功能,更严重的会导致人体突变,具致畸形、致癌的潜在危害[1];已有研究表明,儿童性早熟、妇女乳腺癌和子宫癌发病率的上升与动物源性食品中性激素残留有关。我国农业部176号公告明确规定,禁止饲料和动物饮用水中添加炔诺醇、左炔诺孕酮、炔诺酮等孕激素,并在235号公告规定了醋酸甲羟孕酮等外源性激素物质在动物性食品中的最高残留限量为不得检出。但迫于利益驱使,为提高奶牛产奶量,仍有养殖户非法使用孕激素,严重影响了人们的身体健康和我国的出口贸易。
目前,对于孕激素类药物残留的检测方法已有很多,用于食品中激素残留检测的方法主要有气相色谱-质谱法(GC-MS)[2,3]和液相色谱-质谱法(LCMS)[4-11]。但其残留检测的前处理方法步骤较为繁琐,多需要经酶解或固相萃取,新的QuEChERS技术也需要旋蒸浓缩等步骤[12,13],实验时间长、耗材消耗量大,且前处理中大量有害试剂对操作人员可能有危害风险。
TurboFlow在线净化技术结合了扩散、化学和体积排除的原理,在捕获感兴趣分析物的同时,快速净化样品;结合高灵敏度、高定性能力的串联质谱保证了方法的灵敏度,该技术已应用于食品中化学污染物的分析[14-17]。本文采用该技术建立了在线净化液相色谱-串联质谱测定牛奶中炔诺酮、17α-羟基孕酮、甲羟孕酮、乙酸甲地孕酮、孕酮和醋酸美伦孕酮6种孕激素类药物残留的方法,为牛奶中孕激素的多残留分析提供了一个快速而有效的“绿色”解决方案。
1 实验部分
1.1 仪器与试剂
TurboFlow在线净化液相色谱-串联质谱仪(美国Thermo Fisher公司),由CTC多功能自动进样器(配有100μL定量环)、两个耐压125 MPa的四元梯度液相泵、六通阀切换装置、多元柱切换装置和TSQ Quantum Ultra三重四极杆质谱仪组成;PT2100型均质器(瑞士Kinematica公司);高速冷冻离心机(德国Sigma 4K-18);漩涡振荡器(美国Vortex-Genie2);超声波清洗器(KQ-500E)。甲醇、乙腈均为色谱纯;水为Milli-Q高纯水。标准物质:炔诺酮、17α-羟基孕酮、甲羟孕酮、乙酸甲地孕酮、孕酮、醋酸美伦孕酮,德国Dr.Ehrenstorfer公司,纯度≥99%。内标标准物质:炔诺酮-D6、孕酮-D9,纯度≥99%。
精确称取适量标准品,用乙腈配制成100 mg/L的标准储备液和内标标准储备液。分别取标准储备液用乙腈配制成质量浓度为1 mg/L 的混合标准工作液;分别取内标标准储备液用乙腈配制成质量浓度为1 mg/L 的混合内标工作液。用混合标准工作液和内标工作液配制系列标准溶液,孕激素质量浓度范围在0.1~50μg/L 范围内,内标质量浓度为5μg/L。
1.2 实验方法
1.2.1 样品处理
准确称取样品约2 g(精确到0.01 g),置于50 mL离心管中,加入50μL混合内标工作液和10 mL乙腈,涡旋提取 0.5 min,超声 15 min。9 000 r/min离心10 min。取1 mL左右的上清液经0.22μm微孔滤膜过滤后进样测定。
1.2.2 在线净化色谱条件
在 线 净 化 柱 为 Cyclone-P 柱 (50 mm×0.5 mm);在线净化流路流动相A为10 mmol/L 乙酸铵-0.01%(v/v)乙酸溶液,B 为乙腈,C 为丙酮-乙腈-异丙醇(1∶1∶1,v/v/v);其在线净化程序见表1,其中在线净化程序中每步的变化采用瞬变模式;进样量为50μL。HPLC分析柱为Thermo Phenyl-Hexyl柱(100 mm×2.1 mm,3μm);流动相A为甲醇,流动相B为0.5%(v/v)的甲酸溶液;HPLC的洗脱梯度见表1,每步的变化除最后一步采用瞬变模式外其他步骤间改变采用渐变模式。整个运行时间为10 min。方法的流路模式见参考文献[14]。

表1 在线净化及色谱分离的梯度洗脱程序Table 1 Gradient elution procedures of on-line cleanup and chromatographic separation
1.2.3 质谱条件
电喷雾离子源(ESI);多反应监测(MRM)正离子扫描模式;电喷雾电压(IS)4 000 V;毛细管温度350℃;辅助气压力45 unit;鞘气压力30 unit;源内诱导解离电压10 V;碰撞气压力200 Pa(1.5 mTorr);定性离子对、定量离子对,碰撞能量见表2。

表2 6种孕激素测定的质谱参数Table 2 MS parameters for the determination of the six progesterones
2 结果与讨论
2.1 质谱条件的选择
用蠕动泵以10μL/min 向质谱系统注入1 mg/L的混合标准溶液来确定分析物的最佳质谱条件。在ESI+扫描方式下分别对分析物进行一级全扫描(Q1),得到各标准物质的母离子,分析物的分子离子峰[M+H]+响应值最高,无[M+Na]+和[M+NH4]+。分别选择各母离子进行子离子扫描(Q3)得到特征碎片离子并优化碰撞能量。选择响应值高、稳定且无干扰的Q1/Q3离子对为定量和定性离子对,其优化的参数见表2。
2.2 提取溶液的选择
一般以乙腈、甲醇、乙酸乙酯及其他不同比例的混合提取液提取孕激素,提取液用固相萃取柱净化。本实验根据牛奶样品的特点及孕激素的化学性质,考察了甲醇、乙腈、乙酸乙酯、1%三氯乙酸-乙腈(7∶3,v/v)4种提取液的提取效果,其回收率结果见表3。结果表明乙酸乙酯作提取剂时回收率最低;1%三氯乙酸-乙腈(7∶3,v/v)其次;甲醇和乙腈的回收率相当;但甲醇提取后溶液放置一段时间后会有白色絮状物析出,说明甲醇沉淀蛋白效果较差,乙腈作提取剂时回收率稳定,且蛋白沉淀效果最好。所以,选择乙腈作为提取溶剂。

表3 不同提取溶剂的回收率结果(n=5)Table 3 Recoveries with different extraction solvents(n=5) %
2.3 在线净化条件的选择
在线固相萃取是用液相泵驱动不同的溶液使分析物在不同阶段实现在在线净化柱上的保留、洗脱并尽可能地淋洗掉干扰组分。选择恰当的在线净化柱和每步的流动相组成是在线净化条件优化的关键。孕激素极性较弱,反相硅胶型的C18柱和极性修饰的C18-P柱以及聚合物型的Cyclone和极性修饰的Cyclone-P柱均可有效保留孕激素;但Cyclone-P柱更易洗脱,流动相中有机相比例在60%时就可将分析物完全洗脱;使用较低比例的有机相会减小进入分析柱后产生的溶剂化效应,改善峰形。故选择Cyclone-P柱为在线净化柱。
在线净化过程主要包括上样、洗脱转移和淋洗。选择Cyclone-P柱为在线净化柱,实验采用不接分析柱分流进质谱的方式,优化每一步的分析条件。上样溶液比较了10 mmol/L 乙酸铵-0.02%乙酸水溶液和0.5%甲酸水溶液,结果显示用10 mmol/L乙酸铵-0.02%乙酸水溶液作流动相时得到的色谱峰形较好。在洗脱转移这一步骤,对10 mmol/L乙酸铵-0.02%乙酸水溶液和乙腈的使用比例进行了考察,如图1所示,当乙腈的使用比例小于50%时,洗脱效果明显变差,因此选定乙腈比例为60%。淋洗这一步骤是分析物在分析柱分离和质谱检测过程中,由净化泵带着洗脱能力较强的溶剂对净化柱进行淋洗,并用洗脱溶剂充满洗脱环以备下一个样品的分析。方法选择丙酮-乙腈-异丙醇(1∶1∶1,v/v/v)作为强洗脱溶剂,充分淋洗净化柱,绝大部分杂质可淋洗掉,进样500余次后在线净化柱仍能有效净化分析物。
2.4 分离条件的优化
在流动相的选择上,实验比较了甲醇和乙腈,结果表明,甲醇做流动相时分析物的信号明显增加。在梯度的优化上,因在洗脱转移时在线净化流路与HPLC流路合并,两路混合后在线净化流路中的有机相对分析物的保留行为包括色谱峰形、保留时间均有明显影响,故在此步骤应设置高的HPLC流速且高水相比例。实验发现当HPLC流动相起始水相比例高于80%时可有效稀释合并流路的有机相,但水相过高会延长分析时间。综上考虑,方法选择了表1的梯度洗脱条件。在优化的净化分析条件下,其MRM色谱图如图2所示。
2.5 基质效应、线性范围和测定低限
实验采用 Matuszewski等[18]建立的基质效应确认方法,即对比样品提取净化后的基质加标溶液和标准品溶液的响应值来考察方法的基质效应。当比值等于或接近1时,表明不存在基质效应的影响;大于1,表明存在离子增强作用;小于1,表明存在离子抑制作用。实验在5μg/L 水平用牛奶提取液配制的基质标准溶液与用乙腈配制的标准溶液的响应值进行了对比,结果发现比值均在0.9左右(见表4:Ratio-1),说明存在一定的基质效应影响。但经同位素校正后,标准溶液中分析物与内标物的比值和基质标准溶液的分析物与内标物的比值基本一致(见表4:Ratio-2),表明用同位素内标稀释法可有效消除基质效应的影响。所以,采用溶剂配制系列标准溶液,内标法校正分析结果。

图1 洗脱剂中乙腈体积比不同时的MRM图Fig.1 MRM chromatograms under different volume ratios of acetonitrile in elution solventNot connected to the analytical column.A:10 mmol/L ammonium acetate-0.01%acetic acid aqueous solution;B:acetonitrile.

图2 孕激素及内标物的多反应检测(MRM)色谱图Fig.2 MRM chromatograms of analytes and internal standards
用乙腈配制系列标准溶液,在选定的色谱和质谱条件下进样分析。以分析物峰面积与内标峰面积的比值对标准工作溶液中被测组分的质量浓度作线性回归,其线性范围、线性方程和线性相关系数见表5。由结果可知方法在0.1~50μg/L 范围内呈良好线性,线性相关系数在0.999 2~0.999 9 之间。
根据最终样液所代表的试样量、定容体积以及测定时所受的干扰情况,确定牛奶中6种分析物的测定低限(LOQ)为0.5μg/kg。
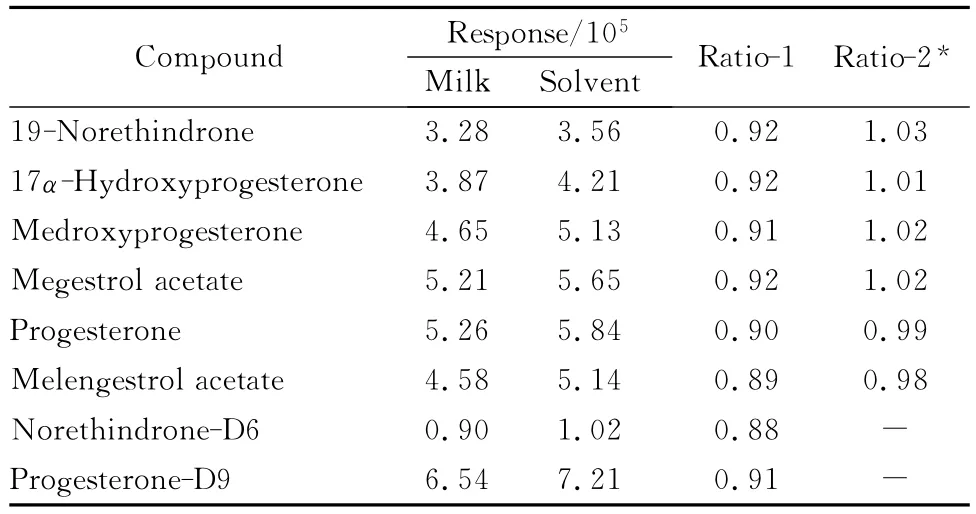
表4 基质效应考察结果Table 4 Results of matrix effect test

表5 线性范围、线性方程和相关系数(R)Table 5 Linear ranges,linear equations and correlation coefficients(R)
2.6 方法的回收率和精密度
用牛奶样品做添加回收和精密度试验,样品添加不同浓度的标准溶液后,按1.2节方法进行提取、净化和测定,分析结果见表6。3个添加水平的回收率在90.8%~107.5%之间,相对标准偏差在6.3%~11.8%之间,方法回收率高,稳定性好。

表6 方法的添加回收率和精密度(n=6)Table 6 Recoveries and precisions of the method(n=6)
2.7 实际样品的测定
对市售的10种牛奶及进口的乳清粉进行抽样分析,发现样品均含有孕酮,含量在1.7~2.6 μg/kg之间,其他5种孕激素均未检出。
3 结论
本文建立了在线净化液相色谱-串联质谱测定牛奶中6种常见孕激素类物质含量的方法。方法采用乙腈提取,提取液直接进样,在线净化液相色谱-串联质谱测定,同位素内标法定量。方法的LOQ为0.5μg/kg,满足国内外的限量要求,方法简单快速,回收率高,重现性好,已应用在本实验室的日常检验中。
[1] Luo H T,Huang X L,Wu H Q,et al.Journal of Instrumental Analysis(罗辉泰,黄晓兰,吴惠勤,等.分析测试学报),2011,30(12):1329
[2] Deng X L,Fan J,Huang T H,et al.China Food(邓晓丽,范军,黄涛宏,等.中国食品),2011(4):56
[3] Zhang H,Wang S H,Yang L X,et al.Modern Preventive Medicine(张宏,王淑惠,杨立学,等.现代预防医学),2010,37(4):636
[4] Yang Y,Shao B,Zhang J,et al.J Chromatogr B,2009,877(5/6):489
[5] Gao Q,Luo D,Bai M,et al.J Agric Food Chem,2011,59(16):8543
[6] Kang H N,Ouyang S,Lin L,et al.Chinese Journal of Chro-matography(康海宁,欧阳姗,林黎,等.色谱),2012,30(10):986
[7] Tim Harwood D,Handelsman D J.Clin Chim Acta,2009,409(1/2):78
[8] Chen X H,Sheng X F,Jin M C.Chinese Journal of Health Laboratory Technology(陈晓红,盛雪飞,金米聪.中国卫生检验杂志),2010,20(11):2671
[9] Wang H X,Zhou Y,Jiang Q W.Chinese Journal of Analytical Chemistry(王和兴,周颖,姜庆五.分析化学),2011,39(9):1323
[10] SN/T2533-2010
[11] Zhang H W,Cai X,Lin L M,et al.Chinese Journal of Chromatography(张鸿伟,蔡雪,林黎明,等.色谱),2012,30(10):991
[12] Zeng Y Z,Zhang Y,Dong L F,et al.Chinese Journal of Chromatography(曾玉珠,章勇,董良飞,等.色谱),2013,31(12):1176
[13] Wang M L,Yan H F,Fu S L,et al.Chinese Journal of Chromatography(王美玲,颜鸿飞,傅善良,等.色谱),2012,30(10):980
[14] Ai L F,Ma Y S,Chen R C,et al.Chinese Journal of Analytical Chemistry(艾连峰,马育松,陈瑞春,等.分析化学),2013,41(8):1194
[15] Mottier P,Hammel Y A,Gremaud E,et al.J Agric Food Chem,2008,56(1):35
[16] Roach J A G,DiBussolo J M,Krynitsky A,et al.J Chromatogr A,2011,1218:4284
[17] Zhao K X,Ge B K,Chen X Y,et al.Chinese Journal of Analytical Chemistry(赵孔祥,葛宝坤,陈旭艳,等.分析化学),2011,39(9):1341
[18] Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal Chem,2003,75(13):3019

