8种多糖的单糖组成、活性及其相关性分析
倪力军,王媛媛,何婉瑛,张立国
(华东理工大学化学与分子工程学院,上海 200237)
多糖广泛存在于较多植物与中药材中,研究表明多糖是由 10个以上单糖通过糖苷键连接而成的聚糖,其具有免疫调节[1],抗氧化、抗病毒、抗炎等多种生物活性[2].多糖中的单糖组成分析是研究多糖的结构、性质及构效关系的一项基本内容.PMP柱前衍生化-高效液相色谱法反应条件温和,操作简便,重现性良好[3],被广泛应用于多糖的单糖组成测定.目前对多糖的结构及生物活性研究通常是就某种单一中药多糖独立展开[4-6],鲜见将不同中药多糖进行系列研究与比较的报道,故难以发现其中的规律与多糖产生功效的作用机制.多糖的活性与其化学结构有着密切的关系[7],对不同中药材中多糖的单糖组成进行分析并研究其与多糖活性间的关系对多糖的构效关系研究具有重要意义.为此,笔者选取 8种中药材,提取其水溶性多糖,并进行其多糖含量、单糖组成分析及清除 DPPH自由基能力的测定,利用多元统计方法分析多糖样品的差异性、不同多糖样品中各单糖之间及单糖与体外抗氧化活性间的相关性,探究单糖组成对体外抗氧化活性的影响,为不同中药材中多糖的功效评价及多糖结构与活性间的关系研究提供基础.
1 材料、试剂与仪器
中药材包括:黄芪Astragali Radix,批号YT2011080802,上海余天成中药饮片有限公司;三七Notoginseng Radix Et Rhizoma,购于上海华宇药业集团有限公司;麻黄Ephedrae Herba、苍术Atractylodis Rhizoma、甘草Glycyrrhizae Radix Rhizoma、川牛膝Cyathulae Radix,批号分别为 y412-100601-12、y002-101001-2、y013-1103-1、y012-110401-1,由承德颈复康药业集团有限公司提供;桑寄生Taxilli Herba,由承德颈复康药业集团有限公司提供;淫羊藿Epimedii Folium,购于安徽亳州.
试剂包括:D-甘露糖(Man)、D-核糖(Rib)、鼠李糖(Rha)、D-葡萄糖醛酸(GlcU)、D-半乳糖醛酸(GalU)、D-无水葡萄糖(Glc)、半乳糖(Gal)、D-木糖(Xyl)、阿拉伯糖(Ara)标准品,中国药品生物制品检定所);1-苯基-3-甲基-5-吡唑啉酮(PMP),AR,阿拉丁化学试剂有限公司;乙腈,GR,德国默克公司;1,1-二苯基-2-苦基肼DPPH,AR,阿拉丁化学试剂有限公司;NaOH、HCl等试剂均为分析纯.
仪器包括:LC-20AD XR型高效液相色谱仪(HPLC,PDA检测器,日本岛津国际贸易有限公司);T6新世纪型紫外分光光度计(UV,北京普析通用仪器有限公司);DZF-6050型真空干燥箱(上海一恒科学仪器有限公司);TDL-5-A 型离心机(上海安亭科学仪器厂).
2 方 法
2.1 多糖样品的制备
利用水提醇沉法提取 8种药材中的多糖,Sevag法除蛋白,大孔树脂法脱色,超滤法除去小分子杂质,真空干燥.
2.2 样品中多糖含量的测定
称取各多糖样品 10,mg,去离子水定容到100,mL,配制 0.1,g/L的样品溶液.量取 600,μL进行苯酚-硫酸法显色反应[8],以去离子水显色作为空白,在 490,nm 波长处测量吸光度值,利用标准曲线计算其多糖含量.
2.3 单糖组成的测定
2.3.1 色谱条件
色谱柱为Inertsil ODS-SP C18柱(日本岛津国际贸易有限公司),流动相为 KH2,PO4-三乙胺缓冲溶液(pH=6.90)-乙腈(体积比 80∶20),流速 1,mL/min,检测波长250,nm,进样体积10,μL,柱温30,℃.
2.3.2 多糖的水解
称取各多糖样品 30,mg,分别溶于 2,mL,2,mol/L的 H2SO4溶液中,110,℃烘箱中水解 2,h.用 4,mol/L NaOH溶液调节pH值为中性,用纯水稀释到5,mL,离心,上清液待衍生化.
2.3.3 单糖标准品的衍生化
称取 D-甘露糖 4.6,mg、D-核糖 4.3,mg、鼠李糖4.5,mg、D-葡萄糖醛酸 4.6,mg、D-半乳糖醛酸4.5,mg、D-无水葡萄糖 4.3,mg、半乳糖 4.2,mg、D-木糖 4.6,mg、阿拉伯糖 4.1,mg,用纯水定容到 5,mL,配制混合单糖标准溶液.量取混合单糖标准溶液50,μL,加 0.3,mol/L NaOH 溶液 100,μL、0.5,mol/L PMP 溶液 100,μL,混匀,70,℃水浴 100,min,取出,冷却 10,min.加入 100,μL 0.3,mol/L HCl溶液中和,用纯水补至 500,μL,加 500,μL 氯仿萃取,涡旋振荡5,min,离心 5,min,弃去下层有机相,重复萃取 3次.上清液用纯水补至1,mL,用0.22,μm微孔滤膜过滤,取10,μL进行HPLC分析.
2.3.4 样品的衍生化
取各水解后的多糖样品 50,μL,进行衍生化操作,步骤同第2.3.3节,取10,uL进行HPLC分析.
2.4 多糖样品清除DPPH自由基能力的测定
配制各多糖溶液 5.0,mg/mL,并分别稀释到0.5,mg/mL、1.0,mg/mL、2.0,mg/mL、3.0,mg/mL、4.0,mg/mL,备用.取各质量浓度多糖溶液 2.0,mL作为样品管,加入 0.04,g/L的 DPPH 溶液 2.0,mL,混匀,静置30,min,离心.以去离子水清零,测量上清液在 517,nm波长处的吸光度值.以去离子水代替多糖溶液作为空白管,无水乙醇代替 DPPH溶液作为本底管.对质量浓度-清除率曲线进行拟合并计算各样品清除DPPH自由基能力的IC50值[9].
清除率计算式为
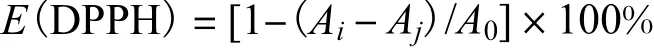
式中:E(DPPH)为DPPH 自由基清除率;Ai为样品管吸光度值;Aj为本底管吸光度值;A0为空白管吸光度值.
2.5 数据分析及单糖-抗氧化活性的相关性分析2.5.1 数据预处理
对各多糖样品的色谱峰进行定性,确定单糖组成,利用单糖混合标准品制定的标准曲线计算各样品中单糖的质量浓度,除以样品中多糖含量,换算成多糖含量为 100%时各多糖样品中的单糖含量.以单糖混合标准品作为样品匹配库,对各多糖样品的 HPLC谱图进行匹配,以保留时间为横坐标,单糖质量浓度作为纵坐标,将横坐标不匹配的点对应的纵坐标赋值为零,处理后所有谱图有统一的横坐标.为消除单糖含量量级差异的影响,对其进行开 4次方预处理;将各样品清除 DPPH自由基的 IC50值乘以对应的多糖含量,换算成多糖含量为 100%时各样品清除 DPPH自由基的IC50值.
2.5.2 数据分析方法
对8个样品 HPLC图谱进行主成分分析后在前3个主成分空间进行投影,观察样品投影图的分布以判断样品间的差异性;以开4次方的各样品中单糖含量为自变量 X,活性数据(1/IC50)为因变量 Y,进行各单糖组成之间、各单糖与体外抗氧化活性之间的简单相关分析,探究各单糖间是否相关及各单糖与体外抗氧化活性是否相关;对开4次方的各样品单糖含量进行自标度化预处理[10]后进行主成分分析,取前 6个主成分与 Y进行典型相关分析[10],根据典型相关系数判断单糖组成与抗氧化活性的整体相关性.
3 结果与讨论
3.1 多糖含量
表 1为各多糖收率及含量.由表1可知,8个样品的各多糖含量差异较大,川牛膝、三七、黄芪、苍术多糖的含量高达50%以上;其他4种多糖的含量低于40%.多糖收率(%)和含量(%)的计算式分别为

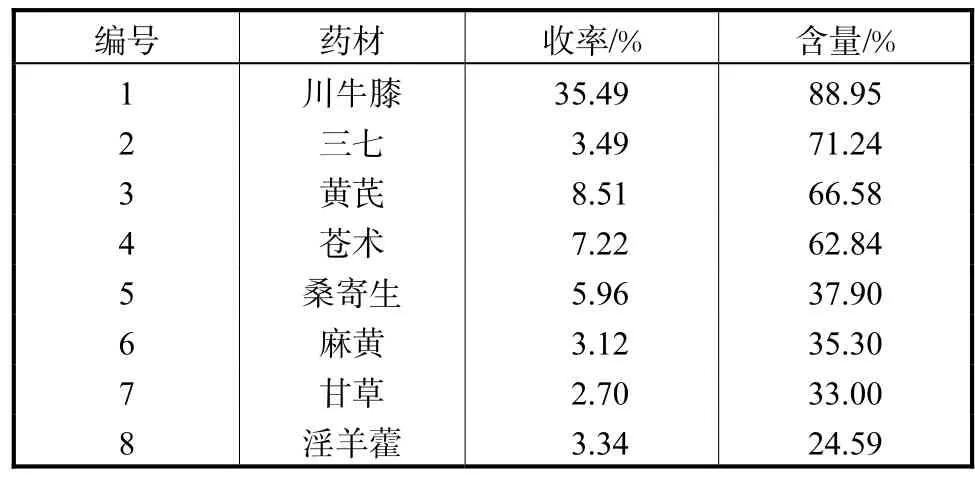
表1 各多糖收率及含量Tab.1 Yield and content of polysaccharides
3.2 单糖组成及含量
图1和图2表明本文建立的PMP柱前衍生化-高效液相色谱方法对各样品有良好的分离效果,并且水解后的 8个多糖样品主要由 Man、Rib、Rha、GlcU、GalU、Glc、Gal、Xyl、Ara或其中的部分单糖组成.
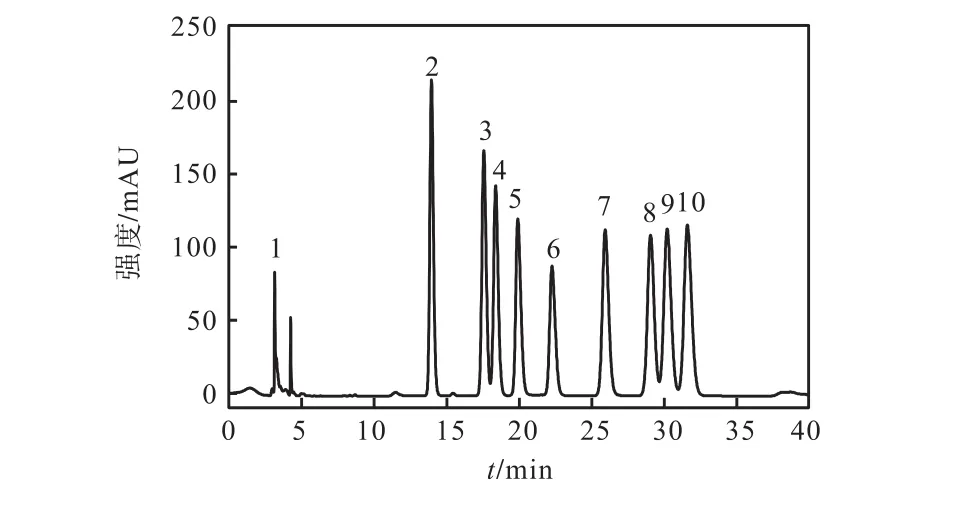
图1 单糖标准品PMP-衍生物的色谱图Fig.1 Chromatograms of 1-phenyl-3-methyl 5-pyrazolone (PMP)-derivatives of monosaccharides
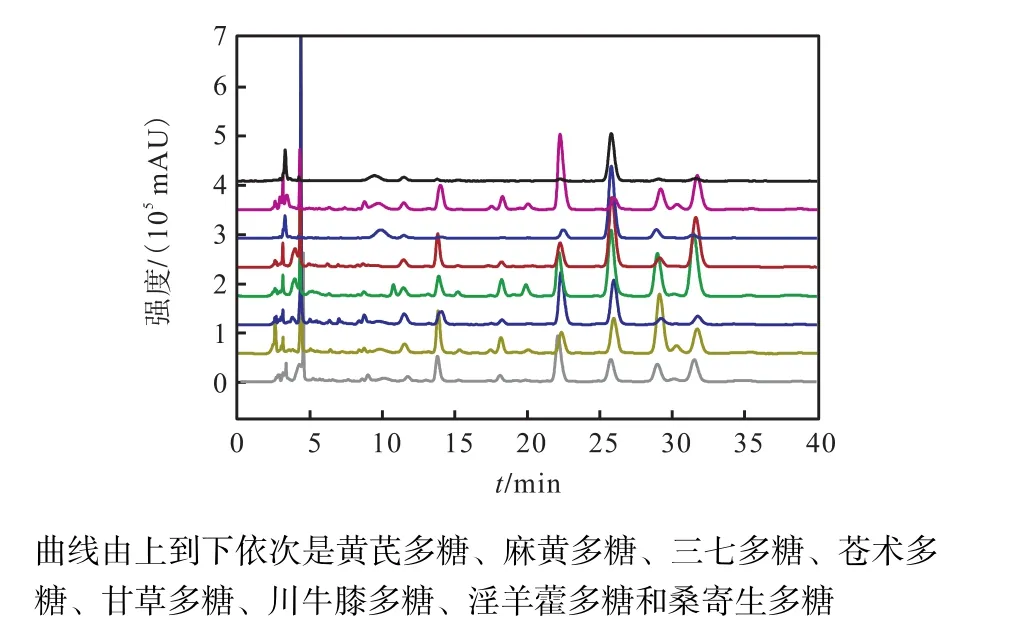
图2 8种多糖水解后的PMP-衍生物的色谱图Fig.2 Chromatograms of PMP-derivatives of acid hydrolyzates of eight polysaccharides
3.3 多糖清除DPPH自由基能力
由表2可知,8种多糖清除DPPH自由基的能力顺序为:淫羊藿多糖>桑寄生多糖>麻黄多糖>甘草多糖>黄芪多糖>三七多糖>苍术多糖>川牛膝多糖.将表2与表1结合可见,清除DPPH自由基能力较强的淫羊藿多糖、桑寄生多糖、麻黄多糖与甘草多糖中的多糖含量并不高(均低于40%),但多糖含量最高的川牛膝多糖的抗氧化活性反而最低.这一结果表明植物多糖的活性不取决于多糖含量,而是与其微观结构性质相关.
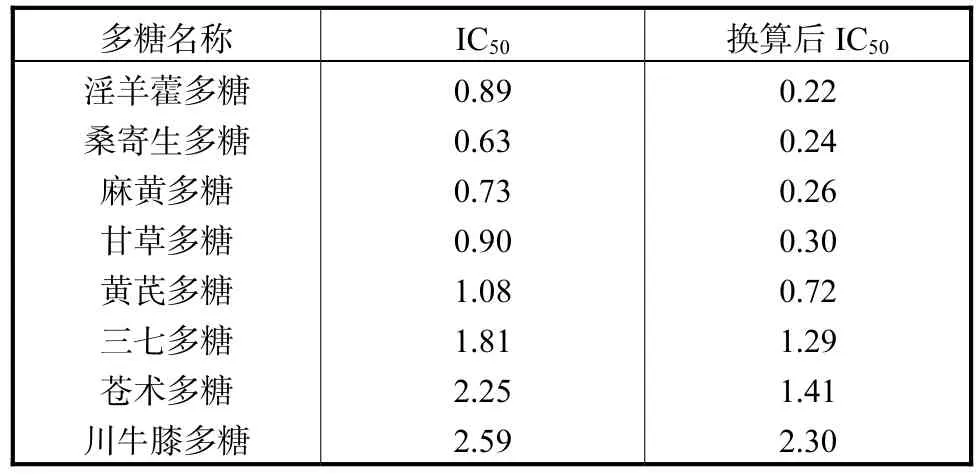
表2 8种多糖清除DPPH自由基的IC50值Tab.2 IC50value of cleaning DPPH free radical of eight polysaccharides
3.4 HPLC谱图匹配与主成分分析
表 3表明 8个多糖提取物的单糖组成不尽相同.其中甘草多糖与麻黄多糖,淫羊藿多糖与桑寄生多糖,三七多糖、苍术多糖与川牛膝多糖提取物中的单糖组成相同,黄芪多糖的单糖组成与其他多糖均不同.Man、GalU、Glc、Gal与 Ara为 8个多糖样品中的共有单糖;而 GlcU仅存在于麻黄与甘草多糖中;Xyl仅存在于麻黄、甘草、桑寄生与淫羊藿多糖中.从图 3可知,单糖组成相同的淫羊藿多糖与桑寄生多糖、麻黄多糖与甘草多糖在主成分空间分布比较接近;黄芪多糖的单糖组分与其他 7种多糖不同,相距其他样品很远;单糖组成相同的苍术多糖、三七多糖及川牛膝多糖在主成分空间分布较为分散,说明本文制备的多糖样品差异较大,具有一定的代表性.
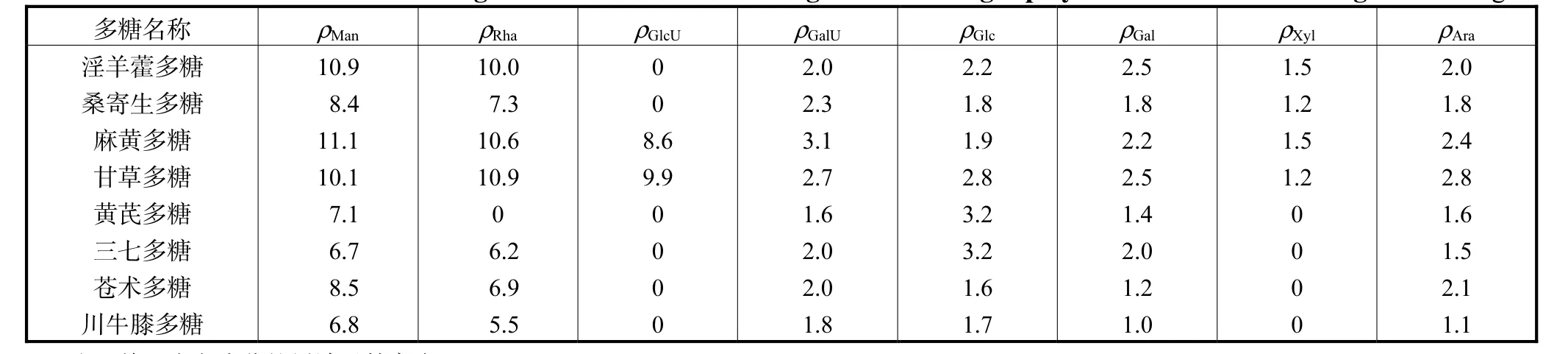
表3 基于图2中8个样品的HPLC数据匹配结果Tab.3 Matching results of HPLC chromatograms of the eight polysaccharides based on Fig.2 mg/L
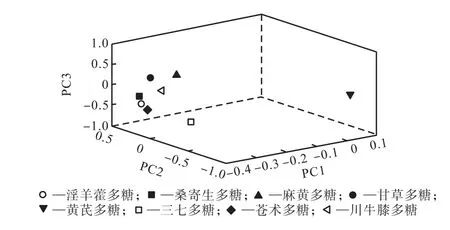
图3 基于表3的8个多糖样品的主成分投影Fig.3 Principal component projection of the eight poly saccharides based on Tab.3
3.5 单糖组成与体外抗氧化活性相关性分析
由表 4可以看出,单糖 Man与 Rha、Xyl、Ara间以及GlcU与GalU、Ara间的相关系数均大于0.8,说明这几个单糖含量有强的正相关性,除 Glc外,各单糖之间的相关系数最小也在 0.5之上,表明这些单糖间有较强的正相关.除 Glc外,其余单糖与 1/IC50间的相关系数均为正(>0.4),说明样品中这 7个单糖与抗氧化活性间具有一定的正相关,其中 Man、Xyl与 1/IC50的相关系数分别为0.814,5与0.969,2,表明这两种单糖与抗氧化活性有强相关性.Glc与其他单糖及 1/IC50的相关系数很小甚至为负,表明该单糖的存在对清除 DPPH自由基能力没有多大贡献,甚至不利于该活性.
典型相关分析中,第一典型相关系数为 0.844,4,表明样品的单糖组成与抗氧化活性有良好的整体相关性.
结合表 2与表 3,发现抗氧化活性强的淫羊藿、桑寄生、麻黄与甘草多糖的单糖组成中均含有 Xyl,而川牛膝、三七、黄芪、苍术 4个抗氧化活性较弱的多糖样品的单糖组成中不含 Xyl,另外唯有麻黄与甘草多糖的单糖组成含有 GlcU.鉴于 Xyl与 1/IC50相关系数较高,可推断Xyl与GlcU有助于提高淫羊藿等 4个多糖的抗氧化活性.抗氧化活性较弱的川牛膝多糖、苍术多糖与三七多糖,其单糖组成相同但含量不同,其活性弱于以淫羊藿为代表的 4个多糖,原因可能在于没有彼组的两个特有单糖 Xyl和 GlcU.黄芪多糖单糖组成及含量不同于上述两组多糖样品,其抗氧化活性居于中游.
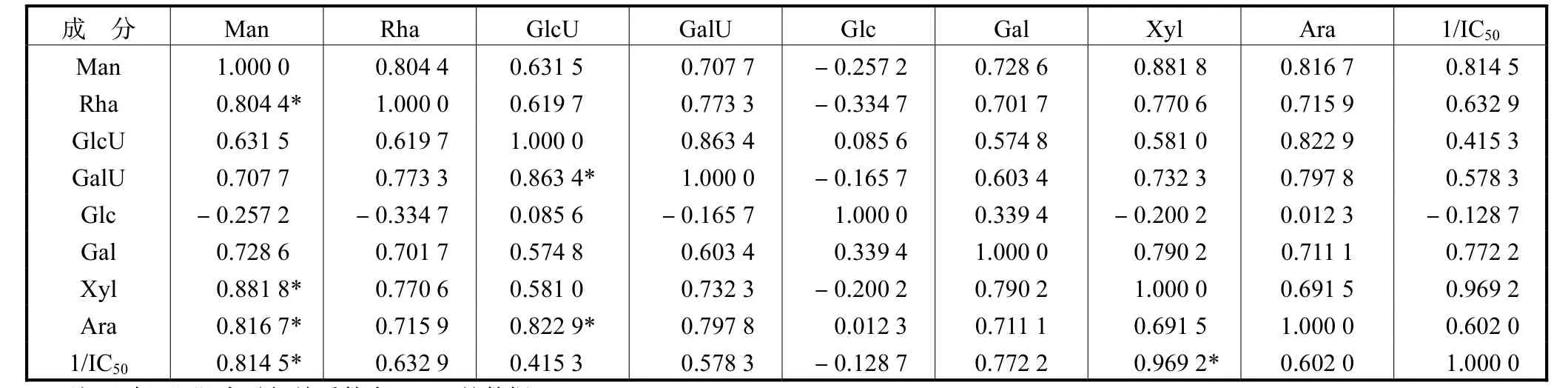
表4 各单糖之间、各单糖与1/IC50简单相关关系分析结果Tab.4 Results of simple correlation analysis between monosaccharides,each monosaccharide and 1/IC50
4 结 语
8种中药材多糖的单糖组成及含量具有较大差异,且其清除 DPPH自由基的活性强度不同;单糖组成类似的多糖样品,其体外抗氧化活性大小也较为相近;除 Glc外的 7个单糖之间、7种单糖与多糖样品的体外抗氧化活性均有较强的正相关;单糖组成与体外抗氧化活性之间存在较强的整体相关性,含有GlcU、Xyl的多糖样品抗氧化活性明显高于没有这两种单糖的样品.单糖组成对多糖抗氧化活性的具体影响方式与强度有待通过制备更多的代表性样品进行研究.
[1] 季宇彬. 中药多糖的化学与药理[M]. 北京:人民卫生出版社,2005.
Ji Yubin.Chemistry and Pharmacology of Polysaccharides in Chinese Herbs[M]. Beijing:People’s Health Press,2005(in Chinese).
[2] 郝 静,李 杰,赖红杉,等. 中草药多糖研究及其在医药上的应用与前景[J]. 亚太传统医药,2007,3(10):44-45.
Hao Jing,Li Jie,Lai Hongshan,et al. Chinese herbal polysaccharide and its application and prospects in medicine[J].Asia-Pacific Traditional Medicine,2007,3(10):44-45(in Chinese).
[3] Dai Jun,Wu Yan,Chen Shangwei,et al. Sugar compositional determination of polysaccharides from Dunaliella salina by modified RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J]. Carbohydrate Polymers,2010,82(3):629-635.
[4] Chen Jingjing,Zhang Tao,Jiang Bo,et al. Characterization and antioxidant activity of Ginkgo biloba exocarp polysaccharides[J].Carbohydrate Polymers,2012,87(1):40-45.
[5] Chattopadhyay N,Ghosh T,Sinha S,et al. Polysaccharides fromTurbinaria conoides:Structural featuresand antioxidant capacity [J].Food Chemistry,2010,118(3):823-829.
[6] Song Houfang,Zhang Quanbin,Zhang Zhongshan,et al. In vitro antioxidant activity of polysaccharides extracted fromBryopsis plumose[J]. Carbohydrate Polymers,2010,80(4):1057-1061.
[7] Wang Junlong,Guo Hongyun,Zhang Ji,et al. Sulfated modification,characterization and structure-antioxidant relationships ofArtemisia sphaerocephalapolysaccharides[J].Carbohydrate Polymers,2010,81(4):897-905.
[8] 王文平,郭祀远,李 琳,等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学,2007,28(4):276-278.
Wang Wenping,Guo Siyuan,Li Lin,et al. Assay study on content of polysaccharides in stanuntonia chinensis by phenol-sulfuric acid method[J].Food Chemistry,2007,28(4):276-278(in Chinese).
[9] 周海华,马海乐. 云芝多糖的体外抗氧化活性研究[J]. 食品研究与开发,2008,29(3):44-48.
Zhou Haihua,Ma Haile. Study on antioxidative activity ofCoriolus versicolorpolysaccharides[J].Food Research and Development,2008,29(3):44-48(in Chinese).
[10] 倪力军,张立国. 基础化学计量学及其应用[M]. 上海:华东理工大学出版社,2011.Ni Lijun,Zhang Liguo. Basic Chemometrics and Its Applications[M]. Shanghai:East China University of Science and Technology Press,2011(in Chinese).

