分泌型卷曲相关蛋白家族成员在多囊卵巢患者不同成熟度卵母细胞周围的卵丘颗粒细胞中的基因表达
刘姝含,黄鑫,郝翠芳*
(1.山东省青岛大学医学院,青岛266000;2.山东省烟台毓璜顶医院生殖医学中心,烟台264000)
多囊卵巢综合征(PCOS)是育龄期妇女常见的一种内分泌及代谢异常所致的疾病,主要以慢性无排卵和高雄激素血症为特征[1]。PCOS主要临床表现有闭经、月经稀发或不规则子宫出血、不孕、多毛和(或)痤疮[2]。文献报道,育龄期妇女发病率约为10%~15%,占不育患者的30%~40%,其中有20%的患者需要辅助生殖技术进行助孕[3]。有资料表明,PCOS患者卵母细胞受精能力的下降,主要是由于其卵泡发育中断所造成内部分子缺陷。普遍认为,卵泡的发生发育是一个复杂的过程,卵泡的生长发育与全身内分泌系统及卵巢内旁分泌密不可分[4]。在这一微环境中,通过卵丘与卵母细胞之间的双向信号传递,卵母细胞逐渐获得了发育的感受性,使其有能力进行减数分裂、受精、胚胎发育及后续的生长[5]。PCOS患者体内常存在高雄激素血症、高胰岛素血症等多种内分泌紊乱,使卵母细胞的自我调节能力被打乱,从而导致了卵泡发育的微环境的改变,引起卵泡周围血供异常,卵周颗粒细胞功能异常,因此在体外受精-胚胎移植(IVF-ET)过程中,PCOS患者虽然能够获取较多的卵母细胞,但是其受精率及胚胎发育潜能均不理想,胚胎着床率和妊娠率也随之降低[6]。在促性腺激素(Gn)的作用下,颗粒细胞增殖、分化,通过旁分泌和缝隙连接控制着卵母细胞的生长和成熟。同时,卵丘-卵母细胞复合体(COCs)的成熟度也影响着卵丘颗粒细胞上的基因表达。
分泌型卷曲相关蛋白(secreted frizzled-related protein,sFRP)家族在结构上大约由300多个氨基酸组成,其中含有一个半胱氨酸富含区(CRD)结构域,该区域含有10个高度保守的半胱氨酸,与卷曲蛋白的胞外CRD区域有30%~40%的同源性,由于sFRPs具有与卷曲相关蛋白相似的CRD,所以可通过与之竞争性结合Wnt的方式拮抗Wnt信号[7]。sFRPs基因的表达被认为能有效地抑制Wnt信号通路的异常激活。在动物模型证实生殖过程中有Wnt信号通路组成元件的参与。Wnt信号通路参与调控卵泡发育与胚胎形成,同时,它在动物胚胎分化、胚胎轴向发育、细胞极性决定、生长和发育信息的传递以及成体组织动态平衡的维持中具有关键的调控作用[8]。迄今为止,已经发现了该家族5种不同类型的成员:sFRP1、sFRP2、sFRP3、sFRP4和sFRP5[9]。有学者报道,在啮齿类动物sFRP2、sFRP4、sFRP5在 COCs中有表达,sFRP4和sFRP5在卵巢颗粒细胞中有明显表达[10]。Maman等[11]研究证实,sFRP4和sFRP5在正常人卵丘颗粒细胞中有表达,且表达量均与卵泡成熟度呈负相关。Rattner等[12]于1997年鉴定哺乳动物基因跨膜受体卷曲蛋白家族时发现sFRP4,它包含1个富含CRD配体结合域的同源序列,并通过与Wnt信号通路的卷曲蛋白受体竞争性结合,抑制Wnt信号通路的传导,作为其信号通路的抑制因子。近年来sFRP4亦得到了国内外学者的广泛关注。业已证实,sFRP4基因在PCOS患者卵丘颗粒细胞上有表达,并且其表达量与卵泡成熟度呈负相关。因此,本实验拟在PCOS及非PCOS患者不同成熟度卵母细胞周围的卵丘颗粒细胞中,对sFRPs家族的5个成员(sFRP1、sFRP2、sFRP3、sFRP4、sFRP5)进行了基因表达分析,从而为揭示sFRPs家族成员在卵母细胞成熟及PCOS致病过程中的作用提供分子学依据。
材料与方法
一、研究对象
本实验经青岛大学医学院附属烟台毓璜顶医院伦理委员会讨论通过后开展。并与患者签署知情同意书。PCOS诊断依据美国生殖医学学会(ASRM)和欧洲人类生殖与胚胎学会(ESHRE)鹿特丹工作组修正的标准确定,即符合以下3项标准中的2项:(1)稀发排卵和(或)无排卵;(2)有高雄激素血症的临床表现(如多毛、痤疮)或生化改变;(3)超声发现多囊性卵巢:卵巢增大,或每侧可以见到10~12个以上的直径2~8mm的囊状卵泡,或卵巢体积>10mm。且排除其他引起高雄激素血症的疾病(如先天性肾上腺皮质增生、分泌雄激素的肿瘤和库欣综合征等)后,诊断为PCOS。非PCOS组(non-PCOS)均因女方输卵管因素行IVF-ET,纳入标准为月经周期正常,超声检查无多囊卵巢的改变,基础内分泌正常。PCOS患者及non-PCOS患者均无男方因素。PCOS患者与non-PCOS患者的临床特点比较列于表1。
表1 PCOS与非PCOS患者的临床特点(±s)
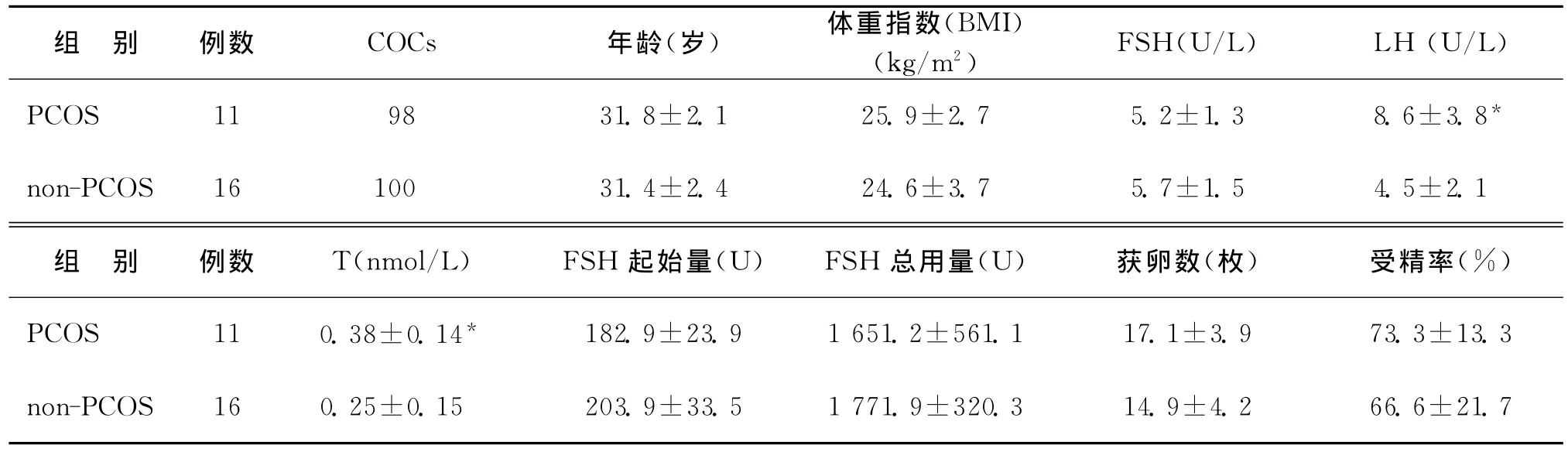
表1 PCOS与非PCOS患者的临床特点(±s)
注:与non-PCOS组比较,*P<0.05;BMI:体重指数,FSH:卵泡刺激素,LH:黄体生成素,T:睾酮
组 别 例数 COCs 年龄(岁) 体重指数(BMI)(kg/m2) FSH(U/L) LH (U/L)PCOS 11 98 31.8±2.1 25.9±2.7 5.2±1.3 8.6±3.8*non-PCOS 16 100 31.4±2.4 24.6±3.7 5.7±1.5 4.5±2.1组 别 例数 T(nmol/L) FSH起始量(U) FSH总用量(U) 获卵数(枚) 受精率(%)PCOS 11 0.38±0.14*182.9±23.9 1 651.2±561.1 17.1±3.9 73.3±13.3 non-PCOS 16 0.25±0.15 203.9±33.5 1 771.9±320.3 14.9±4.2 66.6±21.7
二、研究方法
1.促排卵方案:入选的所有患者均采用达菲林/果纳芬(FSH)标准长方案促排卵治疗。黄体中期降调节,行促性腺激素释放激动剂(GnRH-a)(达菲林,Ipsen,法国)0.05mg/d皮下注射。当垂体充分降 调 节,LH <3.0U/L、雌 二 醇 (E2)<109.8pmol/L时,行 FSH(果纳芬,Merck-Serono,德国)150~250U/d皮下注射。B超监测卵泡发育情况,当2个以上卵泡直径≥18mm且每个主导卵泡分泌的E2>1 098pmol/L时,肌注250μg人绒毛膜促性腺激素(HCG)(艾泽,Merck-Serono,德国),36h后经阴道B超引导下穿刺取卵,获得COCs。
2.颗粒细胞的收集:穿刺取卵后,采用机械法剥除单个卵母细胞周围的部分卵丘颗粒细胞,在PBS缓冲液中冲洗3次后,立即溶解于80μl RLT缓冲液(RNeasy Mini Kit,Qiagen,德国)中(来源于单个卵母细胞周围的颗粒细胞单独保存于1个eppendorf管中),裂解后的颗粒细胞置于-80℃冷冻保存。本实验共获得198个卵丘颗粒细胞样本。根据卵母细胞成熟度不同,将其周围的卵丘颗粒细胞分为4组:non-PCOS患者成熟卵母细胞周围的颗粒细胞组(CCN-MII),non-PCOS患者非成熟卵母细胞周围的颗粒细胞(CCN-MI+GV),PCOS患者成熟卵母细胞周围的颗粒细胞组(CCP-MII)和PCOS患者非成熟卵母细胞周围的颗粒细胞(CCP-MI+GV)。
3.RNA的提取和逆转录反应:根据相同成熟度卵母细胞周围的卵丘颗粒细胞混合后,参照RNeasy Mini Kit说明书提取总RNA,并进行RNA电泳和分光光度计分别测定A260和A280的吸光度,从而进行RNA质量的鉴定,逆转录反应依照实时荧光定量试剂盒(Prime Script RT Reagent Kit)(大连宝生物)说明书进行。
4.实时荧光定量聚合酶链反应(qRT-PCR):均参照SYBR Premix Ex Taq实时荧光定量试剂盒(大连宝生物)说明书进行qRT-PCR反应,使用Rotor Gene 3000型实时荧光定量聚合酶链反应仪(Corbett Research,澳大利亚)测定。各基因特异性引物序列见表2,其中GAPDH基因为内参基因。循环参数:95℃30s,95℃5s40个循环,60℃20s。每次反应结束均进行一次熔解曲线分析,并计算出各基因与GAPDH的相对关系。每次qRT-PCR反应均重复3次,每个基因表达情况的倍数变化通过DDCt方法[13]进行分析。
三、统计学分析
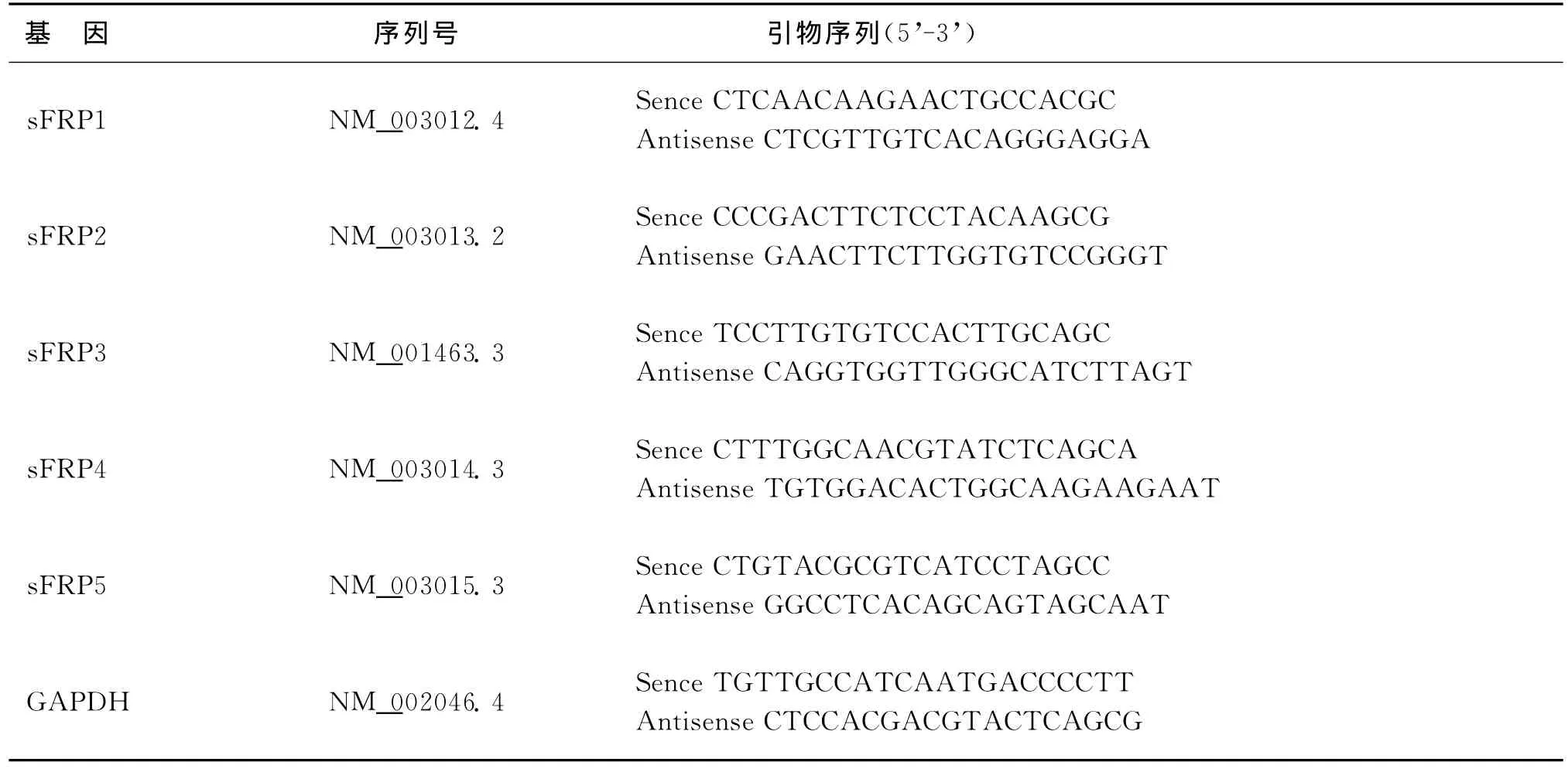
表2 qRT-PCR引物序列
结 果
一、sFRPs在PCOS患者的颗粒细胞中的表达
在PCOS患者不同成熟度卵母细胞周围的卵丘颗粒细胞中,即 CCP-MⅡ与 CCP-MⅠ+GV相比,sFRP4在两组中的表达变化有显著性差异(P<0.05)。sFRP1、sFRP2、sFRP3在两组颗粒细胞中的基因表达无显著性差异(P>0.05)(表3)。而sFRP5在PCOS患者两组颗粒细胞中的表达变化虽有检测到差异[(1.62±0.36),P<0.05]但由于qRT-PCR单次实验误差相对较大,普遍认为至少大于2.0倍以上才算有区别,为避免争议,暂忽略该基因在两组中的表达变化差异。
二、sFRPs在non-PCOS患者的颗粒细胞中的表达
在non-PCOS患者不同成熟度卵母细胞周围的卵丘颗粒细胞中,sFRPs家族成员中检测到sFRP4和sFRP5的表达有变化,即 CCN-MⅡ与 CCN-MⅠ+GV比较中sFRP4和sFRP5的表达变化均具有统计学意义(P<0.05),而sFRP1、sFRP2和sFRP3在non-PCOS患者中表达无显著变化(表4)。
表3 在CCP-MⅡ与CCP-MⅠ+GV中sFRP1、sFRP2、sFRP3、sFRP4和sFRP5的相对表达量[(±s),(n=3)]
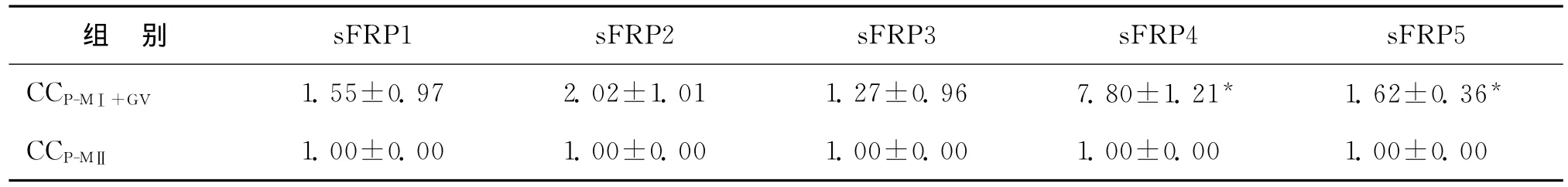
表3 在CCP-MⅡ与CCP-MⅠ+GV中sFRP1、sFRP2、sFRP3、sFRP4和sFRP5的相对表达量[(±s),(n=3)]
注:与CCP-MⅡ组比较,*P<0.05
sFRP1 sFRP2 sFRP3 sFRP4 sFRP5 CCP-MⅠ+GV 1.55±0.97 2.02±1.01 1.27±0.96 7.80±1.21* 1.62±0.36组 别*CCP-MⅡ 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00
表4 在CCN-MⅡ与CCN-MⅠ+GV中sFRP1、sFRP2、sFRP3、sFRP4和sFRP5的相对表达量[(±s),(n=3)]
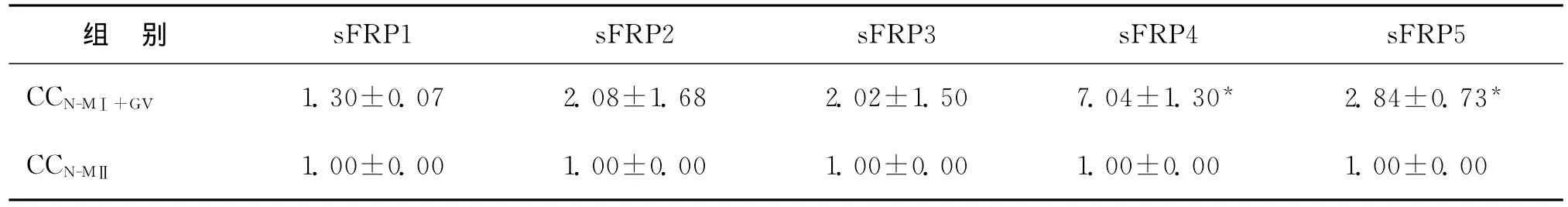
表4 在CCN-MⅡ与CCN-MⅠ+GV中sFRP1、sFRP2、sFRP3、sFRP4和sFRP5的相对表达量[(±s),(n=3)]
注:与CCN-MⅡ 组比较,*P<0.05
sFRP1 sFRP2 sFRP3 sFRP4 sFRP5 CCN-MⅠ+GV 1.30±0.07 2.08±1.68 2.02±1.50 7.04±1.30* 2.84±0.73组 别*CCN-MⅡ 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00
三、sFRP4在PCOS患者和non-PCOS患者卵母细胞成熟过程中的表达
由于sFRP4在PCOS患者和non-PCOS患者卵母细胞成熟过程中均有变化,因此,我们对两组相同成熟度卵母细胞周围的卵丘颗粒细胞中sFRP4的表达进行了比较,发现其在PCOS及non-PCOS患者间的表达无显著性差异[MII组(1.49±1.80)vs.(1.00±0.00)(P=0.43);MI+GV 组(1.00±0.55)vs.(1.00±0.00)(P=0.95)]。
讨 论
一、卵丘颗粒细胞上sFRP4的表达量随卵母细胞的成熟而逐渐降低
Wnt通路参与了卵母细胞与胚胎发育过程,sFRP4作为Wnt信号通路的抑制因子,通过抑制Wnt通路参与生殖过程。而且,Wnt通路与卵母细胞成熟相关。有研究[14]发现,在颗粒细胞中,有两种Wnt分子存在:Wnt2和Wnt4。在啮齿类动物,Wnt2持续存在于卵泡发育成熟的全过程中。还有报道,sFRP4在COCs和颗粒细胞中均有表达[10],且sFRP4在卵巢中的转录位点集中于Fz1、Wnt4和 Fz4[15]。本观察显示,无论是PCOS还是non-PCOS患者的卵丘颗粒细胞中,sFRP4在颗粒细胞中的表达量均与卵母细胞成熟度呈负相关,即其在MI和GV卵母细胞时颗粒细胞中的表达量显著高于其在MII卵母细胞周围的颗粒细胞中的表达量,表明卵母细胞的成熟与sFRP4的表达量下降有关。另外,已有学者对sFRP4基因在正常人卵母细胞成熟过程中以及在PCOS患者卵母细胞成熟过程中的表达进行了研究[11,16],本实验结果与上述两文献中报道的研究结果一致,即sFRP4基因在正常人及PCOS患者卵母细胞成熟过程中表达均逐渐减少。值得注意的是,我们对sFRP4基因在PCOS患者与non-PCOS患者相同成熟度卵母细胞周围的卵丘颗粒细胞中的表达进行了观察,发现两组间无显著性差异。提示该基因的表达主要参与了卵母细胞成熟的过程,而与PCOS患者的致病机制关系也许不大。而且,Haouzi等[17]曾对PCOS患者及non-PCOS患者MII卵母细胞周围的卵丘颗粒细胞进行研究,筛选到相关的差异表达基因,其中并不包括sFRP家族中任何基因。本实验结果也与此结论一致。推测sFRP4基因在卵母细胞发育成熟过程中发挥作用,而与PCOS疾病发生无关。
二、sFRP5仅与non-PCOS患者的卵母细胞成熟有关
本研究显示,在non-PCOS患者,sFRP5在 MI和GV卵母细胞周围的颗粒细胞中的表达量显著高于在MII卵母细胞周围的颗粒细胞中的表达量,此结果与Maman等[11]报道结果相一致。而在PCOS患者,sFRP5在不同成熟度卵母细胞周围的颗粒细胞中的表达无显著性差异。故推测,sFRP5只参与了正常人的卵母细胞成熟过程,而PCOS患者的卵母细胞发育成熟过程中sFRP5的作用可能不明显,或许PCOS患者与non-PCOS患者的卵母细胞成熟过程中存在不同的信号通路。目前已知,卵泡发育存在很多复杂的信号转导通路,包括:PI3K-Akt通路[18]、MAPK 通路[19]、TGF-beta通路[20]、KL/Kit通路[21]、Wnt通路和 RTK-Ras通路。
三、sFRP1、sFRP2和sFRP3在调控卵母细胞成熟过程中的作用不大
尽管有文献报道sFRP2在卵巢颗粒细胞中有表达[10],但也有学者认为其在卵丘颗粒细胞中的表达量太低,所以无法对其进行精确地量化[11]。sFRP2的表达也需要Wnt4,并且可以潜在地抑制Wnt4的作用[22]。然而,sFRP2主要参与成骨细胞和神经元细胞的细胞分化[22],而sFRP4参与颗粒细胞的终末分化[23],因此sFRP2并不像sFRP4那样在卵母细胞发育成熟过程中发挥重要作用。
有研究[24]报道,sFRP1在啮齿类动物卵泡发育中有表达,并且在黄体期达高峰,且sFRP1在卵巢血管生成过程中也有表达。另外,已证实sFRP3主要参与肉芽组织的形成和心肌修复,而且sFRP3主要通过Wnt8而发挥抑制Wnt通路的作用。本研究表明,sFRP1、sFRP2和sFRP3在调控卵母细胞成熟过程中的作用不大。
综上所述,虽然sFRPs家族成员具有类似的化学结构,但其功能却不尽相同。在PCOS患者中,sFRP4在卵丘颗粒细胞上的表达量随卵母细胞成熟而降低,而在 non-PCOS 患者中,sFRP4 和sFRP5均参与调控卵母细胞成熟的调控过程。而sFRP1、sFRP2和sFRP3在调控卵母细胞成熟过程中的作用不大。
[1] Carmina E,Lobo RA.Polycystic ovary syndrome(PCOS):arguably the most common endocrinopathy is associated with significant morbidity in women[J].J Clin Endocrinol Metab,1999,84:1897-1899.
[2] Franks S.Polycystic ovary syndrome [J].N Engl J Med,1995,333:853-861.
[3] Siristatidis CS,Vrachnis N,Creatsa M,et al.In vitro maturation in subfertile women with polycystic ovarian syndrome undergoing assisted reproduction[CD].Cochrane Database Syst Rev,2013,21:CD006606.
[4] Dumesic DA,Padmanabhan V,Abbott DH.Polycystic ovary syndrome and oocyte developmental competence[J].Obstet Gynecol Surv,2008,63:39-48.
[5] Jabara S,Coutifaris C.In vitro fertilization in the PCOS patient:clinical considerations[J].Semin Reprod Med,2003,21:317-324.
[6] Franks S,Roberts R,Hardy K.Gonadotrophin regimens and oocyte quality in women with polycystic ovaries[J/OL].Reprod Biomed Online,2003,6:181-184.
[7] Soriano ME,Scorrano L.Traveling Bax and forth from mitochondria to control apoptosis[J].Cell,2011,145:15-17.
[8] Reya T,Clevers H.Wnt signalling in stem cells and cancer[J].Nature,2005,434:843-850.
[9] Sercan Z,Pehlivan M,Sercan HO.Expression profile of WNT,FZD and sFRP genes in human hematopoietic cells[J].Leuk Res,2010,34:946-949.
[10] Hernandez-Gonzalez I,Gonzalez-Robayna I,Shimada M,et al.Gene expression profiles of cumulus cell oocyte complexes during ovulation reveal cumulus cells express neuronal and immune-related genes:does this expand their role in the ovulation process?[J].Mol Endocrinol,2006,20:1300-1321.
[11] Maman E,Yung Y,Cohen B,et al.Expression and regulation of sFRP family members in human granulosa cells[J].Mol Hum Reprod,2011,17:399-404.
[12] Rattner A1,Hsieh JC,Smallwood PM,et al.A family of secreted proteins contains homology to the cysteine-rich ligand-binding domain of frizzled receptors [J].Proc Natl Acad Sci USA,1997,94:2859-2863.
[13] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25:402-408.
[14] Philibert P,Biason-Lauber A,Rouzier R,et al.Identification and functional analysis of a new WNT4gene mutation among 28adolescent girls with primary amenorrhea and müllerian duct abnormalities:a French collaborative study [J].J Clin Endocrinol Metab,2008,93:895-900.
[15] Hsieh M,Johnson MA,Greenberg NM,et al.Regulated expression of Wnts and Frizzleds at specific stages of follicular development in the rodent ovary [J].Endocrinology,2002,143:898-908.
[16] Huang X,Hao C,Shen X,et al.Differences in the transcriptional profiles of human cumulus cells isolated from MI and MII oocytes of patients with polycystic ovary syndrome[J].Reproduction,2013,145:597-608.
[17] Haouzi D,Assou S,Monzo C,et al.Altered gene expression profile in cumulus cells of mature MII oocytes from patients with polycystic ovary syndrome[J].Hum Reprod,2012,27:3523-3530.
[18] Liu K,Rajareddy S,Liu L,et al.Control of mammalian oocyte growth and early follicular development by the oocyte PI3 kinase pathway:new roles for an old timer[J].Dev Biol,2006,299:1-11.
[19] Harrouk W,Clarke HJ.Mitogen-activated protein(MAP)kinase during the acquisition of meiotic competence by growing oocytes of the mouse[J].Mol Reprod Dev,1995,41:29-36.
[20] Elvin JA,Yan C,Matzuk MM.Growth differentiation factor-9 stimulates progesterone synthesis in granulosa cells via a prostaglandin E2/EP2receptor pathway[J].Proc Natl Acad Sci USA,2000,97:10288-10293.
[21] Driancourt MA,Reynaud K,Cortvrindt R,et al.Roles of KIT and KIT LIGAND in ovarian function[J].Rev Reprod,2000,5:143-152.
[22] Brophy PD,Lang KM,Dressler GR.The secreted frizzled related protein 2(SFRP2)gene is a target of the Pax2transcription factor[J].J Biol Chem,2003,278:52401-52405.
[23] Vaes BL,Dechering KJ,van Someren EP,et al.Microarray analysis reveals expression regulation of Wnt antagonists in differentiating osteoblasts[J].Bone,2005,36:803-811.
[24] Dufourcq P,Couffinhal T,Ezan J,et al.FrzA,a secreted frizzled related protein,induced angiogenic response [J].Circulation,2002,106:3097-3103.

