羟丝肽口服微乳的制备与体内药动学研究*
李磊,王长远,蔡芸,高鹏程,田燕,刘克辛
(大连医科大学药学院,大连 116044)
·药物研究·
羟丝肽口服微乳的制备与体内药动学研究*
李磊,王长远,蔡芸,高鹏程,田燕,刘克辛
(大连医科大学药学院,大连 116044)
目的制备羟丝肽(JBP 485)口服微乳,并考察其形态、稳定性及体内药动学性质。方法采用伪三元相图绘制法来筛选JBP 485微乳制备的处方,以微乳的载药量、稳定性及黏度作为综合评定的指标,优选最佳处方。给大鼠分别灌胃JBP 485水溶液和JBP 485微乳,比较药物在大鼠体内的生物利用度。结果筛选出JBP 485微乳的最佳处方,以三油酸甘油酯-单辛/癸酸甘油酯(ODO-L)-乙醇-水(Km=1∶1)体系作为JBP 485微乳的载药体系,JBP 485微乳热力学稳定性良好,粒径60~120 nm,载药量35μg·mL-1。药动学结果表明所制备的JBP 485微乳在大鼠体内的相对生物利用度达到191.3%。结论制备的JBP 485微乳稳定性良好,相对于水溶液,生物利用度有较明显的提高。
羟丝肽;微乳;伪三元相图;生物利用度;药动学
羟丝肽(JBP 485)为环状-反式-4-左旋-羟脯氨酸-左旋丝氨酸是一种二肽化合物,最初从日本抗肝炎药物Laennec(人胎盘水解产物)中分离,目前已人工合成[1]。JBP 485具有良好的抗肝炎活性,是水溶性好的小分子药物,相对分子质量约200[2-3]。大鼠口服给药后,半衰期(t1/2)只有30~40 min,口服吸收不完全,生物利用度约为30%,口服时需要频繁给药[4]。有研究表明,肽类化合物制成油包水微乳后,药物在胃肠道内的稳定性和渗透性都增强,生物利用度显著提高[5]。为了解决JBP 485口服生物利用度较低的问题,笔者拟将JBP 485制备成油包水型微乳,以达到减缓药物释放,提高生物利用度的目的。
1 材料与仪器
1.1 材料 JBP 485(含量>99.0%,株式会社日本生物制剂公司人工合成);三油酸甘油酯(上海佳和生物科技有限公司);肉豆蔻酸异丙酯(IPM,浙江物美生物科技有限公司);司盘80(Span 80,江苏海安石油化工厂);聚山梨酯80(Tween80,广州市西陆化工有限公司);辛癸酸甘油单酯(Miglyol,济南联谊化工有限公司);单辛/癸酸甘油酯(ODO-L,江苏海安石油化工厂)。
2 方法与结果
2.1 JBP 485微乳的制备[6]
2.1.1 微乳伪三元相图的绘制 使用加水滴定法绘制微乳的伪三元相图。在室温下,将表面活性剂与助表面活性剂按一定质量比(Km)混合并置于西林瓶中,按照表面活性剂和助表面活性剂的混合物与油相的不同质量比(分别为1∶9,2∶8,3∶7,4∶6,5∶5,6∶4, 7∶3,8∶2,9∶1)向混合物中加入油相,在磁力搅拌器搅拌下,滴加纯化水,根据体系的变化来确定微乳区的界限。当形成微乳时,表现为透明或略带乳光的液体,偏光显微镜下观察无双折射现象时;当体系变浑浊或黏度增大,则表明体系已不再是微乳。计算每组分在滴定终点处在微乳体系中的质量百分含量。固定Km值,用等边三角形的一个边表示表面活性剂和助表面活性剂的混合物(E),其余两个边分别表示油相(O)和水相(W),借助OriginPro7.5软件绘制微乳的伪三元相图。
2.1.2 乳化剂的选择 通过单因素考察,选择三油酸甘油酯作为油相。根据W/O微乳的性质,乳化剂的表面活性剂的亲水亲油平衡值(HLB值)应为4~7之间为宜[7]。将ODO-L、Span80-Tween80(5∶1)作为备选乳化剂,与油相三油酸甘油酯和助乳化剂乙醇组成不同的微乳体系,选择一定的Km(Km=1∶2),按照上述方法,分别绘制不同微乳体系的伪三元相图。在相图中,相同的油相条件下,微乳的范围越大,说明乳化剂容纳水的能力越强,载药量也就越高。而同时应该选择黏度较小的乳化剂,使药物流动性增加,便于服用。其中容纳水量的多少是主要考虑因素,由于乳化剂ODO-L对水的容纳能力略大于混合乳化剂Span 80-Tween 80,并且黏度较小,因此选择ODO-L为乳化剂。
2.1.3 制备微乳中Km值的选择 拟定Km分别为1∶2,1∶1和2∶1,分别以三油酸甘油酯为油相、ODO-L为乳化剂、乙醇为助乳化剂的微乳体系的伪三元相图,考察Km对微乳相行为的影响。见图1。随着Km值的增大,整个微乳体系对水的容纳能力略有增加,考虑到适当减少表面活性剂的用量,所以,选择Km值1∶1为最终Km值。
2.1.4 微乳制剂的制备 取三油酸甘油酯1.849 g,乳化剂ODO-L 3.565 g和助乳化剂无水乙醇3.565 g,在室温下磁力搅拌均匀,得油相;称取JBP 485 42 mg,超声溶解于去离子水1.2 mL,配制成35 mg·mL-1的药物溶液,得水相。将水相1 mL在室温下滴入油相中,搅拌混匀,制得外观澄清的油状溶液。
2.2 微乳制剂的鉴别及稳定性考察
2.2.1 微乳类型的鉴别及形态观察 通过苏丹红和亚甲蓝染料在JBP 485微乳中的扩散试验,可见油溶性染料苏丹红的扩散速度大于水溶性染料亚甲蓝的扩散速度,说明微乳类型为W/O型。将JBP 485微乳滴入水中后成油滴状,进一步证明微乳类型为W/O型。采用透射电镜观察微乳的表面形态。将微乳油滴稀释一定倍数,用吸管将样品滴至覆有支持膜的铜筛网上,用2%磷钨酸染色剂染色,用滤纸吸走多余的液体,室温静置30 min晾干,透射电镜下观察微乳形态,并拍摄照片,HV=120 kV,见图2。
2.2.2 微乳的物理稳定性考察 将JBP 485微乳样品放入高速离心机,分别离心30 min(2 000 r·min-1)以及10 min(5 000 r·min-1),取出微乳样品,观察样品外观,如果仍为均一澄清的溶液,无分层也无药物析出,说明微乳的体外物理稳定性较好[8-9]。
观察组和对照组均采用标准的化疗方案,对获得CR的急性髓细胞性白血病的缓解后治疗,主要包括表柔红霉素+阿糖胞苷(DA)、高三尖杉酯醇+阿糖胞苷(HA)、米托蒽醌+阿糖胞苷(MA)、阿霉素+阿糖胞苷(AA)及中/大剂量阿糖胞苷(Ara-C)等方案;对获得CR的急性淋巴细胞白血病患者的缓解后治疗,主要包括长春新碱+柔红霉素+环磷酰胺+强的松(VDCP)、足叶乙苷+阿糖胞苷(EA)以及甲氨蝶呤(HD-MTX)等方案。观察组加用十一味参芪片(吉林金恒制药股份有限公司,国药准字Z10900029,0.3 g/片)口服,每日服用3次,每次服4粒。
2.3 微乳的大鼠体内药动学研究

图1 三油酸甘油酯/ODO-L/无水乙醇/水微乳体系伪三元相图(25℃)A.Km=1∶2;B.Km=1∶1;C.Km=2∶1Fig.1 Pseudo-ternary phase diagrams of the systemof glycerol trioleate/ODO-L/EtOH/H2O(25℃)A.Km=1∶2;B.Km=1∶1;C.Km=2∶1
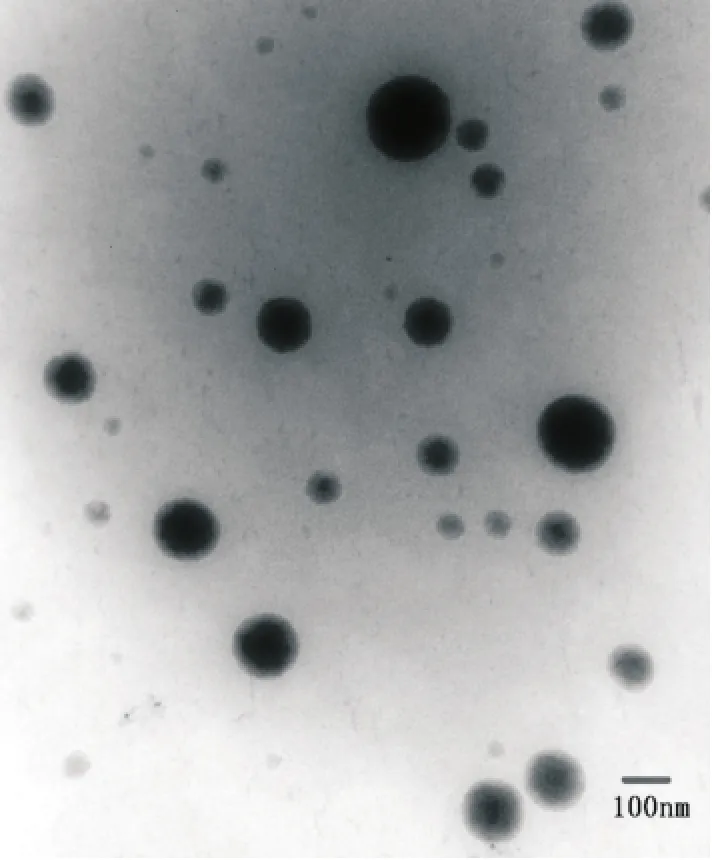
图2 JBP 485微乳的透射电镜照片(×50 000)Fig.2 Transmission electron microscopy micrographs of JBP 485microemulsion(×50 000)
2.3.1 液相-质谱串联(LC-MS/MS)条件 API 3200质谱仪,离子源为电喷雾电离子源(ESI),扫描方式采用正离子扫描,多反应监测(MRM),离子喷射电压(IS)为3 000 V,雾化气温度(TEM)为610℃;气帘气压力(cur)为140 kPa,碰撞气(CAD)为14 L·min-1;源内气流速(GS1,N1)为45 L·min-1,源内气流速(GS2,N2)为30 L·min-1,用于定量分析的离子对为m/z 201.1→86.1(JBP 485),碎裂电压:22 V。Agilent公司高效液相色谱仪,1200 series[10]。色谱柱:伊利特Hypersil ODSC18(2.1 mm×150 mm,5μm);色谱柱设定温度:室温;流动相:0.1%甲酸水溶液-甲醇溶液(97∶3);流速:0.5 mL·min-1;进样体积:10μL。
2.3.2 血浆样品处理方法 取血浆100μL置1.5mL Ep管内,精密加入甲醇400μL,涡漩30 s,11 300×g离心10 min,取上清液400μL置Ep管中,40℃水浴中氮气挥干后,用流动相200μL复溶,6 200×g离心10 min后,取上清液10μL,按上述色谱与质谱条件进行LC-MS/MS测定。

2.3.4 稳定性考察 另取上述3个浓度的JBP 485溶液,制备低、中、高浓度的血浆样品溶液,放置于以下条件中:室温放置8 h;经过3次冻融循环(-20~25℃);-20℃冰箱30 d。分别测定样品浓度,结果测得的JBP 485的精密度(RSD)和准确度(RE)均在± 11%以内,说明药物在血浆中较为稳定。
2.3.5 回收率考察 照“血浆样品处理方法”操作,分别在空白血浆沉淀蛋白前后加入低、中、高3种浓度的JBP 485标准溶液,以不参与血浆沉淀蛋白步骤的样品得到的色谱峰面积为100%。结果JBP 485在0.25, 2.5,10μg·mL-13个浓度下的回收率分别为(91.4± 2.5)%,(90.2±6.9)%和(88.1±9.5)%。
2.3.6 给药方案和样品采集 健康雄性Wistar大鼠12只,体质量约220 g,动物许可证号SCXK(辽)2008-0002,随机分成两组,每组6只,实验前大鼠禁食过夜(不禁水),乙醚麻醉后灌胃:①JBP 485水溶液(25 mg·kg-1,对照组);②JBP 485微乳(16 mg·kg-1,实验组)。给药前取空白血,于给药后第0.08,0.17,0.33,0.5,1,2,4,6,8,10,12,14,24 h大鼠眼眶取血0.3 mL,置于涂有肝素的离心试管中,离心10 min(10 000g·min-1),分离出血浆,置于-20℃冰箱中保存待测。根据血药浓度,计算药动学数据。
2.4 药动学实验结果
2.4.1 两种制剂的血药浓度-时间曲线比较 分别采用大鼠单次灌胃JBP 485水溶液和JBP 485微乳的血药浓度平均值,绘制曲线图,药物浓度-时间曲线见图4。
2.4.2 药动学参数计算 使用DAS 2.1.1数据库分别对两种制剂的大鼠体内血药浓度进行处理,求算药动学参数。各主要药动学参数结果见表1。
3 讨论
本课题组已通过大鼠体外小肠吸收实验结果表明,JBP 485水溶液的表观渗透系数约为5.01× 10-6cm·s-1,提示JBP 485的渗透性可能较低[12]。虽然此药水溶性好,但是口服生物利用度较低,仅为30%。为了进一步改善JBP 485的口服吸收,提高其生物利用度,本实验以制备方法简便的W/O型微乳作为载体,制得JBP 485微乳。

图3 4种血浆样品的图谱A.JBP 485的质谱图;B.空白血浆色谱图;C.大鼠口服微乳后8 h后的血浆样品色谱图;D.空白血浆中加入0.10μg·mL-1JBP 485的样品色谱图Fig.3 Chromatograms of four kinds of p lasma samp lesA.Product ion mass spectra of JBP 485;B.MRMchromatograms for drug-free plasma;C.plasma sample 8 h after oral adiminstration of 16mg·kg-1JBP 485 in rats;D.plasma spiked with 0.10μg·mL-1of JBP 485
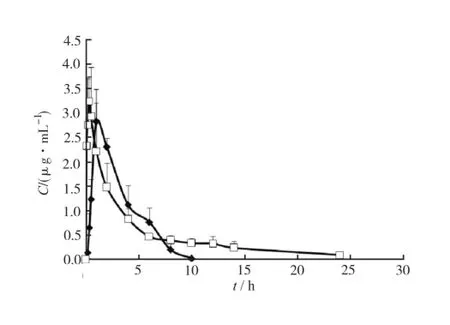
图4 大鼠灌胃JBP 485水溶液和JBP 485微乳后的平均血药浓度-时间曲线
由于JBP 485的亲水性强,而亲脂性较差,在制备微乳的过程中考察了辛癸酸甘油单酯、肉豆蔻酸异丙酯等油相,最终选择了生物相容性好、容纳水相能力相对较高的三油酸甘油酯作为油相,但是当药物水溶液的浓度较高(>40%)时,制备成微乳,放置12 h后,有药物析出。本研究旨在对JBP 485这类水溶性好的小分子化合物进行剂型改造,选择微乳等剂型,以提高其口服生物利用度为目的进行的初步研究,本课题组成员曾以低、中、高剂量JBP 485对大鼠灌胃,进行体内药动学研究。本研究为了实验的整体性,选择了其中的中剂量,即25 mg·kg-1作为各种剂型的大鼠体内药动学研究。由于微乳的载药量有限,在药动学研究中微乳的给药剂量为16 mg·kg-1,而水溶液为25 mg·kg-1。虽然JBP 485的微乳制剂剂量偏低,但是各时间点上血药浓度仍然与口服水溶液后相差不大。今后研究中为了进一步提高载药量,可以考虑采用其他油相与乳化剂。
表1 大鼠分别灌胃JBP 485溶液和微乳后JBP 485的药动学参数Tab.1 Pharmacokinetic parameters of JBP 485 in rats after oral JBP 485 solution and JBP 485-PLGA NPs ±s,n=6

表1 大鼠分别灌胃JBP 485溶液和微乳后JBP 485的药动学参数Tab.1 Pharmacokinetic parameters of JBP 485 in rats after oral JBP 485 solution and JBP 485-PLGA NPs ±s,n=6
药物剂量/ (mg·kg-1) t1/2tmaxh AUC0-t/ (μg·h·L-1) F/ % JBP 85水溶液25 1.5±0.7 1.00±0.00 10.3±2.2…JBP 485微乳16 7.0±1.7 0.35±0.19 12.6±3.2 191.3
本研究通过比较JBP 485微乳与JBP 485水溶液的大鼠体内药动学情况发现,JBP 485微乳具有促吸收作用的原因可能是:油相将JBP 485水溶液包裹而形成JBP 485微乳,口服微乳制剂的表面张力较低,易通过胃肠道的水化层,与肠道有良好的通透性和亲合性,乳滴易于透过肠壁直接被吸收[13],而JBP 485本身脂溶性较差,JBP 485水溶液直接透过肠壁而被吸收会比较困难;同时微乳可经淋巴吸收,克服了肽类药物的首关效应。
[1]LIU K X,KATO Y,KAKU T,et al.Hydroxyprolylserine derivatives JBP923 and JBP 485 exhibit the antihepatitis activities after gastrointestinal absorption in rats[J].J PharmExp Ther,2000,294(2):510-515.
[2]WU JJ,WANG C Y,LIU Q,et al.Protective effect of JBP 485 on Concanavalin A-induced hepatocyte toxicity in primary cultured rat hepatocytes[J].Eur J Pharm,2008, 589(1-3):299-305.
[3]YANG T,WU J J,WANG C Y,et al.Protective effect of JBP 485 on concanavalin A-induced liver injury in mice[J].JPharmPharmacol,2009,61(6):767-774.
[4]CANG J,ZHANG J,WANG C Y,et al.Pharmacokinetics and mechanismof intestinal absorption of JBP 485 in rats[J].Drug Metab Pharm,2010,25(5):500-507.
[5]LYONS K C,CHARMAN W N,MILLER M,et al.Factors limiting the oral bioavailability of N-acetylglucosaminyl-N-acetylmuramyl dipeptide(GMDP)and enhancement of absorption in rats by delivery in a water-in-oil microemulsion[J].Int JPharm,2000,199(1):17-28.
[6]李文浩,何应.5-氟尿嘧啶口服微乳的制备及其大鼠肠吸收作用研究[J].中国药房,2008,19(7):501-503.
[7]陆彬,张正全.用三角相图法研究药用微乳的形成条件[J].药学学报,2001,36(1):58-62.
[8]崔丽莉,邓英杰,张勇,等.胸腺五肽油包水型口服微乳的处方设计与评价[J].沈阳药科大学学报,2010,27 (8):599-604.
[9]袁中文,周郁斌,关世侠,等.灯盏花素口服微乳的制备[J].医药导报,2012,31(5):655-658.
[10]WANG C Y,CANG J,LIU Q,et al.Rapid and selective LCMS-MS method for the determination of cyclo-trans-4-L-hydroxyprolyl-L-serine(JBP 485)in rat plasma[J]. Chromatographia,2011,73:481-486.
[11]印晓星,杨帆.生物药剂学与药物动力学[M].北京:科学出版社,2009:159.
[12]VOLPE D A.App lication ofmethod suitability for drug permeability classification[J].AAPS J,2010,12(4):670-678.
[13]YETKING,CELEBIN,OZER C,etal.The healing effectof TGF-alpha on gastric ulcer induced by acetylsalicylic acid in rats[J].Int JPharm,2004,277(1-2):163-172.
DOI 10.3870/yydb.2014.02.001
Preparation and Pharmacokinetics of JBP 485-loaded W/O Microemulsion for Oral Delivery
LI Lei,WANG Chang-yuan,CAI Yun,GAO Peng-cheng,TIAN Yan,LIU Ke-xin
(School of Pharmacy, Dalian Medical University,Dalian 116044,China)
Objective To prepare JBP 485-loaded oral microemulsion,and to study the shape characteristics,in vitrostability,and its pharmacokinetics in rats.MethodsPseudo ternary phase diagramwas adopted to optimize the formula of JBP 485 microemulsion.Drug loading capability,stability and viscosity were used as the indexes for the assessment of the best formula.Rats were used in the study to compare the oral bioavailability of JBP 485 solution and JBP 485 microemulsion.ResultsGlycerol trioleate/ODO-L/EtOH/H2O(Km=1∶1)was selected as the delivery systemof JBP 485.The prepared JBP 485 microemulsion was stable in thermodynamic assessment.The particle diameter was 60-120 nmand the drug-loading capability was 35μg·mL-1.The relative bioavailability of the prepared JBP 485microemulsion reached 191.3%compared with the JBP 485 solution.ConclusionThe prepared JBP 485 microemulsion is stable,of low toxity,and can prolong the circulation time in vivo and improve the bioavailability.
JBP 485;Microemulsion;Pseudo-ternary phase diagram;Bioavailability;Pharmacokinetics
R944;TQ460.6;R969.1
A
1004-0781(2014)02-0135-05
2012-08-13
2013-06-08
*国家自然科学基金资助项目(30672498)
李磊(1976-),女,湖北武汉人,副教授,博士,主要从事药物新剂型研究。电话:0411-86110420,E-mail:llwht@163.com。
刘克辛,教授,从事研究:药物转运蛋白和药动学。电话:0411-86110407,E-mail:kexinliu@dlmedu.edu.cn。

