利用切片免疫荧光技术研究Tbx5在小鼠胚胎心脏中的表达
李 容, 刘宪楚, 史 艳, 周万邦, 曹灵慧, 李海文, 谭智勇, 唐 超, 任 恋, 吴秀山, 莫小阳
利用切片免疫荧光技术研究Tbx5在小鼠胚胎心脏中的表达
李 容, 刘宪楚, 史 艳, 周万邦, 曹灵慧, 李海文, 谭智勇, 唐 超, 任 恋, 吴秀山, 莫小阳*
(湖南师范大学 蛋白质化学及鱼类发育生物学教育部重点实验室 心脏发育研究中心, 湖南 长沙, 410081)
Tbx5参与转录因子的调控, 对上肢及心脏发育起关键作用. 通过对小鼠胚胎心脏组织切片厚度的选择、加入抗原修复液等试验条件的优化, 建立了利用切片免疫荧光技术检测小鼠胚胎心脏中Tbx5的方法. 结果显示, 在胚胎发育的第11.5 d, Tbx5在整个心脏中都有表达, 尤其在心房以及左心室中高表达. 但在胚胎发育的第13.5 d, Tbx5只在心房和左心室中表达, 在右心室中并不表达. 揭示Tbx5的这种动态表达模式对于心脏的发育以及腔室分化是十分重要的.
切片免疫荧光技术; 胚胎心脏; Tbx5
先天性心脏病(congenital heart disease, CHD)是严重危害人类健康的疾病. 先天性心脏病在新生儿中的发生率为5‰~10‰. 先天性心脏病是一种多基因遗传病, 受到环境因素和遗传因素的共同影响. 心脏是胚胎发育过程中最早形成的器官, 涉及细胞的迁移、分化及增殖、并受到一系列心脏发育相关基因的表达与调控[1—3]. 人们对于心脏形成与心脏发育过程中的重要转录因子进行了大量研究.
Tbx5基因于1997年在Holt-Oram综合征(HOS)中被鉴别并克隆[4]. 人Tbx5基因定位于12q24.1, 属于T-box转录因子基因家族[5]. T-box基因家族基因参与调控胚胎的生长过程, Tbx5基因在脊椎动物进化过程中高度保守[6]. Tbx5在心脏发育中, 尤其是在房室腔初始分化过程中起着重要的作用, 是在心脏发育过程中起重要作用的一个转录因子[7—10]. 国内外许多研究已证实Tbx5基因突变将导致HOS的发生[11—12].
1 材料和方法
1.1 材料
实验所用小鼠为BALB/c品系小鼠, 12~13周龄BALB/c小鼠, 雌鼠体重20~25 g, 雄鼠体重30~35 g, 饲养于24 °C的温度及相对湿度为55%环境下, 日照明时间为早6点到晚6点, 其他时间为暗期. 在显微镜下阴道涂片观察, 确定发情期雌鼠后, 以雌、雄比为2: 1合笼过夜, 次日早上查看雌鼠阴栓, 以观察到阴栓的当天上午定为胎龄0.5 d. 选择不同怀孕时期的小鼠进行颈椎脱臼处死后取出胚胎,剥膜并用4%多聚甲醛溶液固定过夜.
1.2 组织切片技术
1.2.1 组织石蜡包埋和切片技术
将固定好的组织用梯度酒精进行脱水处理后, 将组织浸入透明剂二甲苯中进行透明处理. 用石蜡取代透明剂, 浸蜡后包埋组织. 包埋好的蜡块用刀片修成规整的四棱台, 夹在切片机上进行切片. 用粘附剂将展平的蜡片牢附于载玻片上, 展片后放于温箱中烘干.
1.2.2 组织切片厚度的确定
用石蜡切片法进行组织切片. 分别选取厚度为4、6、8和10 μm的石蜡切片, 粘贴在用聚赖氨酸处理过的载玻片上. 随机抽取上述4种厚度的10个相同天数胚胎进行组织切片, 分别进行组织完整性和染色效果分析, 以确定切片的最佳厚度.
1.3 免疫荧光技术
利用抗原与抗体的特异性结合原理, 检测组织切片中细胞组织的多肽及蛋白质等大分子物质的定性和定位情况. 石蜡切片经脱蜡、梯度酒精复水后, 用0.1 mol/L且pH = 6.0的枸橼酸液进行高温抗原修复并滴加抗原修复液, 经0.01 mol/L的PBS漂洗3次后, 10%血清在37 ℃湿盒内封闭30 min, 一抗(Rabbit Anti-Tbx5)37 ℃湿盒内孵育1 h, PBS洗涤后滴加荧光兔二抗, 在室温中置湿盒内避光孵育1 h,滴加DAPI避光孵育5 min, 可对标本进行显核. 最后用甘油封片, 并在荧光显微镜下立即观察结果并拍照.
2 结果和分析
2.1 切片最佳厚度的确定
经对随机抽取的10个上述4种厚度的小鼠胚胎心脏组织切片分析(表1), 结果显示厚度为6 μm的切片卷折率低、组织结构完整清晰并且易粘片, 因此将免疫荧光组织切片厚度定位6 μm.

表1 不同厚度的胚胎心脏组织切片分析
+++, 程度很高; ++, 程度较高; +, 程度低
2.2 免疫荧光结果
经过对实验条件的优化, 用Tbx5抗体检测其在心脏中的表达. 镜检结果(如图1a-b)显示, 在胚胎发育的第11.5 d Tbx5在整个心脏中都有表达, 并在心房(atrium)以及左心室(Left ventricle)高表达, 在右心室(Right ventricle)中有少量表达. 在胚胎发育的第13.5 d, 房间隔基本形成. 通过对第13.5 d的胚胎心脏(如图1c-d)检测Tbx5的表达发现, 第13.5 d的心脏中Tbx5在右心室的表达消失, Tbx5只在心房以及左心室高表达. 揭示Tbx5在胚胎心脏的表达模式为从整个心脏梯度移至左边的动态表达模式.
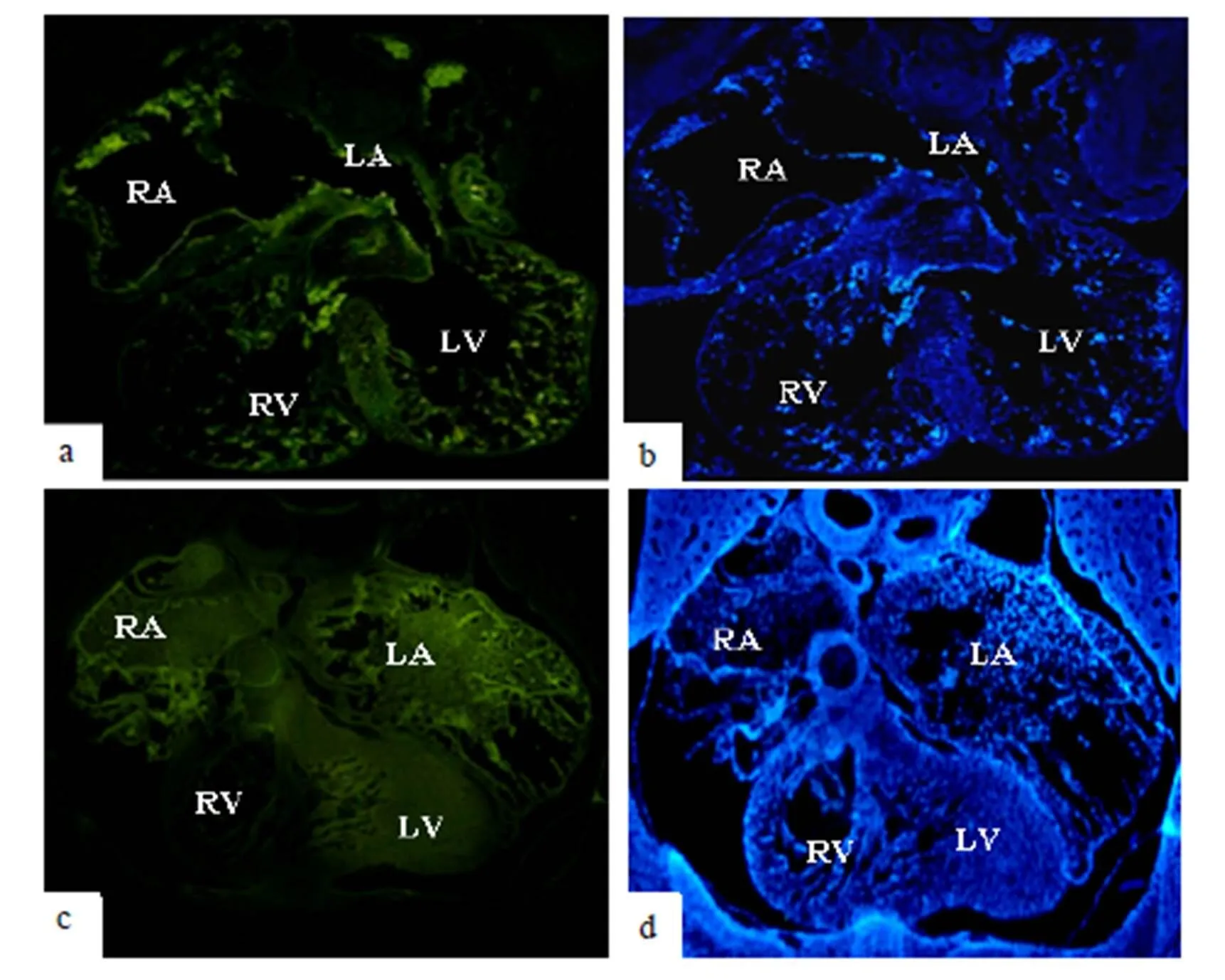
图1 Tbx5在小鼠胚胎心脏的免疫荧光检测结果. a、b: 第11.5 d胚胎心脏中Tbx5的表达检测及Dapi染核; c、d: 第13.5 d胚胎心脏中Tbx5的表达检测及Dapi染核; RA: 右心房; LA: 左心房; RV: 右心室; LV: 左心室
3 讨论
3.1 切片免疫荧光方法的应用
免疫荧光技术是利用免疫学中抗原和抗体的高度特异性反应, 当具有特异性的荧光抗体与相应抗原结合后, 在有抗原存在的部位会有特异的荧光抗体沉着, 通过荧光显微镜能够被清晰地辨认[13]. 免疫荧光技术的定位定量精确可靠, 利用不同的荧光颜色可以同时对多种蛋白的表达进行检测[14], 还可以在细胞水平上对特异性抗原或抗体定位, 目前已被广泛的应用于医学和生物学等多种领域. 免疫荧光技术作为一种研究手段和诊断方法, 对探讨某些疾病的发病机制及实验诊断是十分重要的.
本研究通过切片免疫荧光技术研究了小鼠胚胎心脏组织中标志基因的表达. 建立此方法的目的是为了探索小鼠胚胎心脏早期生长发育过程中Tbx5的表达与分布, 发现Tbx5的表达模式为从整个心脏后梯度移至左边的动态表达模式, 这种动态表达方式对于进一步研究Tbx5与先天性心脏病发生的关系是非常重要的.
3.2 切片免疫荧光方法的改进
石蜡切片的厚度对于实验的成功与否是十分关键的[15], 组织切片的厚度过大, 易发生掉片, 会降低组织切片的粘附性且容易干扰荧光信号; 组织切片的厚度过小, 切片易卷折, 且在实验中容易受损, 不利于保存组织细胞的完整性, 所以选取合适的组织切片厚度非常重要. 本研究根据小鼠胚胎心脏的特点和实验效果确定切片的最佳厚度为6 μm.
石蜡切片免疫荧光实验的质量依赖于高信号、低背景以及较完整的组织结构[16]. 高信号主要由抗原修复和一抗浓度决定, 在本研究中, 采用柠檬酸高温修复的方法[17], 发现沸腾10 min能使一抗与抗原良好结合, 但可能会导致组织结果破坏. 在热修复后滴加抗原修复液能提高质量. 另外, 采用10%的血清封闭30 min能显著降低背景的着色, 在较高浓度的一抗条件下并不会影响阳性荧光信号的检测.
致谢
感谢湖南师范大学心脏发育研究中心和湖南省生物发育与工程及新产品协同创新中心对实验提供的帮助.
[1] Xiang R, Fan L L, Huang H, et al. A novel mutation of GATA4 (K319E) is responsible for familial atrial septal defect and pulmonary valve stenosis [J]. Gene, 2013, S0378-1119(13)01423-6.
[2] Reamon-Buettner S M, Sattlegger E, Ciribilli Y, et al. Transcriptional defect of an inherited NKX2-5 haplotype comprisi- ng a SNP, a nonsynonymous and a synonymous mutation, associated with human congenital heart disease [J]. PLoS One, 2013, 20; 8(12): e83295.
[3] Clark CD, Zhang B, Lee B, et al. Evolutionary conservation of Nkx2.5 autoregulation in the second heart field [J]. Dev Biol, 2013, 374(1): 198—209.
[4] Bruneau B G, Logan M, Davis N,Levi T, et al. Chamber specific cardiac expression of TBX5 and heart defects in Holt-Oram syndrome [J]. Dev Biol, 1999, 211(1): 100—108.
[5] Rokicka A, Rokicki W. Genetical basis of Holt-Oram syndrome [J]. Wiad Lek, 1999, 52(11/12): 606—609.
[6] Bollag R J, Siegfried Z, Cebra-Thomas J A, et al. An accient f amily of embryonically expressed mouse genes sharing a conserved protein motif with the Tlocus [J]. Nat Genet, 1994, 7: 383—389.
[7] Hiroi Y, Kudoh S, Monzen K, et al. TBX5 associates with Nkx 2-5 and synergist ically promotes cardiomyocyte differentiation [J]. Nat Genet, 2001, 28(3): 276—280.
[8] Bogarapu S, Bleyl S B, Calhoun A, et al. Phenotype of a patient with contiguous deletion of TBX5 and TBX3: Expanding the disease spectrum [J]. Am J Med Genet A, 2014.
[9] Baban A, Pitto L, Pulignani S, et al. Holt-Oram syndrome with intermediate atrioventricular canal defect, and aortic coarctation: Functional characterization of a de novo TBX5 mutation [J]. Am J Med Genet A, 2014.
[10] Alby C, Bessieres B, Bieth E, et al. Contiguous gene deletion of TBX5 and TBX3 leads to a varible phenotype with combined features of Holt-Oram and ulnar-mammary syndromes [J]. Am J Med Genet A, 2013, 161A(7): 1797—802.
[11] GONG Li Guo, QIU Guang Rong, QIU Guang Bin, et al. Studies on the Mutation and Expression of TBX5 Gene in Human Simple Congenital Heart Disease [J]. HEREDITAS, 2003, 25(5): 533—537.
[12] Basson C T, Huang T, Lin R C, et al. Different T BX5 interactions in heart and limb def ined by Holt-Oram syndrome mutations [J]. Proc Natl Acad Sci USA, 1999, 96(6): 2919—2924.
[13] Leong T Y, Cooper K, Leong AS. Immunohistology-past, present, and future. Adv Anat Pathol [J]. 2010, 17(6): 404— 418.
[14] Tashiro S, Shima H. Multicolor FISH and immunofluorescence analysis. Tanpakushitsu Kakusan Koso [J]. 2006, 51(14): 1978—1980.
[15] CHEN Li-ying, FAN Pei, YANG Li-qiang, et al. Application of In situ Hybridization with Digoxin-labeled Probe in Expression Detection of FcRn in Small Intertine of Piglets [J]. Journal of Agricultural Biotecnology, 2008, 16(5): 775— 779.
[16] Robertson D, Isacke CM. Multiple immunofluorescence labeling of formalin-fixed paraffin-embedded tissue [J]. Methods Mol Biol, 2011, 724: 69—77.
[17] Robertson D, Savage K, Reis-Filho JS, et al. Multiple immunofluorescence labelling of formalin-fixed paraffin- embedded(FFPE) tissue [J]. BMC Cell Biol, 2008, 9: 13.
Application of immunofluorescence in expression detection of Tbx5 in embryonic heart of mice
LI Rong, LIU XianChu, SHI Yan, ZHOU WanBang, CAO LingHui, LI HaiWen, TAN ZhiYong, TANG Chao, REN lian, WU XiuShan, MO XiaoYang
(The Center for Heart Development, Key Lab of MOE for Development Biology and Protein Chemistry, Hunan Normal University, Changsha 410081, China)
The transcriptional regulation factor.Tbx5 played a key role on the upper limbs and heart development. Special Immunofluorescence was effectively established for the expression of Tbx5 in embryonic heart, which was optimized through a series of trials such as the selection of tissular slice thickness, adding the antigen repair solution. The results showed Tbx5 was expressed in the heart in 11.5 dpc mouse, especially highly expressed in the atrium and the left ventricle. At E13.5, Tbx5 was expressed in the atrium and left ventricular, was’t expressed in the right ventricular. Indicating the dynamic expression pattern of Tbx5 was important for the development of heart and the differentiation of Chambers.
Immunofluorescence;embryonic heart; Tbx5
10.3969/j.issn.1672-6146.2014.03.008
Q 75
1672-6146(2014)03-0033-04
email: moxiaoyang@aliyun.com.
email: maomaoronglr@163.com.
2014-03-12
国家自然科学基金项目(30930054)
(责任编校:谭长贵)

