HPLC法同时测定水解前后杜仲叶黄酮苷元的含量
王志宏,周云雷,彭胜,郑阳,史丽娟,彭密军
(吉首大学林产化工工程湖南省重点实验室杜仲湖南省工程实验室,湖南张家界 427000)
杜仲是我国特有的名贵滋补药材,具有“三降六抗一增”的功效,引起了人们的广泛关注[1]。杜仲含有的活性成分包括黄酮类、苯丙素类、环烯醚萜类和木脂素等,其中黄酮类物质一直是人们研究的热点,包括其检测方法、提取工艺以及分离纯化等方面[2]。成军等对杜仲叶提取物进行分离纯化,经波谱法鉴定 5 种化合物为:槲皮素(3,5,7,3',4'-五羟基黄酮)、山奈酚(3,5,7,4'-四羟基黄酮)、紫云英苷(山奈酚-O-β-D-葡萄糖苷)、异槲皮苷(槲皮素-3-O-β-D-葡萄糖苷)、芦丁(槲皮素-3-O-芸香糖苷)[3]。付桂明采用液质联用技术发现杜仲黄酮还包括金丝桃苷(槲皮素-3-半乳糖苷)、槲皮素-3-O-葡萄糖基-(1→2)-阿拉伯糖苷或槲皮素-3-O-木糖基-(1→2)-葡萄糖苷等[4]。研究表明,杜仲中黄酮类物质的苷元以槲皮素和山奈酚为主。近年研究发现,黄酮苷元在人体内吸收速度、吸收含量及活性功效方面比黄酮糖苷有明显的优势[5-7],其效价高于黄酮糖苷[8]。通过酸水解可将糖苷键原子质子化,使糖苷键断裂,成为苷元。
本文建立快速测定杜仲黄酮苷元的检测方法,并对酸水解前后杜仲黄酮苷元的含量进行探讨,以期为杜仲黄酮深度开发提供参考。
1 实验部分
1.1 试剂与仪器
槲皮素(批号 YA0806YB13)、山奈酚(批号20130329),均由上海源叶生物科技有限公司提供,纯度≥98%(HPLC);甲醇,色谱纯;杜仲叶(采集于吉首大学张家界校区实验基地,经吉首大学廖博儒研究员鉴定为杜仲,60℃烘干,粉碎,过80目筛);杜仲素(杜仲叶提取物,总黄酮含量>20%),由张家界恒兴生物科技有限公司生产。
LC-20A高效液相色谱仪;U-3900紫外分光光度计;BM400型数显电热恒温水浴锅;AEG-220型万分之一天平;GZX-9146-MBE数显鼓风干燥箱。
1.2 色谱条件
液相色谱柱Diamonsil C18(4.6 mm×250 mm,5 μm),流动相为甲醇-0.2% 磷酸(63 ∶37),流速1.0 mL/min,检测波长370 nm,柱温 30 ℃,进样量20 μL。
1.3 标准样品的制备
分别精密称取槲皮素和山奈酚对照品于25 mL棕色容量瓶,用无水甲醇溶解并定容,制成0.1 mg/mL对照品储备液(4℃贮藏)。取标准储备液进行稀释,配制系列浓度的混合标准液,槲皮素0.5,1.0,10,20,40,60,80 μg/mL,山奈酚 0.5,1.0,4.0,8.0,12,16,18 μg/mL(4 ℃贮藏)。
1.4 供试溶液的制备
1.4.1 水解前样品溶液制备 准确称取杜仲叶样品0.5 g于50 mL 烧瓶,以料液比1∶30(g/mL),温度70℃,回流提取3次,合并滤液,定容至50 mL。准确称取杜仲素20 mg于试管中,加入5 mL无水甲醇,超声辅助溶解,过滤,定容至10 mL。样品溶液经0.45 μm滤膜过滤,进行测定。
1.4.2 水解样品溶液制备 准确称取杜仲叶样品0.5 g于 50 mL三角瓶中,以料液比为 1∶100(g/mL)无水甲醇-盐酸(4∶1)混合溶液,70℃水解4 h,过滤,定容至 50 mL。适当稀释,经 0.45 μm 滤膜过滤,进行测定。准确称取杜仲素样品20 mg于试管,按上述条件进行水解,过滤、定容至10 mL,稀释,经 0.45 μm 滤膜,进行测定。
2 结果与讨论
2.1 色谱条件的优化
2.1.1 检测波长的优化 槲皮素和山奈酚标准溶液紫外光谱图见图1。
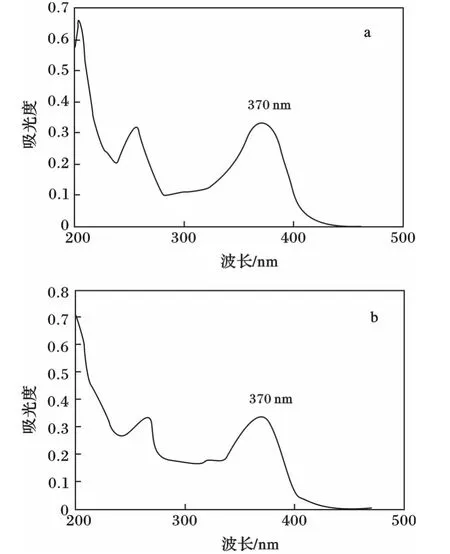
图1 标准溶液紫外最大吸收峰Fig.1 The UV absorption peak of standard solution
由图1可知,槲皮素和山奈酚在254 nm和370 nm处都有吸收峰,但是370 nm处的吸收峰强度更大,峰值较高。所以确定检测波长为370 nm。
2.1.2 流动相的选择及优化 根据文献及《中国药典》报道,同时测定槲皮素和山奈酚的流动相(有机相∶水相)比例为50∶50。但在测定过程中,该条件下槲皮素和山奈酚的保留时间在40 min左右,保留时间较晚,峰形拖尾。通过考察流动相比例,确定有机相∶水相为63∶37时,保留时间在10 min左右,峰形良好,且与其它物质之间的分离效果较好。
由于所测苷元显弱酸性,加入少量的酸可以适当改善拖尾现象,有文献报道使用0.4%的磷酸。实验表明,当磷酸浓度为0.2%时,峰形即可达到同样的效果,同时考虑实验的简便性及色谱柱耐受pH范围,所以选择磷酸浓度为0.2%。
2.2 方法学考察
2.2.1 线性关系 对1.3节配制的系列浓度的标准溶液进样测定,以对照品进样量X为横坐标,峰面积Y为纵坐标,绘制标准曲线,得回归方程,见表1。
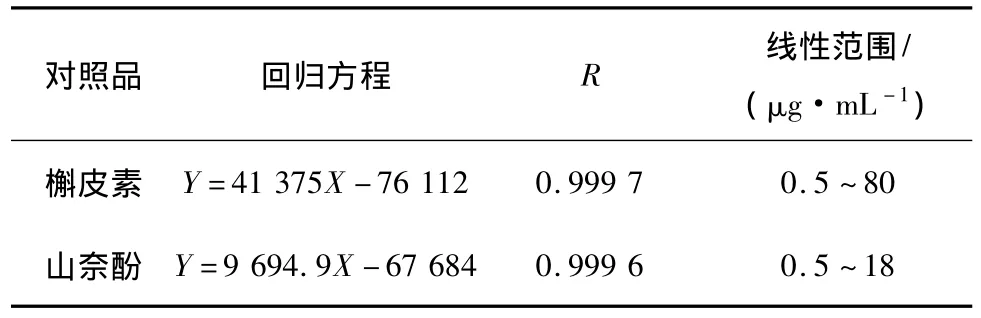
表1 槲皮素、山奈酚的线性回归方程、相关系数和线性范围(n=3)Table 1 The regression equation,correlation coefficient of references and liner ranges
2.2.2 精密度实验 精密吸取同一浓度的混合对照品,按照1.2节色谱条件,连续进样6次,分别记录槲皮素和山奈酚的峰面积。槲皮素和山奈酚的峰面积的RSD分别为1.65%和0.85%。表明仪器的测定精密度较好。
2.2.3 稳定性实验 精密吸取同一供试品,在0,2,4,10,16,24 h 分别进样,分别记录槲皮素和山奈酚的峰面积。槲皮素和山奈酚的峰面积的RSD分别为1.73%和0.57%。表明供测样品在24 h之内稳定性良好。
2.2.4 重复性实验 取同一批杜仲叶样品,每份约为0.5 g左右,按1.4.2节方法处理,平行 6份,进样20 μL,分别记录槲皮素和山奈酚的峰面积。槲皮素和山奈酚的峰面积的RSD分别为0.74%和2.00%。表明该方法测定杜仲叶样品的重复性较好。
2.2.5 加标回收率实验 取已知含量的杜仲叶供试品9份(槲皮素含量约为2.5 mg/mL,山奈酚含量约为 0.4 mg/mL),每份约 0.5 g 左右,精确称量,按照1.4.2节方法进行水解处理,过滤,定容至50 mL。取0.5 mL,再定容至10 mL。分别配制对照品含量为样品中含量约为80%,100%和120%的混合对照品储备液,将样品的溶液与对应不同浓度的混合对照品储备液按1∶1混合,经0.45 μm滤膜过滤,进样测定,结果见表2。

表2 杜仲黄酮苷元加标回收率(n=9)Table 2 The recoveries of flavonoid aglycones from Eucommia ulmoides Oliv.
2.3 杜仲及杜仲素黄酮苷元含量的测定
赵德义等通过比较杜仲黄酮和银杏黄酮的HPLC指纹图谱发现[9],二者极为相近,并且都含有槲皮素和山奈酚。2010版《中国药典》已对银杏黄酮的水解方法有较为详细的说明[10],本文参照《中国药典》和相关文献[11-13],对杜仲叶和杜仲素进行水解,并比较水解前后苷元含量的变化。高效液相色谱测定黄酮苷元混合溶液对照品以及水解前后黄酮苷元的结果见图3,其中1为槲皮素,2为山奈酚。

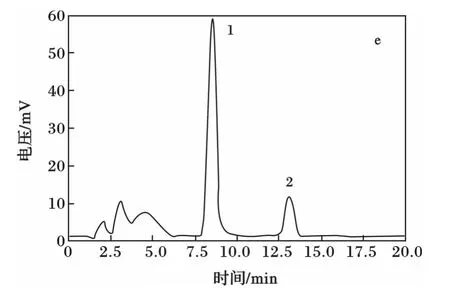
图2 对照品与杜仲样品的HPLC图谱Fig.2 HPLC chromatograms of reference substance and samples of Eucommia ulmoides Oliv.
杜仲叶和杜仲素按照同样的水解工艺进行水解,经高效液相色谱测定,水解前后杜仲叶以及杜仲素黄酮苷元含量见表3。
由表3可知,杜仲叶本身含有槲皮素与山奈酚,且测定结果与张欣等测定的结果基本一致[14];水解之后的杜仲叶中槲皮素含量提升有20倍之多,山奈酚含量也提升将近16倍,杜仲素在水解之前槲皮素含量就能达到0.2%,山奈酚可达到0.04%,水解之后,苷元含量提高将近7倍,水解效果明显;实验中按照上述条件,对含量为98%的芦丁进行水解,通过3次平行实验,水解得率可达85.68%,证明该方法可水解纯度较高的芦丁,且得率可观。
3 结论
建立快速且简便测定杜仲黄酮苷元的HPLC方法,并对杜仲叶及杜仲素中水解前后黄酮苷元进行检测。结果表明,杜仲叶中槲皮素含量为0.021%,而山奈酚则仅含0.005%;通过酸水解,可将苷键原子质子化,使苷键断裂,杜仲黄酮糖苷变为苷元,所以杜仲叶黄酮苷元含量提高20倍,杜仲素则提高约7倍。
[1]李芳东,杜红岩.杜仲[M].北京:中国中医药出版社,2001.
[2]孙兰萍,马龙,张斌,等.杜仲黄酮类化合物的研究进展[J].食品工业科技,2009,30(3):359-363.
[3]成军,赵玉英,崔玉新,等.杜仲叶黄酮类化合物研究进展[J].中国中药杂志,2000,25(5):284-286.
[4]付桂明,万茵,张硕,等.杜仲叶总黄酮超临界提取工艺优化及其液质联用分析[J].食品科学,2007,28(12):128-131.
[5]Izumi T,Piskula,Osawas,et al.Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans[J].Journal of Nutrition Education,2000,137(7):1695-1699.
[6]吕鹏,黄晓舞,吕秋军.黄酮类化合物吸收、分布和代谢的研究进展[J].中国中药杂志,2007,32(19):1961-1964.
[7]Crepy V,Morand C,Besson C,et al.Quercetin,butnot its gly-colsides,is absorption from the rat stomach[J].Journal of Agricultural and Food Chemistry,2002,50(3):618.
[8]Kima H Y,Moonb B H,Lee H J,et al.Flavonol glycosides from the leaves of Eucommia ulomides Oliv.with glycation inhibitory activity[J].Journal of Ethnopharmacol,2004,93(2):227-230.
[9]赵德义,高锦明,许爱遐,等.杜仲黄酮指纹图谱研究[J].西北植物学报,2003,23(11):1988-1990.
[10]国家药典委员会.中华人民共和国药典[M].一部.北京:中国医药科技出版社,2010:296.
[11]伍毅.银杏黄酮苷元制备的研究[D].无锡:江南大学,2008.
[12]孙勇,林鹿,彭红,等.微晶纤维素在盐酸、甲酸体系中的水解动力学[J].东北林业大学学报,2008,36(4):63-65.
[13]陈娟,师彦平.HPLC测定萹蓄中槲皮素和山奈酚的含量[J].中国中药杂志,2009,34(4):423-427.
[14]张欣,张春凤,祁东利,等.HPLC同时测定杜仲叶中7中成分的含量[J].中国药科大学学报,2012,43(5):435-437.

