不同浓度雄黄对胃腺癌细胞凋亡的影响
胡少明,张瀛,陶秀良,熊丽萍
(1.华中科技大学同济医学院附属同济医院中西医结合科,武汉 430030;2.广州军区武汉总医院病理科,武汉 430070)
不同浓度雄黄对胃腺癌细胞凋亡的影响
胡少明1,张瀛1,陶秀良1,熊丽萍2
(1.华中科技大学同济医学院附属同济医院中西医结合科,武汉 430030;2.广州军区武汉总医院病理科,武汉 430070)
目的 观察不同浓度雄黄对体外胃腺癌细胞株SGC-7901细胞凋亡的影响。方法采用噻唑蓝(MTT)法检测0,10,20,50,80 μg·mL-1浓度雄黄对胃腺癌细胞SGC-7901增殖抑制率的影响;采用膜联蛋白Ⅴ/碘化丙啶双染色法及流式细胞仪检测0,20,50,80 μg·mL-1浓度雄黄对SGC-7901细胞凋亡的影响。结果10,20,50,80 μg·mL-1浓度雄黄在24和48 h对SGC-7901细胞株的抑制率分别为6.15%,7.54%,42.31%,63.54%以及32.56%,46.14%,64.51%,87.52%,组间差异有统计学意义(P<0.05)。24和48 h后细胞半数抑制浓度分别约45.23,15.34 μg·mL-1。0,20,50,80 μg·mL-1浓度雄黄作用24 h后诱导的细胞早期凋亡率依次为(11.10±2.10)%,(15.31±1.30)%,(25.81±2.68)%,(43.62±8.51)%,组间差异有统计学意义(P<0.05);晚期凋亡率依次为(1.84±0.25)%,(4.41±0.09)%,(4.37±0.14)%,(5.00±0.10)%,差异无统计学意义(P>0.05)。结论高纯度雄黄可抑制胃腺癌细胞增殖和诱导细胞早期凋亡。
雄黄;胃腺癌;细胞凋亡
胃癌(gastric cancer,GC)是全球最常见的恶性肿瘤之一。据美国癌症协会统计,2013年美国约有21 600例新发胃癌病例,其中男13 230例,女8 370例;并预期有6 740例男性及4 250例女性胃癌患者死亡[1]。胃癌的流行病学有明显的地域差异,美国及澳洲发病率低,日本、丹麦以及发展中国家发病率高。我国属胃癌高发地区,由于人口基数大,我国每年新发胃癌病例数占全球的比例40%或40%以上[2],并且具有早期诊断率低、晚期比例大、病死率高和生存率低等特点。由于中晚期胃癌单纯依靠手术难以根治,化学治疗(化疗)联合分子靶向药物日益成为晚期胃癌的主要治疗方法。胃癌虽对化疗相对敏感,但由于胃癌疾病异质性强,目前尚无标准治疗方案,即便采用表柔比星+顺铂+氟尿嘧啶(ECF)、多西他赛+顺铂+氟尿嘧啶(DCF)、奥沙利铂+亚叶酸钙+氟尿嘧啶(FOLFOX)等新含铂联合化疗方案及分子靶向治疗,晚期胃癌患者的5年总生存率仍令人失望。因此,发掘新的有效治疗药物势在必行。雄黄为硫化物类矿物,在祖国医学中既往多用于治疗痈肿疗疮、蛇虫咬伤、虫积腹痛、惊
和疟疾等。随着砒霜(As2O3)在治疗恶性肿瘤方面取得诸多成果,与之同属砷剂的另一天然化合物雄黄开始引起人们的关注。近年研究结果表明,雄黄除具有抗炎镇痛、抑制细菌生长、抗病毒等作用外,尚有一定的抗肿瘤效应[3]。笔者在本研究拟观察不同浓度高纯度雄黄体外对胃腺癌细胞株SGC-7901细胞凋亡的影响,探讨其作用机制。
1 材料与方法
1.1 实验细胞 胃腺癌细胞株SGC-7901由华中科技大学同济医学院附属同济医院肿瘤科实验室惠赠。
1.2 主要试剂与仪器 雄黄粉(购自湖北省中药材公司,经华中科技大学同济医学院附属同济医院药学部魏世超副主任药师鉴定为硫化物类矿物雄黄族雄黄),DMEM(Dulbecco's Modified Eagle Medium)高糖培养液(Hyclone公司,批号:NWM0542),胎牛血清(杭州四季青公司,批号:120112),乙二胺四醋酸(Ethylene diamine tetraacetic acid,EDTA)-胰蛋白酶消化液、双抗溶液(青霉素∶链霉素=1∶1)(湖北百奥斯生物科技有限公司),四甲基偶氮唑盐[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT]试剂盒,Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术研究所,批号:C0009,C1063),流式细胞仪(美国BDFACS Aria)。
1.3 高纯度雄黄的制备 将雄黄及水按体积比1∶2用星式球磨机球磨72 h,制备雄黄微细粉末,加水研磨5 min,再加水搅拌2 min,644×g离心2 min,倒出上清液,重复3次后再用无水乙醇洗3次;旋转蒸发器干燥后60℃真空减压干燥制备干燥雄黄粉末,纯度大于98%。氯化钾饱和硝酸溶液溶解,氢氧化钠溶液调pH至7.0,磷酸盐缓冲液(phosphate buffered solution, PBS)定容,配成2 mg·mL-1的储备液,经筛孔内径0. 22 μm滤膜过滤除菌后,4℃保存备用。
1.4 细胞培养 将加入细胞培养液的胃腺癌细胞株SGC-7901置于5%二氧化碳(CO2)、37℃恒温培养箱培养,用EDTA-胰蛋白酶消化液消化后收集细胞并传代。
细胞培养液配置:DMEM高糖培养液90 mL,添加双抗溶液(青霉素100U·mL-1,链霉素100 μg·mL-1)1 mL,胎牛血清10 mL,使血清终浓度为10%。
1.5 MTT法检测药物对细胞生长抑制作用 取生长对数期状态良好的细胞消化后稀释成5×104个·mL-1,接种于96孔板,每孔为100 μL。设置空白对照组(调零孔)、阴性对照组(不加药物的细胞)和4个药物组,每组设复孔6个。每次种板2块(两个时限)。将2 mg·mL-1雄黄药物储备液以DMEM高糖培养液配成浓度梯度10,20,50,80 μg·mL-1。将配制各浓度雄黄溶液于药物组每孔加100 μL,96孔板周围加入PBS 100 μL以消除边缘效应。分别置于5% CO2、37℃培养箱中孵育24,48 h。培养结束前4 h加入MTT工作液50 μL,细胞培养箱内继续孵育4 h。细胞板底肉眼可见少量紫色结晶,显微镜下观察部分细胞周围有丝状结晶状物质,用100 μL移液枪小心吸去上清液,保留底部紫色结晶,然后加入溶液A 100 μL, 37℃孵育15 min,待紫色结晶完全溶解。
酶标仪570 nm波长检测各孔的吸光度(A)值,并计算细胞生长抑制率。抑制率(%)=[1-(药物组A值-本底A值)/(阴性对照组A值-本底A值)]× 100%(本底为无细胞无药物的调零孔)。重复3次取平均值。
1.6 流式细胞仪检测细胞凋亡率 取生长对数期状态良好细胞同前法消化,将稀释至1×105个·mL-1的细胞种于6孔板,每孔2 mL。分为阴性对照组及3个药物组,每组设3个复孔。DMEM高糖培养液配制20,50,80 μg·mL-1浓度梯度雄黄溶液备用。细胞贴壁后取出,PBS洗涤3次,弃PBS,分别加入新配制的各浓度雄黄溶液,每孔2 mL,阴性对照组加DMEM高糖培养液2 mL作为对照,标记后平放入恒温箱中培养。取培养时限结束的细胞,用不含EDTA的胰酶消化液消化细胞3 min,镜下观察细胞间隙出现时,完全培养液终止消化,吹打下全部细胞,收集于离心管内,于644×g离心5 min,弃上清液,PBS洗2次,再离心弃上清液。加入去离子水稀释后的Binding Buffer(4∶1)500 μL入离心管,悬浮细胞。加入荧光素标记膜联蛋白Ⅴ(Annexin V-FITC)5 μL混匀后,再加入碘化丙啶(propidium iodide,PI)10 μL混匀。室温、避光、反应5~15 min后于流式细胞仪下检测细胞凋亡率。
1.7 统计学方法 用SPSS19.0版软件统计分析,计量资料用均数±标准差(±s)表示,MTT数据组间比较用多因素方差分析,流式细胞仪测凋亡率比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 对胃腺癌SGC-7901细胞株生长抑制作用 MTT法检测表明,高纯度雄黄呈时间和剂量依赖性抑制SGC-7901细胞增殖,各组均差异有统计学意义(P<0.05),见表1。24,48 h后细胞半数抑制浓度(half inhibitoryconcentration,IC50)分别约45.23, 15.34 μg·mL-1。
2.2 对胃腺癌SGC-7901细胞凋亡的影响 根据MTT试验结果选择24 h为作用时限,SGC-7901细胞经0,20,50,80 μg·mL-1高纯度雄黄作用24 h,细胞早期凋亡率依次分别为(11.10±2.10)%,(15.31±1.30)%, (25.81±2.68)%,(43.62±8.51)%,凋亡率随雄黄浓度升高呈浓度依赖性,各浓度组差异有统计学意义(P<0.05);晚期凋亡及坏死率依次为(1.84± 0.25)%,(4.41±0.09)%,(4.37±0.14)%,(5.00± 0.10)%,晚期凋亡及坏死细胞较对照组明显增加,但各浓度组间比较差异无统计学意义(P>0.05)。流式检测结果见图1。
表1 不同浓度雄黄对SGC-7901细胞生长抑制作用Tab.1 Growth inhibition of different concentrations of realgar on the SGC-7901 cells ±s
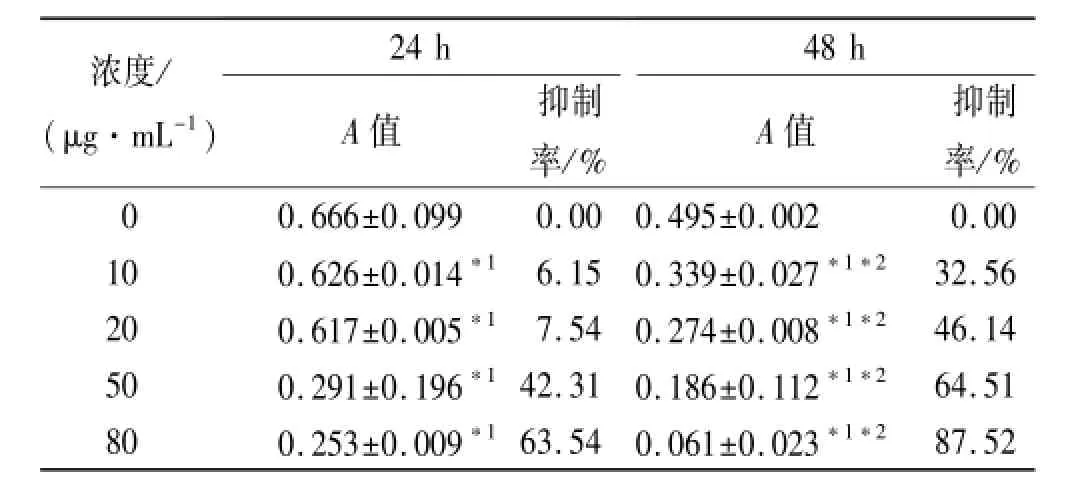
表1 不同浓度雄黄对SGC-7901细胞生长抑制作用Tab.1 Growth inhibition of different concentrations of realgar on the SGC-7901 cells ±s
与0 μg·mL-1比较,*1P<0.05;与24 h比较,*2P<0.05Compared with 0 μg·mL-1group,*1P<0.05;Compared with the same concentration group at 24 h,*2P<0.05
浓度/ (μg·mL-1) 24 hA值抑制率/% 48 hA值抑制率/% 87.52 00.666±0.0990.000.495±0.0020.00 100.626±0.014*16.150.339±0.027*1*232.56 200.617±0.005*17.540.274±0.008*1*246.14 500.291±0.196*142.310.186±0.112*1*264.51 800.253±0.009*163.540.061±0.023*1*2
3 讨论
我国为胃癌高发地区,胃癌年患病率和病死率均为世界平均水平的2倍多[4]。由于我国胃癌患者发现时多为中晚期,即使采用包括姑息手术、放射治疗(放疗)、化疗、分子靶向治疗等综合治疗手段,5年生存率依然低下。因此,积极寻找有效治疗胃癌的药物仍是目前亟需解决的重要难题。
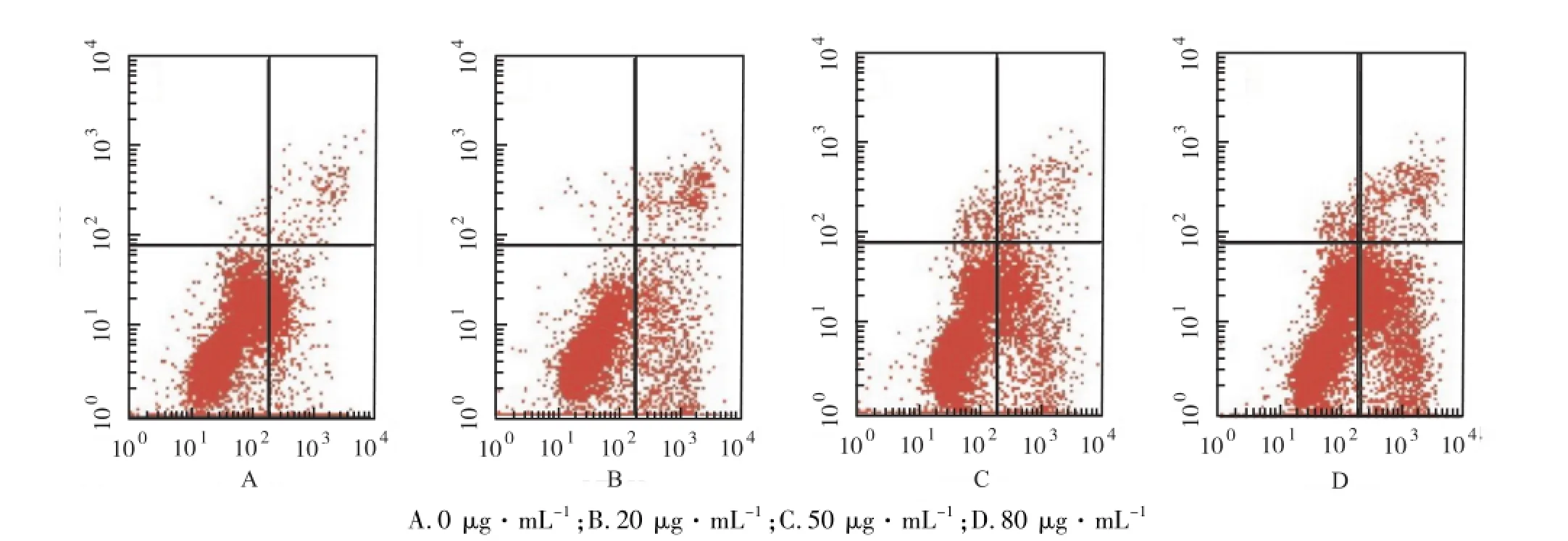
图1 不同浓度雄黄作用SGC-7901细胞24 h后凋亡变化Fig 1 Apoptosis of SGC-7901 cells 24 h after treatment with different concentrations of realgar
雄黄为硫化物类矿物雄黄族雄黄,主含二硫化二砷(As2S2或As4S4),在传统医学中有悠久的使用历史。现代研究发现,雄黄对人类多种肿瘤如白血病[5]、多发性骨髓瘤[6]、淋巴瘤[7]、宫颈癌[8]、胶质瘤[9]、肺癌[10]、肝癌[11]、卵巢癌[12]等都具有明显的抗肿瘤作用,其作用机制与诱导细胞凋亡、抑制肿瘤细胞增殖、促进肿瘤细胞分化、抗肿瘤血管形成、调节基因表达有关,显示良好的应用前景。然而,雄黄难溶于水,传统的处理工艺如水飞、酸洗、酸奶洗等虽使用多年,但未能解决雄黄的溶解度问题。临床上雄黄仍以粗糙的原粉入药,这种单一的给药方式,严重影响其在体内的吸收和分布,限制了临床应用范围。近年来,国内曾有学者试图采用纳米技术解决难溶性雄黄的生物利用度问题,降低毒副作用[13]。本实验采用高能球磨法制备雄黄微细粉末[14],可使制备的雄黄粉末粒径达到纳米级分布,并可通过淘洗除去可溶性杂质三氧化二砷及有机物杂质,是目前解决难溶性雄黄的生物利用度的较理想方法。
本研究结果表明,雄黄对胃腺癌细胞株SGC-7901具有明显的抑制作用,并呈浓度及时间依赖性,而对细胞凋亡周期的影响主要体现在抑制细胞早期凋亡。凋亡指该类细胞的死亡形态表现为细胞核裂解,然后被细胞质包绕,形成凋亡小体,再被其他细胞吞噬清除,尤如树叶凋落,周围没有炎症细胞浸润,不出现炎症反应。细胞坏死则是指通过炎症反应彻底破坏细胞内成分,诱导炎症反应。近年来对抗肿瘤药物选择到底是期待凋亡还是坏死存在争议。有学者认为对于选择肿瘤药物,如果药物导致细胞大量坏死则正常细胞亦难以承受,将会降低药物安全度。亦有学者认为治疗肿瘤应该利用“细胞坏死诱导炎症反应”机制,并称部分肿瘤患者在罹患严重感染后肿瘤“自发性消退”可能通过该类机制[15]。本研究发现,增加雄黄浓度并不会导致肿瘤细胞晚期凋亡及坏死细胞明显增多,表明雄黄在肿瘤治疗中主要表现在抑制肿瘤细胞的早期凋亡,细胞坏死少,药物安全性相对高,但尚需进一步行动物体内药物试验评估其效价的优劣。
[1] SIEGEL R,NAISHADHAN D,JEMAL A,et al.Cancer statistics[J].CA Cancer J Clin,2013,63(1):11-30.
[2] 王婕敏,林三仁.胃癌研究及诊治新进展[J].胃肠病学和肝病学杂志,2012,21(1):3-5.
[3] 马淑云,高尚风,陈蕊,等.雄黄诱导卵巢癌细胞珠SKOV3和COC1凋亡的实验研究[J].陕西医学杂志, 2012,41(8):942-944.
[4] 何立丽,孙桂芝,张培彤.胃癌的病因病机研究进展[J].北京中医药,2009,28(3):234-236.
[5] 罗丽云,张天蓝,王夔,等.雄黄纳米微粒对人白血病细胞株HL-60的诱导分化作用[J].中国中药杂志,2006, 31(16):1343-1345.
[6] 王梦昌,刘陕西,刘蓬勃.雄黄对多发性骨髓瘤细胞株RPMI8226细胞基因表达谱的作用[J].中南大学学报, 2006,31(1):24-27.
[7] WANG X,ZHANG X,XU Z,et al.Reversal effect of arsenic sensitivity in human leukemia cell line K562 and K562/ ADM using realgar transforming solution[J].Biol Pharm Bull,2013,36(4):641-648.
[8] 尹伶,濮德敏,吴青,等.As4S4对宫颈癌HeLa细胞增殖抑制和诱导凋亡的初步研究[J].中国癌症杂志,2006, 16(11):919-921.
[9] 王汉斌,庞琦,富壮,等.雄黄体外诱导C6胶质瘤细胞凋亡的特点及分析[J].山东大学学报:医学版,2009,48 (1):22-29.
[10] 杨明,易娟,陈静,等.纳米雄黄对肺癌A549细胞的凋亡诱导作用[J].亚太传统医药,2010,6(6):8-10.
[11] 黄娥娇,戴支凯.雄黄抗人肝癌BEL-7402细胞作用[J].重庆医科大学学报,2011,36(8):936-939.
[12] 陈杰,郭兴罡,张纪妍.雄黄抑制卵巢癌细胞株SKOV3增殖和诱导凋亡的体外研究[J].实用肿瘤学杂志, 2012,26(3):193-198.
[13] 王晓波,袭荣刚.复方纳米雄黄中砷在大鼠体内的药动学[J].中国新药杂志,2007,16(21):1758-1761.
[14] ZHAO W Z,LU X,YUAN Y,et al.Effect of size and processingmethodonthecytotoxicityofrealgar nanoparticles in cancer cell lines[J].Int J Nanomedicine, 2011,6:1569-1577.
[15] 吴克复,马小彤,宋玉华.期望肿瘤细胞凋亡还是坏死? [J].中国实验血液学杂志,2005,13(6):921-923.
DOI 10.3870/yydb.2014.10.013
Effects of Different Concentrations of Realgar on the Apoptosis of Gastric Adenocarcinoma Cells
HU Shao-ming1,ZHANG Ying1,TAO Xiu-liang1,XIONG Li-ping2
(1.Department of Integrated Traditional Chinese Medicine&Western Medicine,Tongji Hospital Affiliated with Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;2.Department of Pathology,Wuhan General Hospital of Guangzhou Command,Wuhan 430070,China)
ObjectiveTo observe the effect of different concentrations of realgar on the apoptosis of gastric adenocarcinoma cell Line SGC-7901.MethodsMTT assay was conducted to detect the growth inhibition ratio of SGC-7901 cells treated by different concentrations of realgar(0,10,20,50 and 80 μg·mL-1).AnnexinⅤ/Propidium iodide double staining method together with flow cytometry were used to detect the effect of realgar at 0,20,50 and 80 μg·mL-1on the apoptosis of SGC-7901 cells.ResultsThe growth inhibition ratio of SGC-7901 cells by various concentrations of high-purity realgar(10,20,50 and 80 μg·mL-1)was 6.15%,7.54%,42.31%and 63.54%,respectively,24 h after realgar treatment.At 48 h after the treatment,the growth inhibition ratio rose to 32.56%,46.14%,64.51%and 87.52%,respectively(P<0.05).Half inhibitory concentration was 45.23 μg·mL-1after 24 h and 15.34 μg·mL-1after 48 h.After treated by various concentrations of pure realgar(0,20,50 and 80 μg·mL-1)for 24 h,early cell apoptosis rate was(11.10±2.10)%,(15.31±1.30)%,(25.81±2.68)%and(43.62± 8.51)%,respectively,significantly different among the four groups(P<0.05).The late cell apoptosis rate in each group was (1.84±0.25)%,(4.41±0.09)%,(4.37±0.14)%and(5.00±0.10)%,respectively(P>0.05).ConclusionHigh purity realgar can inhibit the proliferation and induce early apoptosis of gastric adenocarcinoma SGC-7901 cells.
Realgar;Gastric adenocarcinoma;Apoptosis
R285.5;R965
A
1004-0781(2014)10-1306-04
2014-02-18
2014-04-20
胡少明(1955-),男,湖北武汉人,主任医师,学士,研究方向:肿瘤中西医结合治疗。电话:027-83663217,E-mail:smhu@tjh.tjmu.edu.cn。
熊丽萍(1972-),女,江西九江人,主治医师,硕士,研究方向:肿瘤病理学。电话:027-50772675,E-mail:ripplexiong@hotmail.com。

