大剂量甲氨蝶呤化学治疗48 h血药浓度与消除相末端药动学和毒副反应的关系*
汪洋,张华年,陈渝军,徐华,刘茂昌
(武汉市妇女儿童医疗保健中心药剂科,武汉 430016)
大剂量甲氨蝶呤化学治疗48 h血药浓度与消除相末端药动学和毒副反应的关系*
汪洋,张华年,陈渝军,徐华,刘茂昌
(武汉市妇女儿童医疗保健中心药剂科,武汉 430016)
目的 验证大剂量甲氨蝶呤(MTX)化学治疗(化疗)中给药开始48 h点血药浓度(C48h)对于预判消除相末端药动学特征和毒副反应的可靠性,为临床制订合理的解救治疗方案提供依据。方法急性淋巴细胞白血病患儿114例,行HDMTX化疗176次,MTX剂量为3~5 g·(m2)-1,24 h持续静脉滴注。用固相萃取高效液相色谱法测定MTX用药后24,48,72 h血清中MTX浓度。病例按C48h≥1 μmol·L-1和C48h<1 μmol·L-1分组,采用残数法计算两组的消除相药动学参数,采用Ridit分析比较两组的毒副反应差异。结果C48h≥1 μmol·L-1组的C72h和AUC48-∞均显著高于C48h<1 μmol·L-1组(P<0.01);C48h≥1 μmol·L-1组在血液系统、胃肠系统和肝胆系统的毒副反应也显著强于C48h<1 μmol·L-1组(P<0.05)。C48h≥1 μmol·L-1组解救天数(5.02±1.65)d,C48h<1 μmol·L-1组解救天数为(3.05± 0.21)d。结论C48h可以很好地预测MTX消除相末端的药动学特征和毒副反应,C48h≥1 μmol·L-1可以作为MTX消除延迟的临床诊断依据以指导后期解救。
甲氨蝶呤;白血病,淋巴细胞,急性;血药浓度;消除延迟;药动学;毒性反应
大剂量甲氨蝶呤(methotrexate,MTX)结合亚叶酸钙(folinic acid calcium,FC)解救(HDMTX-CF)方案是目前预防儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)髓外白血病和全身巩固治疗的有效措施[1]。患儿接受大剂量MTX化学治疗(化疗)后,如果CF解救不及时,易发生骨髓抑制、黏膜损害、急性肝损害等严重的MTX浓度依赖型不良反应,但是如果CF解救剂量过多又会对化疗效果产生影响[2]。因此,根据血清MTX浓度监测结果来调整CF解救的次数和剂量已成临床共识[3]。尤其是对于大剂量MTX化疗中存在约10%消除异常的患儿[4],及早判定并加以针对性的解救是避免不良反应的关键。国内采用大剂量MTX 3~5 g·(m2)-1持续静脉滴注24 h化疗方案的单位,也多以给药后48 h血清MTX浓度(C48h)≥1 μmol·L-1来判定消除延迟事件的发生[4-5],并因此而加大CF的解救次数或剂量[6-7]。该判断标准是否灵敏可靠直接关系到后期化疗的安全性和有效性。笔者在本研究中将通过对比分析,验证C48h对于预判MTX消除相末端药动学行为和后期毒副反应的可靠性,为临床制定合理有效的CF解救方案提供依据。
1 资料与方法
1.1 临床资料 2009年3月至2013年6月我院血液内科收治的患儿,纳入研究标准:①符合小儿ALL诊断标准[8];②经前期化疗后ALL处于完全缓解期;③行HDMTX-CF化疗方案预防髓外白血病者;④化疗期间进行血清MTX浓度监测者。排除标准:①化疗前血、尿常规及肝、肾功能等生化指标异常者;②未严格执行化疗方案者;③由于严重不良反应或其他原因退出化疗者;④关键性研究资料缺失者;⑤存在临床医师或研究人员认为不适合纳入研究的其他因素者。排除后共收入研究病例114例,行HDMTX-CF化疗共176例次(入组顺序为:先行收集88例次C48h≥1 μmol·L-1的疗程病例,共63例,定为消除延迟组;再按1∶1收集88例次C48h<1 μmol·L-1的疗程病例,共51例,定为消除正常对照组),资料见表1。本研究经本院伦理委员会批准,患儿家属对本研究过程知晓并签署知情同意书。
1.2 用药方案 MTX剂量为3~5 g·(m2)-1,于巩固治疗休息1~3周后,血、尿常规及肝、肾功能正常,无感染的证据,骨髓均为增生活跃或明显活跃者开始治疗。首剂1/5~1/6量(不超过500 mg)作为突击量0.5 h快速静脉滴注,余量23.5 h持续静脉滴注。大剂量MTX化疗期间“三联鞘注”、水化、碱化等方法参照文献[8]。MTX用药36 h后用CF解救,每次15 mg·(m2)-1, q6 h,首次静脉注射,之后口服或肌内注射,如出现消除延迟则依据血药浓度适当追加CF解救次数或剂量,解救至MTX血药浓度<0.1 μmol·L-1[8]。
1.3 标本采集及血药浓度测定 分别于MTX静脉滴注开始后第24,48,72小时(是否需要测定96 h及以后时间点血清MTX浓度根据解救情况而定)采患儿静脉血3 mL,离心取血清,采用固相萃取高效液相色谱法(Spe-HPLC)[9]测定血清MTX浓度。
1.4 药动学原理及参数计算 MTX静脉滴注结束后的体内过程符合二室一级消除药动学模型[10],即具有α相(分布相)和β相(消除相)。数学表达式为:

其中R和S为常系数,α为分布速率常数,β为消除速率常数,t为滴注停止后时间。
根据残数法的原理,因为α≫β,当t充分大时(在消除相末端),(Ⅰ)式可简化为:
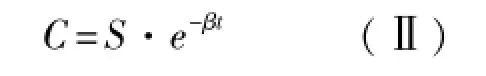
对(Ⅱ)式取对数得:
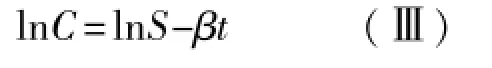
表1 114例患儿的生物学特征Tab.1 Biocharacteristics of 114 patients ±s
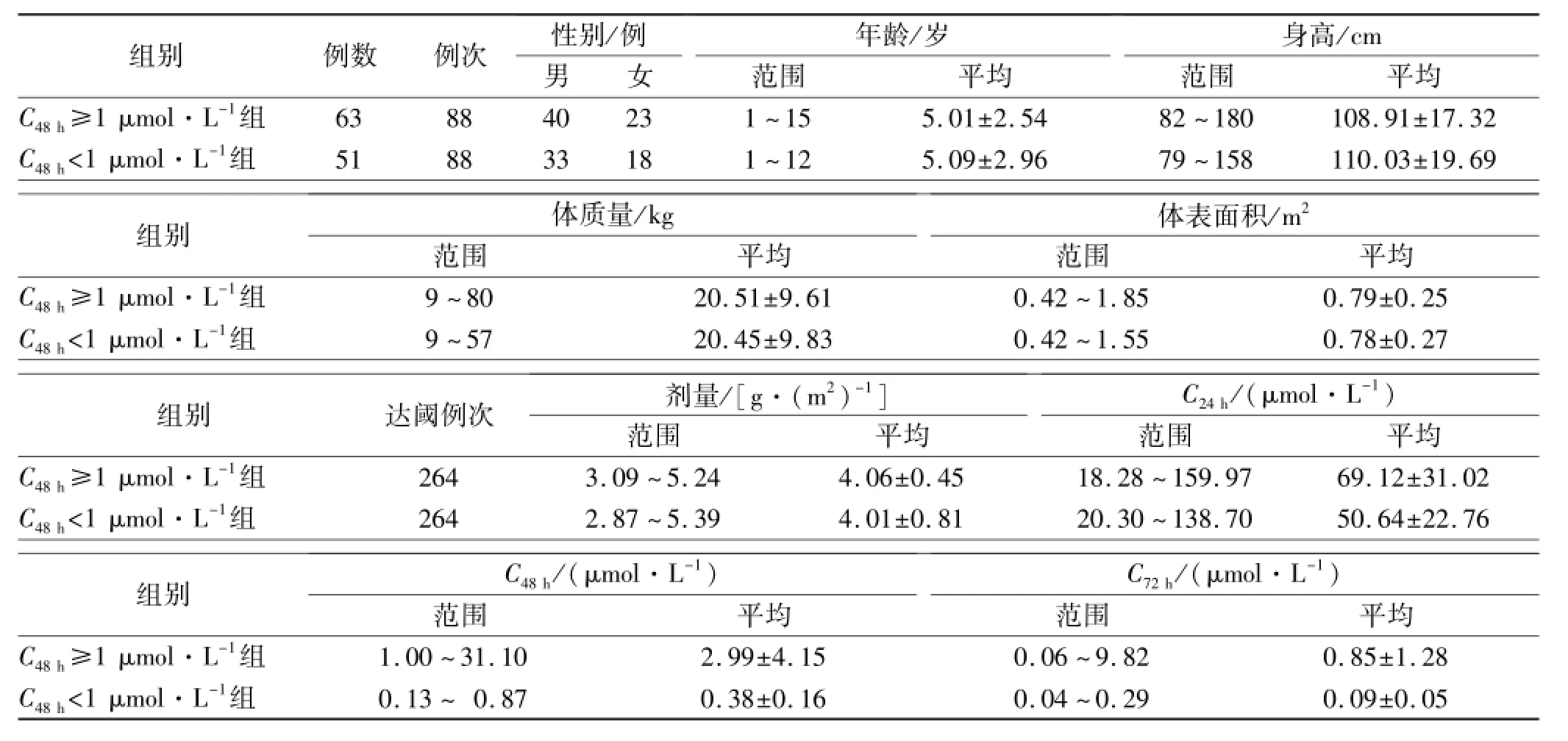
表1 114例患儿的生物学特征Tab.1 Biocharacteristics of 114 patients ±s
组别例数例次性别/例年龄/岁身高/cm范围平均C48h≥1 μmol·L-1组男女范围平均638840231~155.01±2.5482~180108.91±17.32C48h<1 μmol·L-1组518833181~125.09±2.9679~158110.03±19.69组别体质量/kg 体表面积/m2范围平均C48h≥1 μmol·L-1组范围平均9~8020.51±9.610.42~1.850.79±0.25C48h<1 μmol·L-1组9~5720.45±9.830.42~1.550.78±0.27组别达阈例次剂量/[g·(m2)-1]C24h/(μmol·L-1)范围平均C48h≥1 μmol·L-1组2643.09~5.244.06±0.4518.28~159.9769.12±范围平均31.02C48h<1 μmol·L-1组2642.87~5.394.01±0.8120.30~138.7050.64±22.76组别C48h/(μmol·L-1)C72h/(μmol·L-1)范围平均C48h≥1 μmol·L-1组范围平均1.00~31.102.99±4.150.06~9.820.85±1.28C48h<1 μmol·L-1组0.13~0.870.38±0.160.04~0.290.09±0.05
即lnC-t作图为一直线,斜率为-β,因此取消除相末端的两个浓度值代入(Ⅲ)式即可计算出MTX的消除速率常数β。据群体药动学研究报道[11]:MTX24 h持续静脉滴注时,药物由分布相转入消除相的时间为MTX开始用药后约36 h(34.0~41.4 h),故48 h及以后时间点可以视为MTX消除相末端。本研究取C48和C72,代入(Ⅲ)式得:
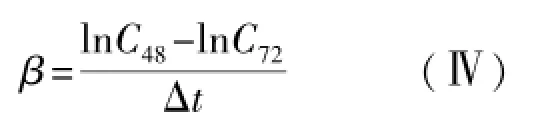
其中Δt为两次取样时间间隔,本研究Δt=24 h。进而可计算出患儿MTX消除半衰期为:
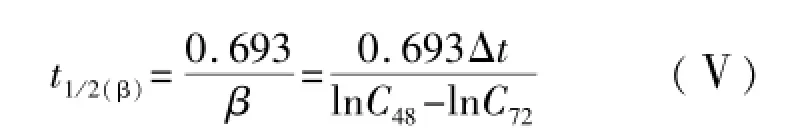
由(Ⅱ)式可知,48 h后t*时间的血药浓度表达式为:
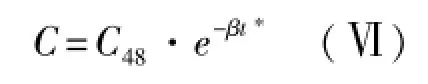
对(Ⅵ)式积分得MTX消除相末端(48 h后)药时曲线下面积为:

1.5 毒副反应观察及评价 医师或临床药师观察大剂量MTX用药后1~10 d内血液系统、消化系统不良反应,逐日详细记录并统计最终解救天数。指定专人按美国国家癌症研究所2009年发布的化疗药物常见不良反应事件评价标准(CTCAE v4.02版)对记录到的不良反应分级评定。该标准共分为0~Ⅴ级:0级为无;Ⅰ级为轻度,无需治疗;Ⅱ级为中度,需要较小或局部治疗;Ⅲ级为严重但不会立即危及生命,导致住院延长;Ⅳ级为危及生命而需要紧急治疗;Ⅴ级为相关的死亡。另指定专人盲法复核,若存异议,待协商一致后作出最终评定结果。解救天数统计为大剂量MTX用药开始至血药浓度低于安全阈值(0.1 μmol·L-1)的时间。
2 结果
2.1 药动学参数比较结果 依据血药浓度监测结果和“1.4”项下公式计算得两组消除相末端药动学参数见表2。经秩和检验两组C72h和AUC48-∞差异有统计学意义(P<0.01),而β和t1/2(β)差异无统计学意义(P>0.05)。
2.2 毒副反应和解救时间比较 大剂量MTX化疗后的毒副反应主要分为血液系统、胃肠系统、肝胆系统。记录到的血液系统反应主要表现为骨髓抑制所造成的三系血细胞减少,最多见的是白细胞减少;胃肠系统反应主要为恶心呕吐、食欲不振、腹痛、腹泻、口腔黏膜炎、肛门黏膜炎;肝胆系统损害主要表现为丙氨酸氨基转移酶、天冬氨酸氨基转移酶的突发性升高,重症继发肝衰竭。各分组评定见表3,经Ridit分析,两组毒副反应差异有统计学意义(P<0.05)。解救天数的统计发现C48h≥1 μmol·L-1组为(5.02±1.65)d,而C48h<1 μmol·L-1组为(3.05±0.21)d,两组经秩和检验差异有统计学意义(Z=-10.303,P<0.01)。另从Kaplan-Meier统计结果(图1)可以看出C48h≥1 μmol·L-1组血药浓度降低至安全阈值(0.1 μmol·L-1)所需时间明显长于C48h<1 μmol·L-1组。
3 讨论
近年来,国内外学者试图从常规生化检验值[12]、化疗期间的偶联事件[5]及药物代谢基因组学[13]的研究当中寻找引起MTX消除延迟的原因,以期在化疗前就能提前预判MTX在ALL患儿体内的个体药动学特征,尽早预报MTX毒性蓄积事件的发生以制定合理的CF解救方案,但是发现影响因素繁多且不确定,目前尚无定论。因此现阶段血药浓度监测在大剂量MTX化疗中的作用无可取代,尤其应重视对消除相末端(48 h后)的监测。徐卫群等[4]研究发现,MTX给药开始后24 h血药浓度可预测化疗效果,48 h浓度则可反映后期排泄情况。ODOUL等[10]也发现,采用48 h血药浓度进行Bayesian反馈,可以获得较准确的药动学参数,对于预测MTX后期消除情况最为敏感。本研究从药动学和毒副反应两方面重新验证C48h对于消除相末端预测作用的可靠性。
表2 两组患儿的药动学参数Tab.2 Pharmacokinetic parameters of two groups of patients ±s
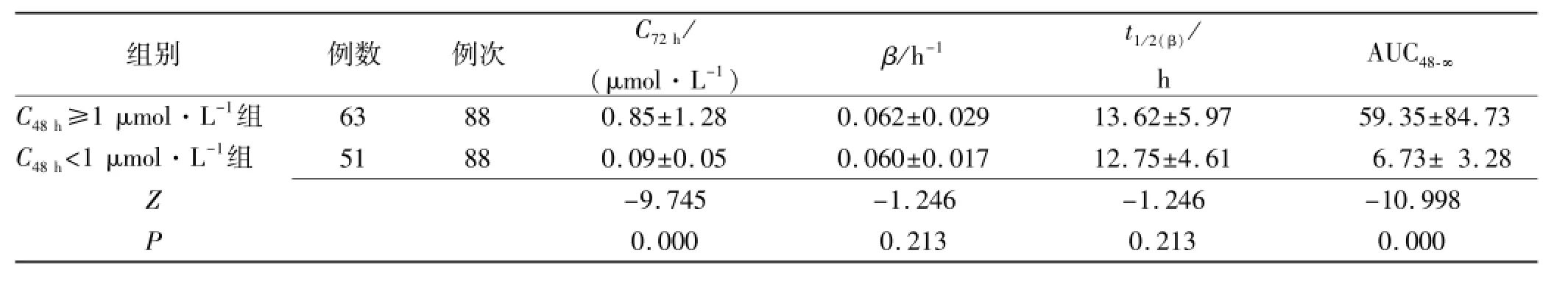
表2 两组患儿的药动学参数Tab.2 Pharmacokinetic parameters of two groups of patients ±s
组别例数例次C72h/ (μmol·L-1)β/h-1t1/2(β)/ h AUC48-∞C48h≥1 μmol·L-1组63880.85±1.280.062±0.02913.62±5.97 59.35±84.73C48h<1 μmol·L-1组51880.09±0.050.060±0.01712.75±4.61 6.73±3.28Z-9.745-1.246-1.246-10.998P0.0000.2130.2130.000
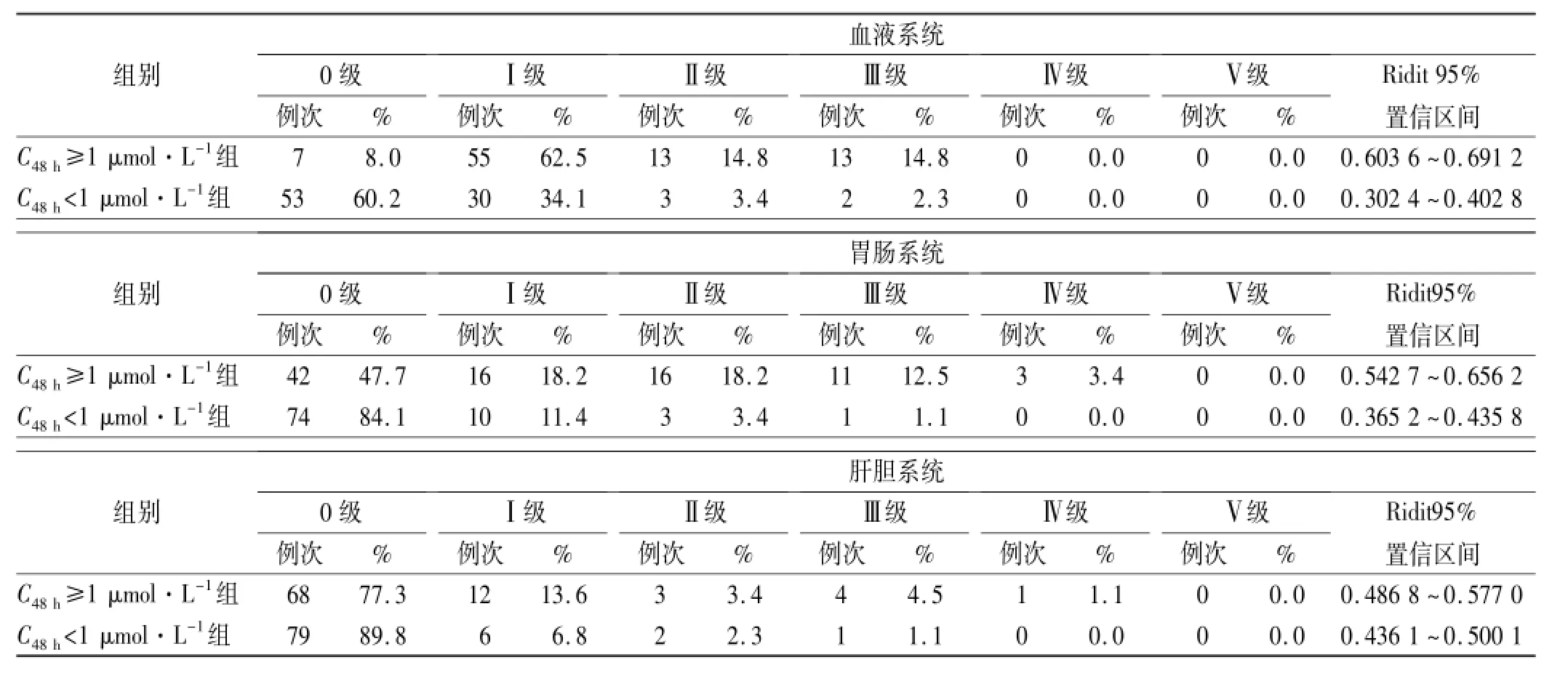
表3 两组患儿的毒副反应评级差异Tab.3 Toxic reaction ranks of two groups of patients
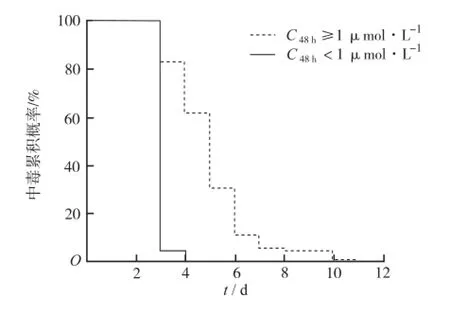
图1 两组解救时间Kaplan-Meier统计结果(n=176)Fig.1 Statistical results of Kaplan-Meier analysis on the saving time of two groups(n=176)
由于伦理学等原因,本研究只采集患儿两个时间点的血样对MTX消除相末端的药动学参数进行估算,虽然准确性稍有欠缺,但是也能较好地反映末端消除情况,研究得出的消除半衰期也与文献[14]报道的均值11.05 h十分接近。从药动学参数的比较结果可以看出,C48h≥1 μmol·L-1组的t1/2(β)长于C48h<1 μmol·L-1组,但差异无统计学意义,同时C48h≥1 μmol·L-1组的C72h和AUC48-∞均明显高于C48h<1 μmol·L-1组。由于C72h和AUC48-∞均是反映MTX在消除相末端暴露药量大小的指标,因此说明C48h可以很好地预测MTX在患儿体内的后期残留量,如C48h≥1 μmol·L-1则预示后期可能残留的MTX较多,且消除较慢,为避免毒副反应的发生需加大CF的解救剂量。另外这种关联关系也说明MTX的消除延迟和毒性蓄积在给药48 h内已经形成,为防止该类事件的发生,今后应更多关注给药48 h内机体对MTX的处置情况,如何在该时间段内即加速MTX的消除需要进一步研究。
从毒副反应的比较结果可以看出,虽然适当追加CF解救次数或剂量,但C48h≥1 μmol·L-1组在血液系统、胃肠系统和肝胆系统的毒副反应也都明显强于C48h<1 μmol·L-1组,与文献[15]结论相似。这说明CF解救的时机或剂量还不够完善,临床需研究更合理的专门应对消除延迟的解救方案。从Kaplan-Meier统计结果也可以看出C48h≥1 μmol·L-1组解救至安全阈值以下所需的时间明显长于C48h<1 μmol·L-1组。C48h<1 μmol·L-1组患儿在解救至第4天时血药浓度基本可降低至完全阈值以下,而C48h≥1 μmol·L-1组在第4天时血药浓度高于安全阈值的累积概率仍高达60%。结合药动学统计结果可以得出结论,C48h≥1 μmol·L-1组在消除相末端的MTX残留量大,暴露时间长,由此造成机体的毒性损伤也更明显。
因此,C48h可以很好地预测MTX消除相末端的药动学特征和毒副反应,C48h≥1 μmol·L-1可以作为MTX消除延迟临床诊断的依据,并因此加大CF解救剂量和提早采取针对性的毒副反应预防措施。
[1] 张华年,肖伟,徐华,等.7-OHMTX/MTX比值判断儿童急性淋巴细胞白血病化疗中甲氨蝶呤不良反应的价值[J].中国医院药学杂志,2009,29(18):1554-1557.
[2] SKARBY T V,ANDERSON H,HELDRUP J,et al.High leucovorin doses during high-dose methotrexate treatment may reduce the cure rate in childhood acute lymphoblastic leukemia[J].Leukemia,2006,20(11):1955-1962.
[3] LE GUELLEC C,BLASCO H,BENZ I,et al.Therapeutic drug monitoring of methotrexate after its administration in high-dose protocols[J].Therapie,2010,65(3):163-169.
[4] 徐卫群,汤永民,方澄清,等.大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病排泄延迟分析[J].中华血液学杂志,2005,26(01):15-17.
[5] 华瑛,赵卫红,卢新天.大剂量甲氨蝶呤消除相血药浓度及其影响因素[J].实用儿科临床杂志,2010,25(3): 211-214.
[6] 杨丽华,卢新天,顾健,等.大剂量氨甲蝶呤持续静脉滴注后四氢叶酸钙解救方案的研究[J].中华儿科杂志, 2005,43(5):393-394.
[7] 魏筱华,郑雪莲,邹德琴,等.大剂量甲氨蝶呤治疗小儿急性淋巴细胞白血病的血药浓度与不良反应相关性探讨[J].中国现代应用药学,2011,28(1):79-81.
[8] 中华医学会儿科学分会血液学组.儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J].中华儿科杂志, 2006,44(5):392.
[9] 张华年,文玲莉,张少文,等.固相萃取高效液相色谱法检测生物样本中甲氨蝶呤[J].药物分析杂志,2000,20 (6):401-404.
[10] ODOUL F,LE GUELLEC C,LAMAGNERE J P,et al. Prediction ofmethotrexateeliminationafterhighdose infusion in children with acute lymphoblastic leukaemia using a population pharmacokinetic approach[J].Fundam Clin Pharmacol,1999,13(5):595-604.
[11] 杨丽华,卢炜.用群体药物动力学方法分析大剂量甲氨蝶呤持续静滴时间和解救开始时间[J].儿科药学杂志, 2006,12(1):1-4.
[12] 张春燕,顾健.大剂量甲氨蝶呤在急性淋巴细胞白血病患儿体内血药浓度的相关因素分析[J].中国药房, 2009,20(2):138-140.
[13] VLAMING M L,PALA Z,VAN ESCH A,et al.Functionally overlapping roles of Abcg2(Bcrp1)and Abcc2(Mrp2)in the elimination of methotrexate and its main toxic metabolite 7-hydroxymethotrexatein vivo[J].Clin Cancer Res,2009, 15(9):3084-3093.
[14] 张善堂,屈建,杨林海,等.大剂量甲氨蝶呤在急性淋巴细胞白血病患儿体内的药动学研究[J].中国现代应用药学,2008,25(5):454-458.
[15] 李辉,刘爱国.大剂量甲氨蝶呤治疗儿童白血病血药浓度与疗效及安全性的相关性[J].医药导报,2013,32 (5):605-608.
DOI 10.3870/yydb.2014.10.019
Relationship Between Serum Concentration at 48 h and Pharmacokinetic Characteristics and Toxic Reactions at Terminal Elimination Phase After Starting High Dose Methotrexate Infusion
WANG Yang,ZHANG Hua-nian,CHEN Yu-jun,XU Hua,LIU Mao-chang
(Department of Pharmacy,Wuhan Women and Children Medical Care Center,Wuhan 430016,China)
ObjectiveTo recheck the reliability of methotrexate(MTX)serum concentration at 48 h(C48h)in predicting the pharmacokinetic characteristics and toxic reactions at terminal elimination phase after high dose MTX infusion and to provide a reference for determination of rational rescue regimen in clinic practice.MethodsIn total,114 cases of children with acute lymphoblastic leukemia(ALL)received 176 courses of high dose MTX chemotherapy treatment.The regimen was continuous infusion of MTX[3-5 g·(m2)-1]in 24 h.Plasma samples were treated with solid phase extraction and serum concentrations of MTX were determined by HPLC at 24,48 and 72 h(C24h,C48handC72h)after starting MTX infusion.All data were divided intoC48h≥1 μmol·L-1group andC48h<1 μmol·L-1group.The pharmacokinetic parameters of the two groups at elimination phase were estimated by residual method and the toxic reactions after MTX infusion of two groups were compared by Ridit analysis.ResultsTheC72hand AUC48-∞were significantly higher inC48h≥1 μmol·L-1group than inC48h<1 μmol·L-1group(P<0.01).The MTX toxicities to the blood,digestive and hepatic systems were significantly higher inC48h≥1 μmol·L-1group than inC48h<1 μmol·L-1group(P<0.05).ConclusionC48hcan predict the pharmacokinetic characteristics and toxic reactions at ther terminal elimination phase.Therefore,C48h≥1 μmol·L-1can be used as a marker of MTX elimination delay event to guide later rescue regimen.
Methotrexate;Leukemia,lymphoblastic,acute;Serum concentration;Elimination delay;Pharmacokinetics; Toxic reaction
R979.1
B
1004-0781(2014)10-1327-05
2013-12-19
2014-02-08
*湖北省卫生厅2011~2012年度科研项目(JX5B74)
汪洋(1982-),男,重庆市人,主管药师,学士,研究方向:临床药学。电话:027-82433462,E-mail:cattop3211 @qq.com。

