PLGA、壳聚糖纳米粒的制备及细胞毒性研究
薛延香,詹雪灵,刘 影,沈仁泽,晋冰玉,高 杰
(南方医科大学南方医院·南方医科大学口腔医学院,广东 广州 510515)
聚乳酸-羟基乙酸共聚物[poly(1actide-coglycolide),PLGA]是一种广泛用于制备生物膜或支架的合成聚合物之一,不仅具有良好的生物相容性和低毒性,而且还可通过调整共聚物中聚乳酸与聚羟基乙酸的比例而使其降解率从几周到几年不等[1-4]。壳聚糖(Chitosan,CS)是甲壳素脱乙酰基的产物,富含正电荷,其结构与细胞外基质中的多糖类似,且具有较好的生物相容性、降解性、无毒性、抑菌性、抗炎性、止血及促进伤口愈合等生物学特性[5-9]。由于PLGA和CS具有较好的生物学特性,两者均被广泛应用于医学领域。
目前,CS和PLGA纳米粒(粒径1~1 000 nm)主要作为载体携带药物或生物活性分子等,以达到缓释的目的[7,10-11]。PLGA 可操作性好且易于成形,但由于其亲水性差,不利于细胞的黏附;而CS虽亲水性相对较好,但其降解较快。因此,有学者提出,若将CS与PLGA混合不仅可提高其细胞的黏附性,并能缩短PLGA的降解时间[12]。有研究发现,用于组织工程的纳米级材料与普通材料相比拥有更佳的特性,能够更好地模拟人体器官或组织的微结构[13-14]。但应用前需确保纳米材料在发挥其应有作用时不会对机体产生毒副作用。目前尚未发现PLGA和CS 2种纳米粒混合材料用于牙周组织修复的相关研究。因此,本实验旨在制备PLGA、CS纳米粒,并初步观察其对人牙周膜细胞的毒性,为后期PLGA与CS纳米粒最佳混合比例的研究和3D打印复合纳米支架的制备奠定基础。
1 材料和方法
1.1 主要材料、试剂和仪器
PLGA(75∶25,粘度 0.46,山东省医疗器械研究所);CS(脱乙酰度≥95%,粘度40~100 MPa.s,广州天俊公司);聚乙烯醇、多聚磷酸钠(Sigma,美国);DMEM培养基(HyClone,美国);胎牛血清(FBS,Sciencell,美国);青/链霉素(青 10 KU/mL,链 10 mg/mL,Solarbio);2.5 g/L 胰酶/0.2 g/L EDTA消化液(吉诺);Ⅰ型胶原酶(BIOSHARP);四甲基偶氮唑盐(MTT,BIOSHARP);LEGENP MICRO 17R离心机(Thermo,美国);JY92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);GalaxyS+50 mL/L CO2恒温孵箱(RSBiotech,英国);Malvern Zetasizer 3000HS(Malvern,英国);H-9500透射电子显微镜(Hitachi,日本);RET basic safety control磁力搅拌器(IKA,德国);SpectraMax M5多功能酶标仪(Molecular Devices,美国)。
1.2 PLGA、壳聚糖纳米粒的制备
采用乳化溶剂挥发法[15]制备PLGA纳米粒:将100 mg PLGA溶于10 mL丙酮中,室温下磁力搅拌8 00 r/min至完全溶解后缓慢倒入40 mL 20 mg/mL聚乙烯醇溶液中,并继续磁力搅拌8 h;待溶剂完全挥发后(溶液呈淡蓝色),13 300 r/min离心15 min,去上清,沉淀部分用去离子水清洗3次并重悬后,超声处理20 s,自然风干备用。
用离子交联法[16]制备壳聚糖纳米粒:将20 mg CS溶于20 mL 1 mL/mL的冰醋酸溶液中,室温下磁力搅拌至完全溶解后,用10 moL/L-NaOH调节pH至4.6~6.0,然后再在磁力搅拌下将5 mL浓度为1 mg/mL的多聚磷酸钠溶液,逐滴滴入壳聚糖溶液中(约15 s/滴),待溶液呈淡蓝色时,13 300 r/min离心 15 min,去上清,沉淀部分用去离子水清洗3次并重悬后,超声处理20 s,自然风干备用。
1.3 PLGA、壳聚糖纳米粒的粒径及形态观察
取 PLGA、CS纳米粒悬液适量,用 Malvern Zetasizer 3000HS仪分别测定纳米粒的平均粒径及分散系数。
分别将适量PLGA、CS纳米粒悬液滴于铜网上,静置2 min后用镊子夹起铜网,并用滤纸吸去多余液体;室温下干燥后,置于透射电镜下观察并进行拍照。
1.4 人牙周膜细胞培养
选取12~24周岁志愿者(知情同意)因正畸或阻生拔除的无龋、无牙周炎的正畸牙或阻生牙,用PBS(含双抗)冲洗3次后,刮取牙根中1/3的牙周膜组织,并将其剪碎;然后用DMEM完全培养液冲洗3次,添加200 μLⅠ型胶原酶,置于37℃孵箱中消化10 min,用DMEM完全培养液终止消化后,1 000r/min离心3 min;吸取组织块平铺于35 mm的培养皿,并盖以24 mm×24 mm的盖玻片后,加入 1.5 mL含 100 mL/L FBS和青霉素10 KU/mL、链霉素10 mg/mL的DMEM培养基,置于37℃、50 mL CO2培养箱内培养。次日换液后每3 d换液1次,当爬出细胞达20%时,掀片继续培养,待细胞覆盖率达到80%后,用2.5 mL胰酶+0.2 g/L EDTA消化液消化,1∶2传代培养。取3~5代细胞用于实验。
1.5 PLGA、壳聚糖纳米粒的细胞毒性观察
1.5.1 PLGA、壳聚糖纳米粒悬液的制备
分别取γ射线灭菌后的PLGA、CS纳米粒及普通粒径的PLGA、CS粉末,用含100 mL/L FBS和1%青/链霉素的 DMEM 配制 0.5、1、2 mg/mL 的PLGA、CS纳米粒及1 mg/mL的PLGA、CS粉末完全培养基混悬液并置于4℃保存备用。
1.5.2 细胞毒性实验
取3~5代人牙周膜细胞,用2.5 g/L胰酶+0.2 g/L EDTA 消化后,以(1~5)×103/孔的细胞密度接种于96孔板。常规条件下培养24 h至细胞贴壁后,弃原培养液,并将细胞随机分为两大组(PLGA组、CS组);每一大组再各随机分为5个亚组(空白对照组、普通粉末对照组和3个实验组),每组设6个复孔。其中3个实验组分别加入浓度为0.5、1、2 mg/mL的PLGA或CS纳米粒完全培养基混悬液;普通粉末对照组加入浓度为1 mg/mL的PLGA或CS粉末全培混悬液;空白对照组仅加入含100 mL/L FBS和青霉素 KU/mL链霉素10 mg/mL的 DMEM完全培养基,置于 37℃、50 mL/L CO2培养箱内继续培养。分别于培养后1、2、3 d各时间点取各组细胞,每孔各加入 20 μL MTT溶液,继续孵育4 h,然后用多功能酶标仪测定各孔490 nm波长处的吸光度值(OD值),实验重复3次。所得结果按以下公式计算各组细胞的相对增殖率(relative growth rate,RGR):RGR(%)=实验组吸光度值/空白对照组吸光度值×100%。然后根据RGR,并按细胞毒性分级标准(表1),对各组的细胞毒性进行评价。
1.6 统计学分析
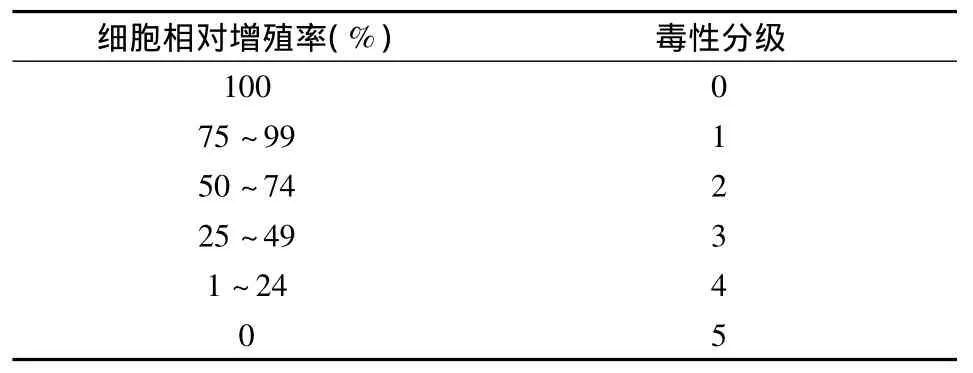
表1 细胞毒性评价标准
2 结果
2.1 PLGA、CS纳米粒的粒径及形态表征
2.1.1 纳米粒的粒径大小及分布
马尔文激光散射粒度仪检测结果显示:PLGA纳米粒的粒径为(188.10±2.86)nm,分散系数为0.55± 0.04(图 1a);CS 纳米粒的粒 径 为(250.97±30.86)nm,分散系数为 0.50 ± 0.07(图1b)。
2.1.2 纳米粒的形态表征
透射电镜观察显示:PLGA纳米粒呈球形,大小均匀,边缘清晰(图2a);CS纳米粒类似球形,大小较均匀,边缘清晰(图2b)。
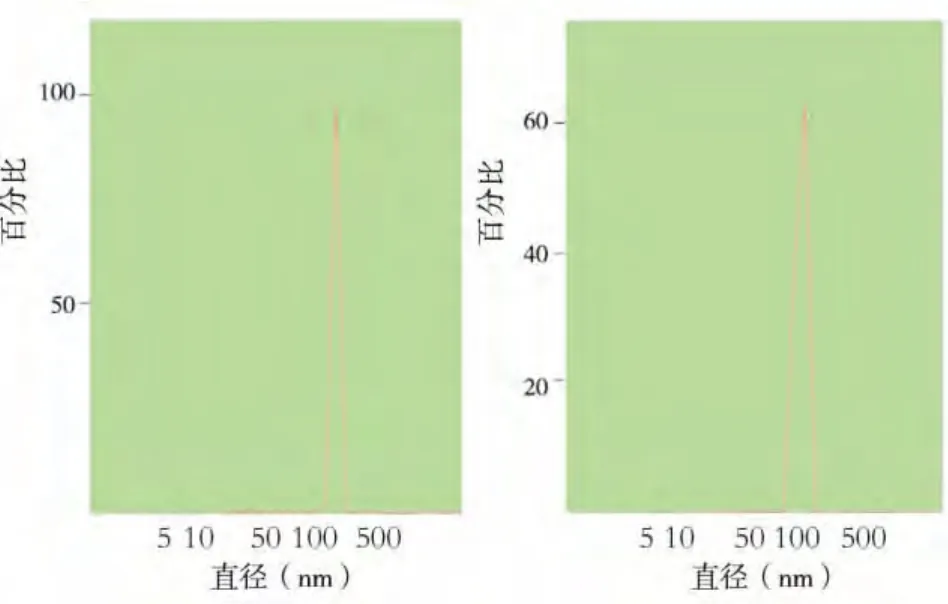
图1 PLGA、CS纳米粒粒径分布图

图2 PLGA、CS纳米粒透射电镜图
2.2 PLGA、CS纳米粒的细胞毒性
0.5、1、2 mg/mL PLGA、CS 纳米粒和 1 mg/mL PLGA、CS粉末与人牙周膜细胞共同培养24、48、72 h后,各组细胞的OD值和相对增殖率(RGR)如表2~3和图3所示;72 h内所有组细胞的相对增殖率均大于85%,其毒性分级均为0或1级;根据ISO10993-5可以认为所有组对牙周膜细胞均无毒性。随着培养时间的延长,PLGA纳米粒和CS纳米粒组牙周膜细胞的OD值也随之增加。图3a显示,48 h时PLGA粉末组和2 mg/mL PLGA纳米粒组的OD值低于空白组(P<0.05);其余各浓度组与空白对照组相比各浓度组间两两相比均无明显差异(P>0.05);24 h和72 h时,各浓度PLGA纳米粒组的OD值与空白对照组相比,以及各浓度组间两两相比均无统计学差异(P>0.05)。图3b显示,48 h时,1 mg/mL CS纳米粒组和粉末组的OD值均明显低于空白组(P<0.05),其余各浓度组与空白对照组相比,以及各浓度组间两两相比均无统计学差异(P>0.05);24 h和72 h时,各浓度CS纳米粒组的OD值与空白对照组相比,以及各浓度组间两两相比均无明显差异(P>0.05)。
表2 培养24、48、72 h后PLGA纳米粒组细胞的相对增殖率(%,)

表2 培养24、48、72 h后PLGA纳米粒组细胞的相对增殖率(%,)
*与空白对照组相比P<0.05
时间(h) 空白对照 普通PLGA粉 PLGA(mg/mL)0.5 1 2 24 100(0) 92.1 ±4.6(1) 95.7 ±6.6(1) 93.1 ±1.7(1) 98.4 ±3.9(1)48 100(0) 92.6 ±0.9(1)* 93.8 ±2.1(1) 99.7 ±1.8(1) 89.5 ±1.7(1)*72 100(0) 88.4 ±7.7(1) 99.2 ±3.4(1) 98.4 ±8.0(1) 109.2 ±2.9(0)
表3 培养24、48、72 h后CS纳米粒组的相对增殖率(%,)

表3 培养24、48、72 h后CS纳米粒组的相对增殖率(%,)
*与空白对照组相比P<0.05
时间(h) 空白对照 普通CS粉 CS(mg/mL)0.5 1 2 24 100(0) 92.4 ±8.0(1) 93.3 ±2.2(1) 88.8 ±5.9(1) 94.5 ±8.0(1)48 100(0) 97.2 ±5.3(1)*100.1 ±2.9(0) 96.7 ±2.2(1)*100.7 ±5.4(0)72 100(0) 85.6 ±5.6(1) 106.6 ±11.1(0) 94.0 ±6.2(1) 108.1 ±3.1(0)
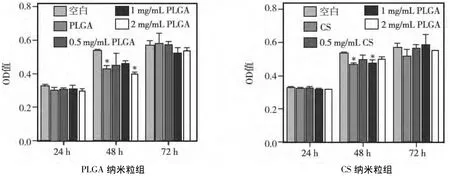
图3 PLGA、CS纳米粒对牙周膜细胞的毒性(*与空白对照组相比P<0.05)
3 讨论
PLGA已通过美国食品和药物管理局(Food and Drug Administration ,FDA)的认证[17-18],并广泛应用于医药、化工等各领域。但由于PLGA的表面呈疏水性,不利于细胞的粘附、生长和增殖。由于CS具有良好的细胞相容性、低毒性、降解性、亲水性、粘附性、低廉性等优点,已被广泛应用于多个领域,并成为广泛应用的的天然聚合物之一[7,9]。但是,CS的机械强度差、吸水易变形且降解相对较快,因此不适合单独应用于需要承载负荷或维持一定空间的地方。然而,PLGA和CS联用则可以改善降解速率,提高机械强度,以符合特定部位的生理需求。Nandagiri等[19]报道,在壳聚糖-明胶支架中加入PLGA纳米粒后,可显著降低支架对水的摄取,含16.6%(w/w)和 66.6%(w/w)PLGA 纳米粒支架的压缩模量分别比对照组提高了3倍和6倍。
本实验中PLGA纳米粒的制备采用的是乳化溶剂蒸发法,所用的溶剂为丙酮而不是国外普遍应用的二氯甲烷[20-22]。因为在前期实验中发现,虽然二氯甲烷的沸点为39.8℃,低于丙酮的沸点(56.48℃),用其作为溶剂制备PLGA纳米粒时虽可缩短时间。但制备出的PLGA不是纳米级,一般在几十到几百微米不等 。而改用丙酮作为溶剂后,则很容易得到PLGA纳米粒。本实验分别将不同浓度PLGA、CS纳米粒与人牙周膜细胞共同培养不同时间后,MTT检测显示48 h时,虽然部分组的细胞增殖率明显低于空白对照组,但在72 h时组间均无统计学差异,说明48 h时有差异的组在下一个24 h内恢复了较好的增殖能力;在24~72 h内,各组牙周膜细胞的相对增殖率均保持在85%以上,说明PLGA、CS纳米粒与普通PLGA、CS一样拥有良好的细胞相容性,对牙周膜细胞无毒性。另外,本课题组曾就壳聚糖纳米粒和普通壳聚糖对大肠杆菌的抑菌性进行了比较研究,结果显示:在浓度相同情况下壳聚糖纳米粒组的抑菌性明显高于普通组;当浓度为2 mg/mL时,纳米粒组的抑菌性已达到100%,而普通组则仅为70%左右。以上结果说明,壳聚糖纳米粒比普通壳聚糖具有更好的抑菌性。
牙周炎可以造成患者牙槽骨的吸收,而且不同患者牙槽骨吸收的形态不同,以前制造生物支架的技术都只能将支架制备成特定的形态而不能因人而异。作为生物支架,应该最大程度的模拟生物器官或组织的微观结构以实现个性化治疗。近几年兴起的3D打印则可通过对病损区的扫描,重建病损形态,从而实现了个体化修复设计。本实验初步研究了PLGA、CS纳米粒对牙周膜细胞的毒性,以期为后续PLGA、CS纳米复合膜或支架的研究及3D打印复合纳米支架的制备奠定基础。
[1]Jose MV,Thomas V,Johnson KT,et al.Aligned PLGA/HA nanofibrous nanocomposite scaffolds for bone tissue engineering[J].Acta Biomaterialia,2009,5(1):305-315.
[2]Danhier F,Ansorena E,Silva JM,et al.PLGA-based nanoparticles:an overview of biomedical applications[J].J Controlled Release,2012,161(2):505 -522.
[3]Park B,Zhou L,Jang KY,et al.Enhancement of tibial regeneration in a rat model by adipose-derived stromal cells in a PLGA scaffold[J].Bone,2012,51(3):313 -323.
[4]Lu H,Kawazoe N,Kitajima T,et al.Spatial immobilization of bone morphogenetic protein-4 in a collagen-PLGA hybrid scaffold for enhanced osteoinductivity[J].Biomater,2012,33(26):6140-6146.
[5]Coelho PG,Giro G,Kim W,et al.Evaluation of collagenbased membranes for guided bone regeneration,by three-dimensional computerized microtomography[J].Oral Surg Oral Med,Oral Pathol Oral Radiol,2012,114(4):437 -443.
[6]Mota J,Yu N,Caridade SG,et al.Chitosan/bioactive glass nanoparticle composite membranes for periodontal regeneration[J].Acta Biomater,2012,8(11):4173 -4180.
[7]Anitha A,Sowmya S,Sudheesh Kumar PT,et al.Chitin and Chitosan in Selected Biomedical Applications[J].Prog Polym Sci,2014.
[8]Bautista-Banos S,Hernández-López M,Bosquez-Molina E,et al.Effects of chitosan and plant extracts on growth of Colletotrichum gloeosporioides,anthracnose levels and quality of papaya fruit[J].Crop Prot,2003,22(9):1087 -1092.
[9]Arancibia R,Maturana C,Silva D,et al.Effects of chitosan particles in periodontal pathogens and gingival gingival fibroblasts[J].J Dent Res,2013,92:740 - 745.
[10]Chronopoulou L,Massimi M,Giardi MF,et al.Chitosan-coated PLGA nanoparticles:A sustained drug release strategy for cell cultures[J].Colloids Surf B,2013,103:310 -317.
[11]Yang Y,Tang G,Zhang,H,et al.Controlled release of BSA by microsphere-incorporated PLGA scaffolds under cyclic loading[J].Mater Sci Eng C,2011,31(2):350 -356.
[12]Li A D,Sun ZZ,Zhou M,et al.Electrospun Chitosan-graft-PLGA nanofibres with significantly enhanced hydrophilicity and improved mechanical property[J].Colloids Surf B,2013,102:674-681.
[13]Zhang LJ,Webster TJ.Nanotechnology and nanomaterials:Promises for improved tissue regeneration [J].Nano Today,2009,4(1):66-80.
[14]Ferreira AJ,Cemlyn-Jones J,Robalo Cordeiro C,et al.Nanoparticles,nanotechnology and pulmonary nanotoxicology[J].Rev Port Pneumol,2013,19(1):28 -37.
[15]Mo L,Hou L,Guo D,et al.Preparation and characterization of teniposide PLGA nanoparticles and their uptake in human glioblastoma U87MG cells[J].Int J Pharm,2012,436(1):815 -824.
[16]Guan J,Cheng P,Huang SJ,et al.Optimized Preparation of Levofloxacin-loaded Chitosan Nanoparticles by Ionotropic Gelation[J].Physics Procedia,2011,22:163 -169.
[17]Ji W,Yang F,Seyednejad H,et al.Biocompatibility and degradation characteristics of PLGA-based electrospun nanofibrous scaffolds with nanoapatite incorporation[J]. B iomaterials,2012,33(28):6604-6614.
[18]Atala A,Tissue engineering of human bladder[J].Br Med Bull,2011,97(1):81 -104.
[19]Nandagiri VK,Gentile P,Chiono V,et al.Incorporation of PLGA nanoparticles into porous chitosan-gelatin scaffolds:influence on the physical properties and cell behavior[J].J Mech Behav Biomed Mater,2011,4(7):1318 -1327.
[20]Yvonne K,Dipl-Food C,Christian K,et al.Preparation and biological evaluation of multifunctional PLGA-nanoparticles designed for photoacoustic imaging[J].Nanomed Nanotechnol Biol Med,2011,7:228-237.
[21]Klose D,Siepmann F,Elkharraz K,et al.PLGA-based drug delivery systems:Importance of the type of drug and device geometry[J].Int J Pharm,2008,354:95 -103.
[22]Van de Vena H,Vermeerschb M,Matheeussenb A,et al.PLGA nanoparticles loaded with the antileishmanial saponinβ-aescin:Factor influence study and in vitro efficacy evaluation[J].Int J Pharm,2011,420:122- 132.
- 牙体牙髓牙周病学杂志的其它文章
- 牙龈卟啉单胞菌牙龈素研究进展

