消痹方对兔膝骨性关节炎软骨下骨Cyclin D1 mRNA的影响
林乔龄李 民* 陈 志
(1 福建中医药大学附属漳州市中医院,福建 漳州 363000;2 福建中医药大学附属康复医院,福建 福州 350003)
消痹方对兔膝骨性关节炎软骨下骨Cyclin D1 mRNA的影响
林乔龄1李 民2* 陈 志1
(1 福建中医药大学附属漳州市中医院,福建 漳州 363000;2 福建中医药大学附属康复医院,福建 福州 350003)
目的探讨消痹方对兔膝骨性关节炎软骨下骨Cyclin D1 mRNA的影响。方法将新西兰大白兔分为试验组和对照组,术后1周开始分组灌胃治疗。采用X线摄片、光镜对软骨下骨进行组织形态学观察,RT-PCR法检测软骨下骨Cyclin D1的表达。结果试验组软骨下骨退变表现、骨质增生和软骨下骨结构紊乱现象明显较对照组轻,试验组骨转换指标Cyclin D1 mRNA表达量较低(P<0.05)。结论消痹方通过下调Cyclin D1 mRNA的表达,降低软骨下骨重塑速率。
消痹方;骨性关节炎;Cyclin D1 mRNA
1 材料与方法
1.1 材料
1.1.1 试验药物:消痹方由巴戟天、紫河车、杭白芍、青风藤、两面针、白术组成,系根据福建省名老中医章宝春临症经验整理,现为漳州市中医院协定方。
1.1.2 动物:健康6个月龄新西兰大白兔64只,体质量(2000±100)g,雌雄各半。
1.1.3 主要试剂:反转录试剂盒、TRIZOL;PCR引物;CycleTESTTM Plus DNA Reagent Kit;FITC-conjugated Cyclin D1 Antibody Reagent set。
1.1.4 主要仪器:全自动石蜡切片机,万能研究显微镜,紫外分光光度计,超纯水装置,CR系统,基因扩增仪,蛋白核酸分析仪,离心机,低温冰箱,摊片烤片机,生物组织自动脱水机,,生物组织包埋机,电热恒温鼓风干燥箱,紫外透射分析仪,凝胶成像系统,三恒多用电泳仪。
1.2 方法
1.2.1 试验前动物处理:①分组及造模:健康6个月龄新西兰大白兔64只,随机分为试验组和对照组,每组各32只。两组均行常规术前准备,根据改良Hulth法造模[1]:取兔膝关节内侧入路,切断内侧副韧带,摘除内侧半月板,切断前交叉韧带。术后连续3 d肌内注射青霉素20万单位,每日2次。②动物喂养:采用一笼一兔喂养,饲养期间观察其毛色、食欲、活动和体质量变化,术后1周开始每天驱赶2次,每次30 min。③给药:按体表面积换算与人的给药剂量[2]:新西兰兔(2.0 kg)=成人(60 kg)每日药量×0.07×2/3×2.0=1.12 g。试验组给予消痹方水溶液10 mL/d(含消痹方1.12g)灌胃,每日1次;对照组给予生理盐水10 mL/d灌胃,每日1次。④取材:两组动物均于术后1、6、9、12周分批处死取材,每批每组各随机抽取8只动物。
1.2.2 观察指标及检测方法
1.2.2.1 X线片:摄兔双膝正侧位CR片,观察两侧膝关节骨结构,包括周围软组织、关节间隙、关节面的变化及有无骨赘形成。
1.2.2.2 光镜制样与观察步骤:①取材:胫骨内侧髁中央的软骨连同软骨下骨,修成1 cm×1 cm×1 cm大小组织块。②固定:10%福尔马林溶液固定7 d。③冲洗:流水冲洗24 h。④脱钙:10%EDTA二钠盐,溶于0.1 mol/L磷酸缓冲液,以氢氧化钠调至pH 7.0,脱钙14 d。⑤冲洗:流水冲洗24 h。⑥脱水:70%酒精2 h→85%酒精2 h→90%酒精2 h→95%酒精2 h→100%酒精2 h。⑦透明:二甲苯浸泡30 min。⑧浸蜡、包埋:室温25 ℃,石蜡58 ℃,浸蜡4 h中间换2次,常规石蜡包埋。⑨切片、染色:轮转式切片机切5~6 μm的薄片→二甲苯15 min→二甲苯25 min→100%酒精3 min→95%酒精3 min→90%酒精3 min→85%酒精3 min→70%酒精3 min→蒸馏水浸洗2 min→苏木素5 min→自来水洗去浮色→1%盐酸酒精分色→自来水反蓝20 min→70%酒精3 min→85%酒精3 min→二甲苯15 min→二甲苯23 min→中性树胶封片。⑩光镜下观察:关节软骨各层细胞的形态结构和数量变化、是否有群集,软骨有无裂隙,细胞有无凋亡,软骨下有无假性囊肿形成、骨质增生、骨小梁骨折及软骨下骨密度。
1.2.2.3 RT-PCR法检测软骨下骨相关指标:①总核糖核酸(RNA)的提取:总RNA的提取严格依照TRIzol试剂操作说明进行。取适量RNAlaterTM试剂保存的兔骨或软骨组织,置入匀浆器中充分研磨,加入1 mL TRIzol再混合均匀并转移至1.5 mL Ep管中,室温静置5 min;每管加氯仿200 μL,激烈混匀后静置分层,在4 ℃ 12000 rpm的条件下离心15 min,转移上清至一新1.5 mL Ep管;加500 μL异丙醇室温沉淀10 min,在4 ℃ 12000 rpm的条件下离心10 min;用75%乙醇(DEPC水配制)洗沉淀1次,然后风干,溶于适量无RNA酶水中;每一RNA样品取适量紫外分光光度计定量,其余-80 ℃保存待用。②反转录反应:吸光光度仪测定RNA的吸光度值(OD值),用于检测RNA纯度及其浓度。取80 μL DEPC水调零吸光光度仪,取1 μL待测RNA用DEPC水100倍稀释,吸取80 μL稀释后的RNA,测定260 nm和280 nm的OD值。当260 nm OD值与280 nm OD值的比值在1.8~2.0,说明提取的RNA纯度高。RNA的浓度=260 nm OD值×40 μg/mL×稀释倍数,计算出RNA的浓度。20 μL体系反转录过程:RNA 1 μg(根据浓度计算出体积),加0.05 μg/μL Oligo(dT)18 primer 1 μL,再加DEPC水至12 μL,混匀,70 ℃的条件下离心5 min,立即冰水浴,离心。在冰上依次加入5×reaction buffer 4 μL、RibolockTM Ribonuclease Inhibitor 1 μL、10mM dNTP mix 2 μL,混匀,37 ℃条件下离心5 min之后加入RevertaidTM M-MuLV Reverse Transcriptase 1 μL。在42 ℃的条件下静置60 min,再在72 ℃的条件下静置10 min(破坏MLV),最后在4 ℃冰水浴的状态下保存备用。③c-fos扩增引物合成:c-fos引物:产物长度241bp;上游:5'-CGATTCGCCTACTTCC-3';下游:5'-TCCGCTCCACTTCATT-3'。引物使用前用DEPC水溶解成10 pmol/μL浓度的引物溶液。PCR反应(20 μL体系):Taq Buffer 10(1.5 μL),dNTP(10 mM,0.2 μL),上游引物(10 pmol/μL,0.3 μL),下游引物(10 pmol/μL,0.3 μL),cDNA模板(1 μL),Taq酶(5 U/μL,0.2 μL),DEPC水(16.5 μL)→混匀,离心→95 ℃ 5 min,预变性→94 ℃ 30sec变性,80 ℃40sec退火,72 ℃30sec延伸,35循环→72 ℃ 7 min,终末延伸→4 ℃保温。
PCR产物加入溴芬兰进行琼脂糖凝胶电泳,电流10 mA,电压100 V,电泳时间60 min,电泳结果通过凝胶图像分析系统对条带进行PCR定量;样本c-fos mRNA等产物的PCR定量与内参β-actin的PCR定量比值,为该样本mRNA在组织中的相对含量。
1.3 统计学处理:运用SPSS 18.0软件包处理分析,参数值用均值±标准差表示,组间数据比较采用ONE-WAY ANOVA(单向方差分析)。
2 结 果
2.1 组织形态学观察
2.1.1 造模12周X线片观察结果。试验组:内侧间隙狭窄不明显,关节面粗糙变形,关节边缘有轻微骨赘形成,软骨下骨密度稍增高(图1、2)。对照组:内侧间隙变窄,关节面粗糙变形,关节边缘有明显骨赘,胫骨内侧关节面外侧稍塌陷,软骨下骨骨密度不均匀,硬化与疏松并见(图3、4)。

图2 试验组:侧位片
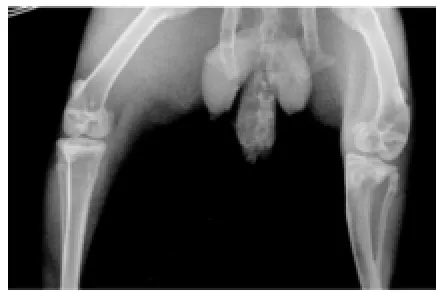
图3 对照组:正位片
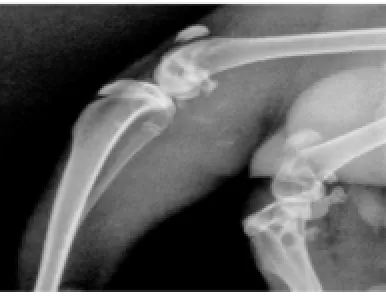
图4 对照组:侧位片
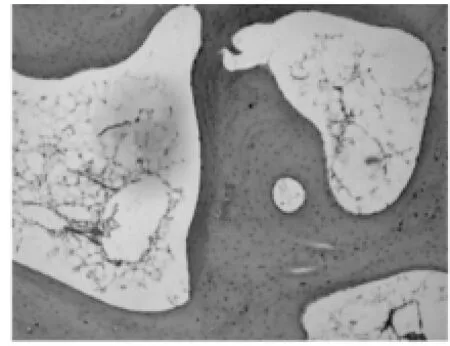
图5 试验组:术后6周骨小梁(HE×100)
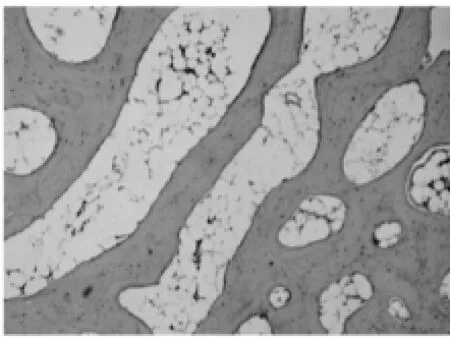
图6 试验组:术后9周骨小梁(HE×100)
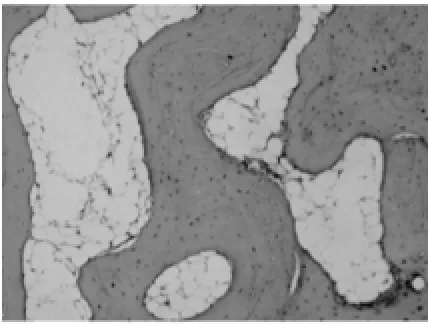
图7 试验组:术后12周骨小梁(HE×100)
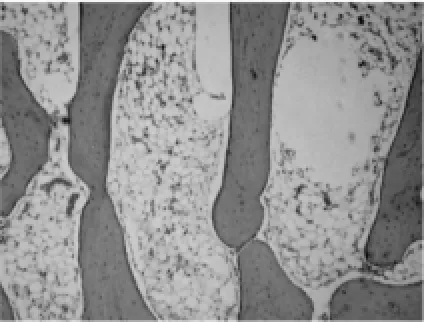
图8 对照组:术后6周骨小梁(HE×100)

图9 对照组:术后9周骨小梁(HE×100)
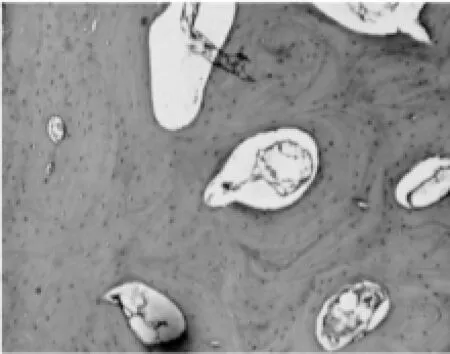
图10 对照组:术后12周骨小梁(HE×100)
2.1.2 软骨下骨光镜观察结果。试验组:造模后6周软骨下轻度骨骨质疏松,偶见骨小梁骨折(图5);造模后9周,软骨下骨骨质疏松与骨修复并见,骨结构轻度紊乱,偶见横向骨小梁(图6);造模后12周,软骨下骨出现局部骨质轻度硬化,骨结构稍紊乱,少量骨赘形成(图7)。对照组:造模后6周软骨下骨骨质疏松严重,可见较多骨小梁骨折(图8);造模后9周,软骨下骨骨质疏松与骨修复并见,骨结构紊乱明显,可见大量横向骨小梁(图9);造模后12周,软骨下骨骨质局部硬化明显,骨结构紊乱加重,骨赘形成多(图10)。
2.2 软骨下骨Cyclin D1 mRNA的表达:RT-PCR检测Cyclin D1 mRNA表达结果显示见图11、表1。

表1 Cyclin D1 mRNA电泳条带灰度值比较(INT/mm2)
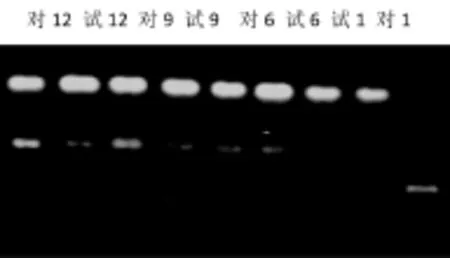
图11 Cyclin D1 mRNA电泳图
2.2.1 各组组内不同时期比较:对照组造模后1、6、9周,随着时间的推移Cyclin D1 mRNA表达不断增强,它们之间均有显著性差异(P<0.05);9周和12周时比较,Cyclin D1 mRNA表达无显著性差异。试验组6、9、12周时相较1周时表达增高,均有显著性差异(P<0.05)。2.2.2 各组组间比较:试验组造模后6、9和12周Cyclin D1 mRNA表达相较对照组较低,组间有显著性差异(P<0.05)。
3 讨 论
软骨下骨重塑就是在破骨细胞和成骨细胞的作用下,经历旧骨不断被吸收,新骨又不断形成的过程。骨细胞的增殖速率越高,则软骨下骨重塑越快,Cyclin D1是反应软骨下骨重塑速率的重要指标。消痹方干预后软骨下骨Cyclin D1 mRNA的表达量较低,显著低于对照组,表明消痹方通过下调Cyclin D1 mRNA的表达以抑制软骨下骨的重塑速率,并能有效降低软骨下骨的高转化率,在早期减少软骨下骨骨吸收,中后期抑制软骨下骨骨形成,从而减轻关节软骨退变,延缓骨性关节炎的病理进程。
[1] 刘献祥,李西海,周江涛.改良Hulth造模法复制膝骨性关节炎的实验研究.[J].中国中西医结合杂志,2005,25(12):1104-1108.
[2] 苗明三.实验动物和动物实验技术[M].北京:中国中医药出版社, 1997:143.
R684.3
B
1671-8194(2014)34-0059-03
福建省自然科学基金资助项目(编号2012J01433);国家临床重点专科建设项目资助;国家中医药管理局“十二五”重点专科建设项目资助
*通讯作者

