N-马来酰化壳聚糖及其配合物的合成与表征
容学德
(广西民族大学预科教育学院,广西 南宁 530008)
壳聚糖是自然界中大量存在的碱性多糖,是甲壳素的脱乙酰产物[1],具有生物相溶性、生物可降解性、吸附性和无毒性等良好性质,是一种应用前景极为广阔的高分子化合物[2]。目前,关于壳聚糖的研究有很多,但有关壳聚糖衍生物的研究还远远少于对壳聚糖的研究,由于经过修饰过的壳聚糖表现出良好的水溶性、生物活性和脂溶性,在水处理、医药、农业、食品、化妆品等领域显示出独特的应用价值[3-4],因此有关壳聚糖衍生物的研究正日益受到人们的重视[5-6]。在壳聚糖分子中的氨基和羟基上导入不同分子量的脂肪族或芳香族酰基,通过发生壳聚糖的酰化反应,可得到壳聚糖的酰化衍生物。
对于壳聚糖的酰化研究,科研人员青睐于用马来酸酐与壳聚糖的酰化反应合成壳聚糖酰化衍生物。有报道以N,N-二甲基甲酰胺[7-9]、氯化-1-乙酸基-3-甲基咪唑离子液体[10]、氯化2-氨基乙酸离子液体水溶液[11]为反应介质,马来酸酐与壳聚糖反应制得水溶性N-马来酰化壳聚糖,但制备条件较为苛刻,要在高温和非均相条件下进行。另有报道将马来酸酐与壳聚糖在室温条件下发生均相反应,制得水溶性N-马来酰化壳聚糖,但是用乙酸和吡啶为反应介质[12],由于吡啶具有浓烈的气味和一定的毒性,因此极易造成实验环境的污染。还有报道在室温条件下以碳酸钠为催化剂,马来酸酐与壳聚糖反应合成水溶性的马来酰化壳聚糖,但需要将反应液透析1周时间[13],其制备时间太长。本文拟通过较为温和的方法制取N-马来酰化壳聚糖,其主要过程为:让壳聚糖在碱性条件下进行脱晶,以N,N-二甲基甲酰胺和无水乙醇为介质,与一定量的马来酸酐在室温、均相条件下反应18 h。
壳聚糖的酰化衍生物的合成研究虽已取得了不少的研究成果,但有关壳聚糖的衍生物与金属的配位这方面的报道仍较少[4,6],而在众多的金属离子中,由于铜、锌元素是人体所需的微量元素,在人体生命活动当中不可或缺。为此,作者在成功合成N-马来酰化壳聚糖的基础上,对N-马来酰化壳聚糖与Cu(Ⅱ)、Zn(Ⅱ)离子能否进行配位以及哪些基团参与了配位等问题作了进一步的实验研究,并通过红外光谱(FTIR)及电子顺磁共振光谱(EPR)对配合物的结构进行表征,为N-马来酰化壳聚糖配合物的制备提供了技术基础和参考。
1 实验部分
1.1 药品试剂
壳聚糖,购自国药集团上海有限公司,脱乙酰度在95%以上。N,N-二甲基甲酰胺(DMF),马来酸酐,冰乙酸(CH3COOH),氯化锌(ZnCl2·2H2O),氯化铜(CuCl2·2H2O)及其他常规试剂均为分析纯。实验用水为去离子水。
1.2 仪器
红外光谱仪:美国PE Spectrum One FI-IR Spectrometer傅里叶变换红外光谱仪;溴化钾压片。电子顺磁共振光谱仪为德国Bruker公司EMX型光谱仪。
1.3 壳聚糖(CT)脱晶
称取壳聚糖5.0 g,在室温下加入到250 mL稀乙酸水溶液中,搅拌使壳聚糖溶解,然后向溶液中滴加270 mL含有乙醇的稀氢氧化钾水溶液,即析出脱结晶度的壳聚糖。析出物分别经蒸馏水、无水乙醇洗涤。
1.4 N-马来酰化壳聚糖(CMT)的合成
室温下,将所得的脱晶壳聚糖将其加入到30 mL N,N-二甲基甲酰胺和30 mL无水乙醇中,搅拌使脱晶壳聚糖溶解,按n(马来酰酐)∶ n(壳聚糖单体)=1∶1的摩尔比加入计量的马来酸酐,置于磁力搅拌器上搅拌,搅拌7 min后马来酸酐溶解,搅拌18 h后混合液由白色变为浅黄色,过滤得到的胶状产物用无水乙醇洗涤5次,真空抽干,待用。称取1.0 g N-马来酸酐酰化壳聚糖,加入到0.1 mol/L的氢氧化钠溶液中,用0.05 mol/L的盐酸滴定,作盐酸的体积与pH值的关系图,然后由图中关系计算马来酰化壳聚糖的取代度(DS)[4]。经过计算可知本实验所制得的马来酰化壳聚糖的取代度DS=63%。
1.5 N-马来酰化壳聚糖铜配合物(CTMCu)的合成
称取从1.4节中得到的N-马来酰化壳聚糖0.5 g,室温下加入到10 mL 0.1 mol/L氯化铜(CuCl2)溶液中,放于磁力搅拌器上搅拌6 h,所得到的浅蓝色沉淀进行抽滤,用无水乙醇(C2H5OH)洗涤再真空抽干。
1.6 N-马来酰化壳聚糖锌配合物(CTMZn)的合成
室温下,称取从1.4节中实验得到的N-马来酰化壳聚糖0.5 g,加入到10 mL 0.1 mol/L氯化锌(ZnCl2)溶液中,放于磁力搅拌器上搅拌6 h,将所得到的浅黄色沉淀进行抽滤,用无水乙醇(C2H5OH)洗涤再真空抽干。
2 结果与讨论
2.1 红外光谱
图1为脱晶壳聚糖(CT)的红外光谱图。在3432 cm−1处有一强而宽的峰,是壳聚糖的O—H和N—H的伸缩振动所形成的峰,由于有分子内和分子间氢,峰变得十分宽大。在1596 cm−1为N—H弯曲振动形成的峰。1155 cm−1,1033 cm−1,1092 cm−1处为C—O,C—N伸缩振动形成的峰。896 cm−1处为壳聚糖分子中的糖环的面外振动形成的峰。当壳聚糖的氨基链接上马来酰基团形成N-马来酰化壳聚糖(CTM)后,其898 cm−1处的糖环面外弯曲振动峰没有改变,如图2所示。这说明壳聚糖分子在与马来酸酐酰化反应时壳聚糖分子没有解体,马来酸酐接到壳聚糖分子的氨基上。

图1 脱晶壳聚糖(CT)红外光谱图
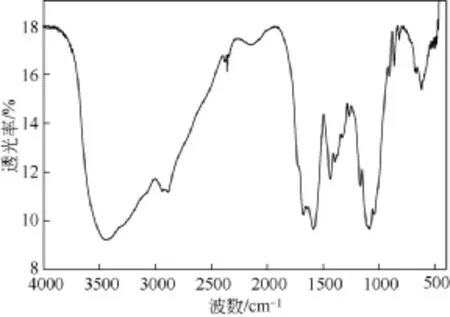
图2 N-马来酰化壳聚糖(CTM)红外光谱图
然而,N-马来酰化壳聚糖(CTM)在1664 cm−1,1572 cm−1有最强峰,明显为羧基上羰基的伸缩振动峰。它的强度超过了在1033 cm−1附近的C—O,C—N伸缩振动峰,这说明了羧基和羰基的存在[14]。同时在853 cm−1,809 cm−1处有两个较弱而尖锐的峰,这是羧基的特征吸收峰[15]。壳聚糖分子中没有羰基存在,在脱晶壳聚糖(CT)的红外光谱图中没有发现这两峰。这就有力地证实了壳聚糖衍生物中马来酸根的存在。1636 cm−1处一个小的峰为N—H弯曲振动,与脱晶壳聚糖(CT)的红外光谱图相比而言向高频移动了[16]。
当N-马来酰化壳聚糖(CTM)与二价铜离子形成CTMCu配合物后,其FT-IR光谱如图3所示。CTMCu配合物在3402.5 cm−1处的N—H和O—H的伸缩振动重叠而成的吸收峰相对于N-马来酰化壳聚糖(CTM)中的相应峰而言,向低频方向移动了29 cm−1,说明氨基上的氮原子或是羟基上的氧原子参加与金属铜离子的配位。1621 cm−1、1568 cm−1处是羧基伸缩振动峰,峰相对减弱且峰形展宽,峰分别向低频移动了43 cm−1和4 cm−1[15]。峰强度减弱并向低频移动说明了羧基参与了配位。
当N-马来酰化壳聚糖(CTM)与二价锌离子形成CTMZn配合物后,其FT-IR光谱如图4所示。通过分析FT-IR光谱图可知,位于3421 cm−1处的N—H和O—H的伸缩振动重叠而成的吸收峰相对于N-马来酰化壳聚糖(CTM)中相应的峰而言,向低频方向移动了10 cm−1,这说明氨基上的氮原子或是羟基上的氧原子很有可能参加与金属锌离子的配位反应。在1631 cm−1,1567cm−1处是羧基伸缩振动峰,峰相对减弱且峰形展宽,由图4可知峰分别向低频移动了 33 cm−1和 6 cm−1。
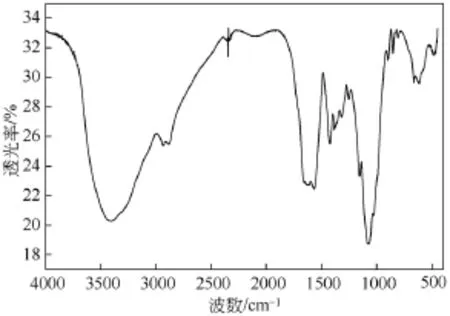
图3 配合物(CTMCu)红外光谱图
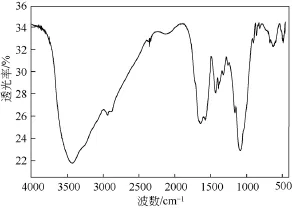
图4 配合物(CTMZn)红外光谱图
2.2 电子顺磁共振
电子顺磁共振广泛应用在含铜离子的配位化合物结构表征中。图5为CTMCu配合物的电子顺磁共振光谱。从图中可见CTMCu配合物显示出单核铜的特征峰,在g=2.17有一个强烈的宽峰。因此N-马来酰化壳聚糖(CTM)与Cu(Ⅱ)离子紧密结合,形成了配合物。
3 结论
在室温条件下,以N,N-二甲基甲酰胺和无水乙醇为介质,将碱性条件下脱晶的壳聚糖与马来酸酐以1∶1的物质的量比进行酰化反应,制得取代度DS=63%的马来酰化壳聚糖;由红外光谱测试的结果表明了马来酸酐成功接到壳聚糖分子的氨基上;该制备N-马来酰化壳聚糖的实验方法其反应条件温和、可操作性强,且具有安全性、清洁性的特点。通过合成的N-马来酰化壳聚糖分别与Cu(Ⅱ)、Zn(Ⅱ)离子反应,制得了N-马来酰化壳聚糖与铜、锌离子的配合物;利用红外光谱及电子顺磁共振光谱对配合物的结构进行表征,结果表明,在温和条件下N-马来酰化壳聚糖能分别与铜、锌离子进行配位反应,且是N-马来酰化壳聚糖的氨基和羧基共同参与配位,形成了N-马来酰化壳聚糖铜配合物和N-马来酰化壳聚糖锌配合物。

图5 CTMCu的常温电子顺磁共振光谱
[1]郎雪梅,侯有军,赵建青.壳聚糖作为分离膜材料的研究进展[J].化工进展,2005,24(7):737-741.
[2]Kumar M N V R,Muzzarelli R AA,Muzzarelli C,et al.Chitosan C-emistry and pharmaceutical perspectiues[J].Chemical Reviews,2004,104(12):6017-6035.
[3]Harish Prashanth K V,Tharanathan R N.Chitin/chitosan:Modification and their unlimited application potential-an overview[J].Trends in Food Science&Technology,2007,18(3):117-131.
[4]张苏敏,魏永峰,郎惠云.壳聚糖银(Ⅰ)配合物的合成及吸附动力学[J].化学通报,2005,68(4):296-300.
[5]Ferreira Felicio S G,Sierakowski M R,Lucia de Oliveira Petkowicz C.Spherical aggregates obtained from N-carboxymethylation and acetylation of chitosan[J].Colloid Polym.Sci.,2008,286(12):1387-1394.
[6]Varma A J,Deshpande S V,Kennedy J F.Metal complexation by chit-osan and its terwatives:A review[J].Carbohydrate Polymers,2004,55(1):77-89.
[7]孙新枝,杨声,张凯峰,等.马来酸酐酰化壳聚糖的合成[J].化学研究与应用,2005,17(2):243-244.
[8]王惠武,董炎明,赵雅青,等.N-马来酰化壳聚糖的结晶形态[J].厦门大学学报:自然科学版,2004,43(6):824-827.
[9]舒红英,戴玉华,丁教,等.马来酸酐接枝壳聚糖的微波法合成及其吸附性能[J].南昌航空大学学报:自然科学版,2008,22(1):63-66.
[10]张惠欣,葛丽环,尹静,等.马来酰化壳聚糖的合成与阻垢性能研究[J].化学研究与应用,2011,23(12):1595-1598.
[11]纪欢欢,梁升,李露,等.在氨基酸离子液体中均相合成马来酰化壳聚糖[J].精细化工,2009,29(4):391-394.
[12]应国清,杨好,李东华,等.N-马来酰化壳聚糖的合成和性能[J].化工进展,2007,26(3):405-408.
[13]李永振,彭政,罗勇悦,等.水溶性马来酰化壳聚糖的制备及其pH响应研究[J].化学推进剂与高分子材料,2011,9(2):70-72.
[14]张肇熙.高聚物结构分析[M].北京:化学工业出版社,1990.
[15]Nakamoto K.Infrared and raman spectra ofinorganic and coordination compounds[M].New York:John Wiley and Sons,1978.
[16]王爱勤,赵培庆,高小军,等.壳聚糖与不同金属锌盐配位的红外光谱研究[J].光谱学与光谱分析,1999,19(6):817-820.

