水热合成焦绿石型氧化钨反应机理的研究
张勤俭
(中南大学冶金与环境学院,湖南长沙 410083)
水热合成焦绿石型氧化钨反应机理的研究
张勤俭
(中南大学冶金与环境学院,湖南长沙 410083)
以纯钨酸钠溶液为反应物,盐酸为添加剂,在碱性环境下水热合成焦绿石型氧化钨。利用FT-IR测试方法分析了不同酸化度下和反应不同时间段的Na2WO4溶液的红外光谱变化规律,逐一分析和是否为制备焦绿石型氧化钨反应的前躯体,利用排除法排除了作为反应前躯体的可能性,认为该前躯体应为和,并通过热力学计算结果辅助证明。
焦绿石型氧化钨;水热合成;反应机理
焦绿石型氧化钨(常记为H2W2O7或WO3·-0.5H2O)以扭曲的WO6八面体为结构基元,通过WO6刚性骨架的角顶构筑形成具有六元环孔道的层状结构,在层与层之间形成[111]方向的三维通道[1]。其具有n型半导体特性和微波吸收特性,作为新兴的工业材料,它在光致变色、电致变色、气致变色、催化等方面都有着很重要的研究意义[2]。此外,焦绿石型氧化钨经过焙烧后能直接转变为三氧化钨,可作为制备三氧化钨的中间产物。
目前制备焦绿石型氧化钨主要采用软化学合成法和水热合成法。水热合成法在无机材料合成领域应用广泛,其优点是水热条件易于调控,所得产品纯度高、分散性好、粒度易控制。目前水热法制备焦绿石型氧化钨通常是以钨酸钠溶液为原料,酸化后水热反应一定时间制得。根据不同科研工作者的研究结果,钨酸钠溶液pH值在2.0~8.9的范围内均能水热合成焦绿石型氧化钨[1,3],但其合成机理尚不明确,无直接证据确定该反应前驱体,研究有待进一步深入。酸性环境下存在多种钨同多酸根离子及杂多酸离子,结构多变且转化情况复杂,因此本文着重讨论碱性体系中焦绿石型氧化钨水热合成机理。
1 实 验
1.1 实验原料
实验所用钨酸钠溶液由分析纯Na2WO4·2H2O和去离子水配制而成,浓度为100 g/L(以WO3计)。其余实验试剂和分析试剂均为分析纯。
1.2 实验方法
水热反应在以甘油为加热介质的DY-8低压群釜(中南大学机械厂产)中进行,控温精度为±1℃。移取100 mL 100 g/L的钨酸钠溶液,利用盐酸调节溶液pH值,在实验设定温度下反应一定时间。为了强化搅拌强度,反应钢弹中均加入2个Φ15 mm和10个Φ6 mm的钢球。反应结束后,采用ET6700红外光谱仪(美国NICOL公司)测试溶液的红外光谱,再将悬浊液进行抽滤,所得滤饼用去离子水洗涤三次。滤液经稀释定容后,通过752型紫外可见分光光度计(上海光谱仪器有限公司)和硫氰酸钾-三氯化钛比色法分析三氧化钨的浓度并计算反应率。定义钨酸钠溶液反应率为反应前后溶液中WO3含量的差值与反应前溶液中WO3含量的比值。
2 实验结果与讨论
2.1 FT-IR检测与分析
钨酸钠溶液酸化过程中,钨酸根离子的存在形态有很大差异,并且变化复杂。莫似浩[4]、Reis[5]、陈启元[6]、Thierry Barré[7]等人的研究结果表明,钨酸钠溶液酸化度<1.25时,溶液中除外,还存在和三种同多酸根离子。本文实验pH值范围介于7.0至10.5之间,换算为酸化度小于1.25,所以下文将对这四种离子进行逐一分析。
利用盐酸调节钨酸钠溶液pH值,测定不同酸化度条件下的Na2WO4溶液对应的红外光谱图,结果如图1所示。由图可知,随着pH值的降低,红外光谱的特征峰位置会发生变化。pH值在7.61~8.05区间时,只能检测到830 cm-1左右的特征峰,而830 cm-1处的吸收峰可归属为WO4四面体的伸缩振动峰,WO4简单四面体结构是的结构基元[8];当pH降到7.61时可以发现,920 cm-1附近出现了一个新特征峰,但当pH值继续降低到7.3左右时该峰消失,且峰强度很弱,此峰对应的离子应为短暂存在的热力学不稳定离子,作为前驱体可能性不大;随着pH的进一步降低,到7.38附近时830 cm-1处的峰逐渐减弱至不明显,开始出现880 cm-1和945 cm-1左右的峰,且880 cm-1处的峰较强;当pH值降至酸性环境6.08时,830 cm-1峰完全消失,说明酸性环境中不复存在,而880 cm-1和945 cm-1处的峰依然存在,并且945 cm-1附近的峰逐渐增强,但最强峰仍在880 cm-1附近。880 cm-1、920 cm-1和945cm-1处的特征峰均可归属为WO6八面体的伸缩振动峰[9]。随着酸化度的增大,四面体离子会聚合成八面体钨同多酸根离子。Thierry Barré等人通过研究分析制备出了,其制备过程反应方程式见式(1)[7];Maksimovskaya和刘士军等人的研究认为酸化钨酸钠溶液生成的方程式为式(2)[10];Arnek和Cruywagen等人在研究

图1 不同pH值下Na2WO4溶液的FT-IR测试曲线


钨酸钠溶液的初始pH值和反应时间都会影响最终反应率。钨酸钠溶液初始pH值越接近于7,反应时间越长,反应率则越高。表1显示了反应时间对反应率的影响。

表1 反应时间对反应率的影响
由表1可知,随着反应的进行,溶液的pH值逐渐增大,当pH值大于7.74后,反应率的增长幅度迅速减小,但仍在缓慢增长。这说明在7.74至8.06这段pH区间中仍然可以获得焦绿石型氧化钨产品。图2是上述反应对应的红外光谱图。

图2 Na2WO4溶液在不同反应时间段的FT-IR测试曲线
从图2可以看出,反应进行3 h后,溶液中的最强红外特征峰接近880 cm-1,同时还有不太明显的830 cm-1和920 cm-1左右的峰。随着反应的进行,pH值逐渐增大,到6 h时先前出现的880 cm-1和920 cm-1附近两个峰已经减弱到几乎不能察觉,同时830 cm-1附近的特征峰逐渐增强并成为最强峰,此时的pH值为7.74,这与图1中钨酸钠溶液酸化测试的红外光谱结果相符合。其后直到反应结束,830 cm-1峰仍然最强,其它两峰基本消失。结合表1可知,反应进行到6~12 h这段时间内,几乎仅有存在,但反应率依然有所增加,说明此时反应依然可以继续进行,即是该水热反应的前驱体。表2显示了初始pH值对反应率的影响。

表2 初始pH值对反应率的影响
表2结果说明,同等反应条件下,初始pH值为7.11时的反应率比初始pH为7.62时的反应率高了20个百分点。仅因H+浓度的差别无法造成这么大的反应率差异。后者水热体系中含钨离子以为主,而前者体系中与均有可能存在,因此不应是反应的唯一前驱体。

表3 Na10H2W12O42·27H2O在水中的溶解度
表3显示Na10H2W12O42·27H2O常温下在水中的溶解度较小,随着温度升高溶解度迅速升高,但101.8℃下仍有接近1/3的仲钨酸钠未溶[15]。而在100℃条件下水热反应得到的产品经XRD分析仅有焦绿石型氧化钨的衍射峰,并无仲钨酸钠的衍射峰。因此该反应所在的水热环境中并无存在或含量极低,作为水热合成焦绿石型氧化钨前驱体的可能性不大。
从图2中,可以看到在3~6 h的反应过程是反应率增长最快的阶段,此阶段溶液中最强的红外特征峰为880 cm-1,并且该峰强度随反应的进行急剧减弱,说明该峰对应的离子消耗速度很快。6~12 h的反应过程中反应率增长较为缓慢,此时溶液中只能检测到830 cm-1处的红外特征峰。880 cm-1处的特征峰属于的vas(W-Oc-W)键,945 m-1处的特征峰属于的vas(W-Ot)键[16,17],因此3~6 h反应快速进行阶段溶液中存在的主要离子为,即是反应的前驱体之一。根据相关文献报道,在pH值区间为5~7的范围内尚能存在,当pH值降至2~4时,均不复存在,含钨离子主要以偏钨酸根和亚稳态的偏钨酸根形式存在,但2~4的pH值区间内仍可生成焦绿石型氧化钨,因此酸性环境下可能存在其它反应前驱体[18]。
关于W2O27-,最早见于1971年Chojnacka等人的研究:当钨酸钠溶液的浓度为0.01~0.02 mol/L时,将其酸化至pH值为10~7甚至更低的范围内,会出现离子,且该离子中所含的W元素在总钨中的比例可达4.5%~13.3%[19]。其后Каримова等人进一步补充了此观点,认为在此钨酸钠浓度范围内,当pH值在7.04~9.30范围内时,溶液中的阴离子数量会随钨浓度增加而增多[3]。Thierry Barré等人认为酸化钨酸钠溶液的过程中可以发生如下反应:在钨浓度低且碱性环境下,可以发生反应(5)。随着pH值的降低可以发生反应(6)和(7)。可是上述观点始终强调出现的前提条件是钨酸钠溶液浓度极低。而本文所配制的钨酸钠溶液浓度是Chojnacka实验所用的钨酸钠溶液浓度20倍以上,因此其观点的参考价值有限。

将分析纯固体Na2WO4与WO3按物质的量1∶1的比例在玛瑙研钵中研磨混合均匀,其后转入刚玉坩埚在750℃的高温下加热熔融10 min,冷却后便可得到较为纯净的Na2W2O7固体[20]。所得物质XRD图如图3所示。该物质在烧杯中加热搅拌10 min亦完全无法溶于水。
为探究Na2W2O7在适于生成焦绿石型氧化钨的环境中能否转变为H2W2O7,设计以下两组实验。1#向低压钢弹中加入0.4 g自制Na2W2O7,2#向低压钢弹中加入0.5 g Na2WO4·2H2O,两者均加入10 mL 0.2 mol/L HCl、90mL去离子水,将钢弹密封至100℃的低压釜中水热反应8 h,1#、2#反应物钨含量以WO3计均为0.015 mol/L。反应结束后分析滤液中的钨浓度时发现1#溶液中不含钨,2#根据反应后溶液中的钨含量计算得反应率为72.58%。滤渣经XRD分析前者仍为Na2W2O7,后者为H2W2O7。这说明Na2W2O7在适宜生成焦绿石型氧化钨的水热体系中仍难以溶解,即不可能作为反应的前驱体存在于该水热体系中,其只要遇到Na+就会结合生成难溶稳定物质Na2W2O7。

图3 自制Na2W2O7的XRD衍射图
从图1可以看出,酸化过程中最先出现的特征峰在920 cm-1处,但很快便又消失不见,随着该特征峰减弱的同时,880 cm-1处的特征峰逐渐出现并加强,呈现一个此消彼长的状态,即八面体钨同多酸根离子之间正在进行相互转化。相关文献认为呈只是酸化过程中短暂存在少量出现的热力学不稳定物质[21],920 cm-1处的特征峰可视为的特征峰。结合上文,可认为该反应方程式为:


2.2 热力学计算分析
已知平均热容,则温度为T K时离子反应的吉布斯自由能计算式如下所示:

298~T K之间的纯化合物及离子平均热容计算式分别如下所示:

a、b、c为常数,其值和相关化合物、离子的标准生成焓、吉布斯自由能、熵均可由热力学手册及文献查得。αT、βT数值见表4[22]。

表4 不同温度下各类离子的αT和βT的数值
H2W2O7(s)的热力学数据未见于热力学数据手册。根据刘桂华、李小斌等人的研究,组成相似的化合物的生成焓、吉布斯自由能以及恒压热容和熵均与其组成存在良好的线性关系[23]。焦绿石型氧化钨含0.5个结晶水,钨酸含1个结晶水,三氧化钨不含结晶水,因此可利用WO3(s)和H2WO4(s)的相关热力学数据估算H2W2O7(s)的热力学数据。表5为H2W2O7(s)在不同温度下的热容估算值,同理可通过热力学手册查得WO3(s)和H2WO4(s)的、,继而估算H2W2O7(s)的和。
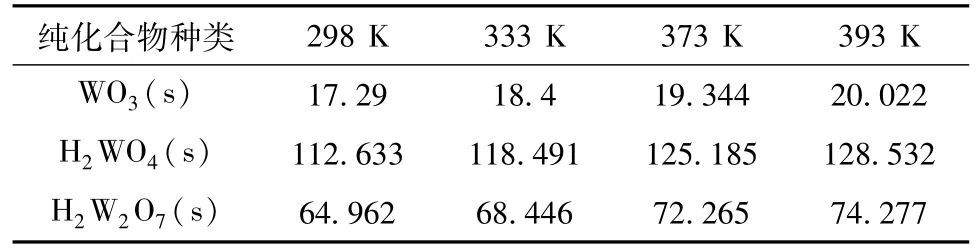
表5 H2W2O7(s)在不同温度下的热容估算值
H2W2O7(s)恒压热容的线性拟合方程为:

反应(9)和反应(10)的热力学计算结果如图4所示。

图4 反应(9)和(10)标准反应吉布斯自由能与温度的关系
3 结 论
1.利用FT-IR测试方法检测了不同酸化度下的Na2WO4溶液及水热合成焦绿石型氧化钨反应过程中的Na2WO4溶液的红外光谱的变化规律,结合现有文献资料,认为焦绿石型氧化钨的反应前躯体是和中的一种或几种。
[1] Reis K P,Ramanan A,Whittingham M S.Hydrothermal synthesis of sodium tungstates[J].Master of Chemistry,1990,2(3):219-221.
[2] 杨勇,施庆乐,陆丽华.用焦绿石型氧化钨制备阴极复合催化剂的研究[J].电源技术,2011,35(8):949-952.
[3] 李建圃.焦绿石型氧化钨超细粉体的水热合成与机理研究[D].长沙:中南大学,2010.
[4] 莫似浩.钨冶炼的原理和工艺[M].北京:轻工业出版社,1984.16-20.
[5] Reis K P,Ramanan A,Whittingham M S.Synthesis of novel compoundswith the pyrochlore and hexagonal tungsten bornze structures[J].Solid.State.Chem,1992,96(1):31-47
[6] 陈启元.有色金属基础理论研究[M].北京:科学出版社,2005.34-38.
[7] Thierry Barré,Laurent Arurault,Fran ois X.Sauvage.Chemical behavior of tungstate solutions[J].Spectrochimica Acta-Part A:Molecular and Biomolecular Spectroscopy,2005,61(4):551-557.
[8] Nakamoto K.Infrared and raman spectra of inorganic and coordination compounds[M].Bei Jing:Chemical Industry Press,1991.147-149.
[9] 王英伟,王自东,程灏波.新型激光晶体Yb:KY(WO4)2的结构与光谱[J].物理学报,2006,55(9):4 803-4 807.
[10]Maksimovskaya R I,Burtseva K G.17O and183W NMR Studies of the Paratungstate anions in Aqueous Solution[J].Polyhedron,1985,(4):1 559-1 562.
[11]Arnek R.Thermochemical studies of hydrolytic reaction.X.reaction of H+andin 3M sodium perchlorate[J].Acta Chem Scand,1969,23:1986.
[12]Cruywagen JJ,Van derMerwe IF J.Tungsten(Ⅵ)equilibria:a potentiometric and calorimetric investigation[J].Chem.Soc.Dalton Trans,1987,3:1 701.
[13]刘士军.几种钨同多酸盐及钨同多酸离子的热力学性质研究[D].长沙:中南大学,1999.
[14]Xu Zhen-he,Wang Xin-long,Li Yang-guang.A novel bismuth ion-bridged chainlike assembly from paradodecatungstate[H2W12O42]10-anions:(NH4)7[Bi(H2W12O42)]·20H2O[J].Inorganic Chemistry Communications,2007,10:276-278.
[15]李洪桂,羊建高.钨冶金学[M].长沙:中南大学出版社,2010.21.
[16]Song Lan-ying,Zhang Dong-di,Ma Peng-tao.Lanthanidecontaining peroxoisopolytungstate with tetrahedraltemplate core,[Ln4(WO4)(H2O)16{W7O22(O2)2}4]14-[J].Cryst Eng Comm,2013,15:4 597-4 600.
[17]Blandine Courcot,Adam J.Bridgeman.Structural and vibrational study of[Mo7O24]6-and[W7O24]6-[J].J.Phys.Chem.A,2009,113(39):10 540-10 548.
[18]Cruywagen J J.Protonation oligomerization and condensation reactions of vanadate(V),molybdate(VI),and tungstate(VI)[J]. Advances In Inorganic Chemistry,2000,49:127-182.
[19]Chojnacka J.Application of isomatrix eledtromigration to the investigation of the condensation of theions[J].Inorg.Nucl.Chem,1971,(33):1 345-1 363.
[20]Liu Shi-jun,Chen Qi-yuan,Zhang Ping-min.Thermodynamic properties of Na2W2O7(s)and Na2W4O13(s)in the temperature range298.15±1 000 K[J].Thermochimica Acta,2001,371:7-11.
[21]李洪桂,羊建高.钨冶金学[M].长沙:中南大学出版社,2010.18.
[22]戴曦.有色冶金原理[M].长沙:中南大学出版社,1998.88.
[23]刘桂华,李小斌,李永芳.复杂无机化合物组成与热力学数据间的线性关系及其初步应用[J].科学通报,2000,45(13):1 386-1 392.
Study on the Reaction M echanism of Hydrothermal Synthesis of Pyrochlore-type Tungsten Oxides
ZHANG Qin-jian
(School of Metallurgy and Environment,Central South University,Changsha 410083,China)
Pure sodium tungstate solution as the initial reactants,hydrochloric acid as an additive,pyrochlore-type tungsten oxide is prepared by hydrothermal synthesismethod in alkaline systems.Analysing the infrared spectrum variation of Na2WO4solution under different acidification degree and in different time period of reaction through FT-IR testmethod,it analyzes and discusses the precursor in preparing pyrochlore-type tungsten oxide from,and.Ruled out the possibility thatandas the precursor,we think the precursors areand,and prove auxiliary by thermodynamic calculations.
pyrochlore-type tungsten oxides;hydrothermal synthesis;reaction mechanism
TF841.1
:A
:1003-5540(2014)03-0037-05
2014-04-08
张勤俭(1990-),男,硕士研究生,主要从事有色金属冶金研究工作。

