清热排毒胶囊对急性痛风大鼠模型IL-1β、IL-8和TNF-α的影响
王苗慧,马鸿斌,孙红旭,杨雪芳,常建全
(1.甘肃中医学院2011级硕士研究生,甘肃 兰州 730000;2.甘肃中医学院附属医院,甘肃 兰州 730020)
痛风(Gout)是由于嘌呤代谢紊乱和(或)尿酸排泄障碍所引起的血尿酸增高的代谢性疾病,急性痛风性关节炎(acute gouty arthritis)是其最常见的首发症状。近年来,研究认为痛风性关节炎的发生发展过程与IL-1、IL-6、IL-8、TNF-α等细胞因子有关[1]。导师马鸿斌教授临床应用清热排毒胶囊治疗急性痛风性关节炎取得满意效果。我们通过检测急性痛风模型大鼠踝关节浸出液中炎性细胞因子IL-1β、IL-8和TNF-α的含量,探讨清热排毒胶囊防治急性痛风性关节炎的部分作用机理,总结如下。
1 实验材料
实验动物:健康SPF级SD雄性大鼠60只,体质量(200±20)g,购自甘肃中医学院SPF实验中心,实验动物质量合格证号SCXK(甘)2011-0001-0001221。实验期间大鼠自由摄食和饮水。
药品与试剂:清热排毒胶囊(土茯苓、秦艽、萆薢、薏苡仁、延胡索、没药、三七、黄芪等),由甘肃中医学院附属医院制剂科制成生药胶囊,每粒0.45g,批号121022;双氯芬酸钠双释放肠溶胶囊(戴芬),TemmLer Werke GmbH生产,每片75mg,批号104166;尿酸钠(MSU),SIGMA公司,每瓶5g,批号10010995;IL-1β、IL-8和TNF-α ELISA试剂盒,购自上海丽臣商贸有限公司,批号CK-E30419,CKE30583,CK-E30635。
实验仪器:游标卡尺(上海申韩量具有限公司),BP210S 电子分析天平(Sartorius公司提供),SHZ-82水浴恒温振荡器(金坛市恒丰仪器厂),10~500μL微量移液器(上海求精生化试剂仪器有限公司),酶联免疫检测仪(Benchmark Plus,美国BIO-RAD)。其余相关设备由甘肃中医学院科研实验中心提供。
2 实验方法
分组与给药:选用健康SPF级SD雄性大鼠60只,适应性喂养1周,称重,之后采用随机数字表法随机分为空白组、模型组、双氯芬酸钠缓释片组(戴芬组)、清热排毒胶囊高、中、低剂量组,每组10只。根据人与动物及各类动物间药物剂量的换算方法,清热排毒胶囊高、中、低剂量组的给药剂量分别为1g/kg、0.5g/kg、0.25g/kg,戴芬组给药剂量为6.8mg/kg,溶于蒸馏水配制成相应浓度的灌胃药液。空白组、模型组给予相应体积的蒸馏水。灌胃按1mL/100g计算,以上各组每天灌胃给药1次,连续给药7天。
造模方法:取500mg尿酸钠晶体(MSU)加入25mL 0.9%氯化钠注射液,搅拌制成浓度为20mg/mL的尿酸钠溶液。采用改良后的Coderre大鼠动物模型造模方法[2,3]。第5天灌胃给药1h后,选受试大鼠右侧踝关节背侧,常规碘伏消毒后,用6号注射针与胫骨成45℃方向插入踝关节,将100μL尿酸钠溶液注入到踝关节腔,以关节囊对侧鼓起为注入标准,即成大鼠急性痛风性关节炎模型。空白组用等体积生理盐水溶液关节腔注射。
取材方法:造模48h后将所有实验动物用过量水合氯醛(350mg/kg)腹腔注射麻醉处死,剪取右侧踝关节(关节近端及远端各保留约0.5cm),去皮,剪开关节周围组织,将组织浸泡于盛有3mL生理盐水的离心管中,恒温震荡10min后再浸泡1h,4℃低温离心(12000rpm,10min),取上清液分装于EP管中,-80℃低温冰箱冻存待测相关指标。
3 观察方法
观测指标:观察各组大鼠造模前后关节皮色、皮温、肿胀等一般情况。大鼠踝关节肿胀度测定方法为实验前在每只大鼠右侧踝关节处用记号笔作一清晰标记,通过2~3mm宽纸条和游标卡尺测量造模前、后不同时间段的踝关节周径,计算出踝关节肿胀度=(测定时间点关节周径-初始周径)/初始周径。采用 ELISA 法检测大鼠踝关节浸出液中IL-1β、IL-8和TNF-α的含量,具体操作步骤按试剂盒说明书进行。
4 实验结果
一般情况。各组大鼠造模前精神状态佳、活泼好动,造模后大鼠右踝关节明显红肿、灼热、倦怠懒动、摄食量明显减少。空白组关节与造模前相比略增粗,无明显红肿及活动受限的表现。模型组关节红肿、灼热较药物治疗组明显,说明各药物治疗组预防性给药有效。
各组大鼠踝关节肿胀度见表1。
表1 各组大鼠踝关节肿胀度比较 (%,)
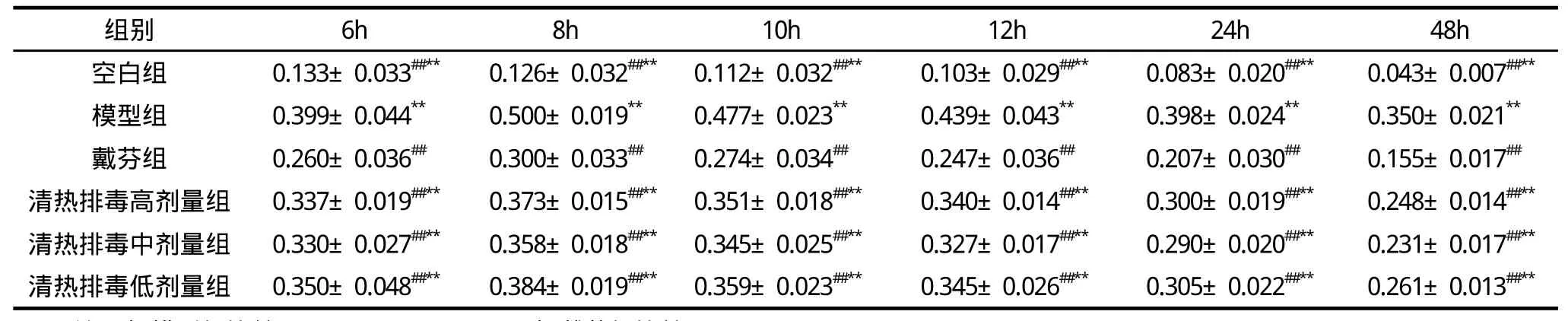
表1 各组大鼠踝关节肿胀度比较 (%,)
注:与模型组比较,#P<0.05,##P<0.01;与戴芬组比较,*P<0.05,**P<0.01。
组别 6h 8h 10h 12h 24h 48h空白组 0.133±0.033##** 0.126±0.032##** 0.112±0.032##** 0.103±0.029##** 0.083±0.020##** 0.043±0.007##**模型组 0.399±0.044** 0.500±0.019** 0.477±0.023** 0.439±0.043** 0.398±0.024** 0.350±0.021**戴芬组 0.260±0.036## 0.300±0.033## 0.274±0.034## 0.247±0.036## 0.207±0.030## 0.155±0.017##清热排毒高剂量组 0.337±0.019##** 0.373±0.015##** 0.351±0.018##** 0.340±0.014##** 0.300±0.019##** 0.248±0.014##**清热排毒中剂量组 0.330±0.027##** 0.358±0.018##** 0.345±0.025##** 0.327±0.017##** 0.290±0.020##** 0.231±0.017##**清热排毒低剂量组 0.350±0.048##** 0.384±0.019##** 0.359±0.023##** 0.345±0.026##** 0.305±0.022##** 0.261±0.013##**
各组大鼠踝关节浸出液中IL-1β、IL-8和TNF-α含量见表2。
表2 各组大鼠踝关节浸出液中IL-1β、IL-8和TNF-α含量 (pg/mL,)

表2 各组大鼠踝关节浸出液中IL-1β、IL-8和TNF-α含量 (pg/mL,)
注:与模型组比较,#P<0.05,##P<0.01;与戴芬组比较,*P<0.05,**P<0.01;与清热排毒中剂量组比较,▲P<0.05,▲▲P<0.01。
组别 剂量 IL-1β IL-8 TNF-α空白组 - 3.88±0.36## 29.60±3.66## 3.10±0.51##模型组 - 4.90±0.46**▲ 37.90±4.76**▲ 4.25±0.46▲**戴芬组 6.8mg·kg-1 4.00±0.37## 31.44±2.54## 3.21±0.42##清热排毒高剂量组 1g·kg-1 4.30±0.39## 33.20±2.48# 3.59±0.60##清热排毒中剂量组 0.5g·kg-1 4.21±0.52## 32.67±3.65## 3.33±0.36##清热排毒低剂量组 0.25mg·kg-1 4.44±0.50# 34.07±4.45# 3.73±0.56#*
5 讨 论
急性痛风性关节炎属中医 “痹证”、“历节病”、“白虎历节”范畴。元代朱丹溪所著《格致余论·痛风论》中明确提出痛风的病机理论为“热血得寒,污浊凝涩,所以作痛”,说明痛风的发生是由于一种病理产物阻遏脉道,影响气血正常运行,不通则痛。马鸿斌教授认为本病的发生多由先天正气不足或劳倦过度,风、寒、湿、热之邪侵袭人体,痹阻关节经络,以致经络阻滞,气血运行不畅而致。初起属实证,多为湿热痹阻、气滞血瘀。清热排毒胶囊有利湿清热、活血消肿功效。方中萆薢性平味苦,能祛风除湿、通络止痛;土茯苓“利湿去热,能入络,搜剔湿热之蕴毒”(《本草正义》),用于肢体拘挛、关节不利等症共为君药。延胡索辛散温通,为活血行气止痛之良药。没药活血化瘀止痛共为臣药。使以三七味甘微苦性温,活血化瘀而消肿定痛。秦艽、薏苡仁等加强清热利湿之力。使以黄芪益气健脾以防诸药伤正。甘草调和诸药。诸药合用,共奏补肝肾、益气血、利湿浊之功。实验结果显示,造模后大鼠踝关节明显红肿、灼热、活动受限,造模48h后清热排毒胶囊中剂量组大鼠踝关节肿胀度与戴芬组相当,提示清热排毒胶囊能够降低急性痛风性关节炎大鼠踝关节肿胀度,具有抗炎消肿的作用。
现代医学认为,急性痛风性关节炎是体内长期嘌呤代谢紊乱导致血尿酸升高,当超过了尿酸溶解度,尿酸钠微晶体即可沉积在关节滑膜及其周围组织上,刺激关节滑膜,发生滑膜局部血管扩张、通透性增加、白细胞聚集等炎症反应,进而出现急性痛风性关节炎[4]。诸多研究表明,IL-1β、IL-8和TNF-α作为炎症趋化因子和激活因子在痛风性关节炎的发生、发展过程中发挥着重要作用,认为IL-1β、TNF-α是前炎症网链中的一级细胞因子,而IL-8是由IL-1β、TNF-α诱导的二级前炎症细胞因子[5]。用尿酸钠诱导急性痛风性关节炎大鼠模型48h后,模型组踝关节浸出液中IL-1β、IL-8和TNF-α均有较高水平的表达,表明这些炎性细胞因子参与了痛风的发病过程。实验研究显示,清热排毒胶囊中剂量组对大鼠急性痛风性关节炎模型大鼠踝关节浸出液中IL-1β、IL-8和TNF-α的表达有明显抑制作用,可达到与戴芬相似的炎症抑制作用,由此推测清热排毒胶囊对急性痛风性关节炎具有一定的治疗作用,其发挥抗炎作用机制可能与抑制滑膜组织中IL-1β、IL-8和TNF-α的表达有关,但其具体作用机制尚待进一步研究。
[1]Chapman PT,Yarwood H,Harrison AA,et al.Endothelial activation in monosodium urate monohydrate crystal-induced inflammation:in vitro and in vivo studies on the roles of tumor necrosis factor alpha and interleukin-1[J].Arthritis Rheum,1997,40(5):955-965.
[2]Coderre TJ,Wall PD.Ankle joint urate arthritis in rats:an alternative animal model of arthritis to that produced by Freund’s adjuvant[J].Pain,1987,28(3):379-393.
[3]Coderre TJ,Wall PD.Ankle joint urate arthritis in rats provides a useful tool for the evaluation of analgesic and anti-arthritic agents[J].Pharmacol Biochem Behav,1988,29(3):461-466.
[4]周莉.痛风的发病机制[J].医学综述,2011,13(21):28.
[5]Shrestha M,Chiu MJ,Martin RL,et a1.Treatment of acute gouty arthritis with intramuscular ketorolac tromethamine[J].Am J Emerg Med,1994,12(4):454-455.

