黄姑鱼仔稚鱼发育过程中氨基酸和脂肪酸的变化
金煜华,谢中国,楼 宝,史会来
(1.浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021;2.浙江海洋学院水产学院,浙江舟山 316022;3.浙江舟山普陀海洋高科技园,浙江舟山 316102;4.湖南文理学院生命科学学院,湖南常德 415000)
黄姑鱼Nibea albiflora Richardson俗称黄婆鸡,属鲈形目、石首鱼科、黄姑鱼属,具有肉味鲜美、营养丰富、养殖效益高等特点,是我国的重要海水经济鱼类。近年来陆续开展了黄姑鱼生物学、全人工繁殖及大规格鱼种培育技术研究等工作[1,2]。传统的黄姑鱼苗培育一般采用轮虫、卤虫和桡足类等生物活饵,但生物饵料成本昂贵,营养不全面,产量不稳定且易携带病原菌,育苗成活率仅为10%左右,严重制约着黄姑鱼产业的发展。研制适用于黄姑鱼仔稚鱼的人工配合饲料部分或全部代替生物饵料是解决这一问题的迫切需求。由于对黄姑鱼仔稚鱼营养需求了解十分有限,因此难以配置出营养均衡全面的饲料。研究黄姑鱼仔稚鱼发育过程中氨基酸、脂肪酸的变化,以期为开发优质高效的仔稚鱼微粒饲料提供理论基础。
1 材料与方法
1.1 试验材料
实验于2012年6-7月在浙江省海洋水产研究所西闪试验场进行,实验所用黄姑鱼亲鱼为该试验场人工繁育的体质健壮、无病无伤的2年龄黄姑鱼。经人工催产,收集受精卵于5 m×2 m×2 m的育苗池中充气培养,育苗所用水为经沉淀和沙滤后的天然海水,盐度26.5~27.0。受精卵孵化期间水温27±1℃,经30 h左右孵出;仔稚幼鱼在原池中培育,水温27±2℃。
初孵仔鱼2日龄开口摄食,开口饵料为经过小球藻强化培育的褶皱臂尾轮虫,10日龄左右投喂卤虫无节幼体,12日龄开始投喂桡足类或人工配合饲料。人工育苗饵料系列及使用时间如图1所示。

图1 黄姑鱼人工育苗饵料系列及使用时期Fig.1 Feeding regime of the N.albiflora larvae
1.2 样品采集
实验所取样品为1、5、10、20、45日龄的仔稚鱼,取样时间均在早晨投喂饲料前,样品取全鱼,随机取出的仔稚鱼放入无饵料水族箱内1 h,20、45日龄稚鱼饥饿24 h。然后将所取的仔稚鱼置于冰盘上致死。所得的样品放在-80℃冰箱保存。仔稚鱼样品在氨基酸、游离氨基酸、脂肪酸分析前,用美国电热YO-230冷干机经充分冷冻干燥至恒重。
1.3 氨基酸分析
样品用6 mol/L的盐酸溶液在110℃下水解22 h,然后过滤水解液,用超纯水定容后取2 mL减压蒸干,干燥完后加入0.02 mol/L的盐酸溶液2 mL溶解全部氨基酸,上机进行色层分析。用美国安捷伦Agilent 1100全自动氨基酸分析仪测定样品中的的氨基酸组成。
1.4 游离氨基酸分析
准确称取1.0 g样品,加15 mL 5%三氯乙酸溶液匀浆,定容至25 mL,于4℃放置24 h。用定性滤纸过滤吸取0.1 mL在10 000 r/min下离心10 min,于4℃保存待检测用。用美国安捷伦Agilent 1100全自动氨基酸分析仪测定样品中游离氨基酸。
1.5 脂肪酸分析
检测方法采用GB/21514—2008,使用日本岛津GC-2010气相色谱仪测定。
1.6 数据处理
实验所得数据采用SPSS19.0软件处理,做单因素方差(One-way ANOVA)分析,若差异显著(P<0.05)则进行Duncan多重比较。结果数据均用平均值±标准差(mean±SD,n=3)表示。
2 结果与讨论
2.1 黄姑鱼仔稚鱼氨基酸变化模式
各日龄黄姑鱼仔稚鱼所含必需氨基酸与非必需氨基酸的变化模式见表1。不同日龄的黄姑鱼水解氨基酸中,必需氨基酸中的精氨酸、缬氨酸、亮氨酸、异亮氨酸、赖氨酸5种氨基酸的含量最高,占必需氨基酸总量的70%左右。必需氨基酸中的组氨酸、蛋氨酸含量最低,仅占必需氨基酸的10%左右。水解氨基酸的总量呈上升趋势,必需氨基酸的总量,先下降,后上升。从不同日龄的氨基酸含量来看,赖氨酸为第一限制性氨基酸。非必需氨基酸中,天冬氨酸、谷氨酸和丙氨酸的含量最高,占非必需氨基酸总量的60%左右。随发育阶段不同,仔稚鱼的各种氨基酸含量差异较大。
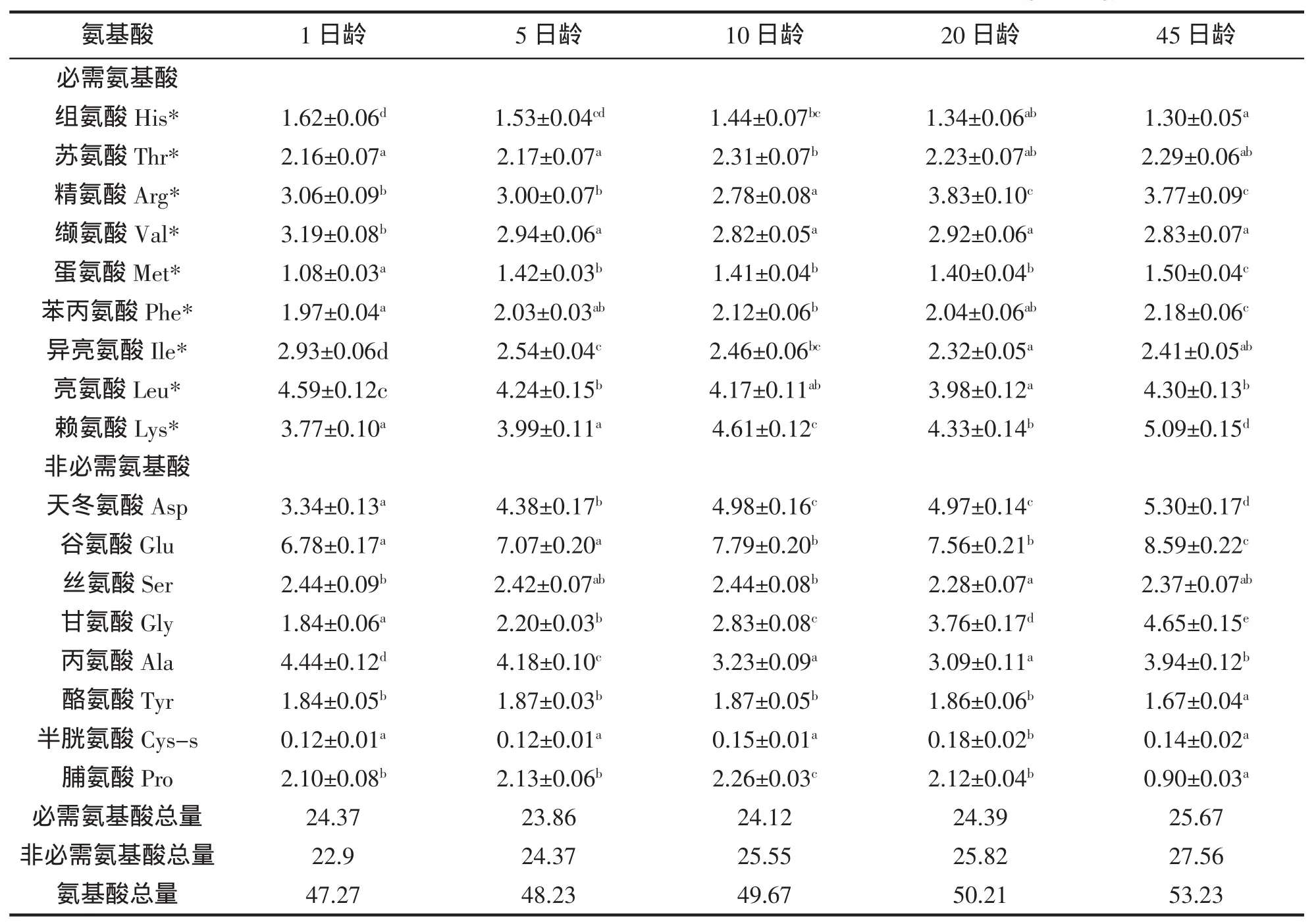
表1 黄姑鱼仔稚鱼氨基酸的含量(g/100 g)Tab.1 Contents and compositions of amino acids of N.albiflora larvae(g/100 g)
对仔稚鱼饲料而言,任何一种必需氨基酸(EAA)的缺乏或者不足均会提高氨基酸的氧化代谢,导致鱼类生长性能下降和饲料转化率的降低[3-4]。因此,了解仔稚鱼对每种必需氨基酸的特定需求量对能否配制出营养平衡且成本较低的饲料至关重要。海水仔稚鱼具有较高的生长率[5],因而对氨基酸有较高的需要量,以满足其体蛋白的沉积、更迭、能量代谢及其它生理功能。海水仔稚鱼的必需氨基酸通常认为与已经确定的鱼类的必需氨基酸一致,为蛋氨酸、赖氨酸、精氨酸、组氨酸、亮氨酸、异亮氨酸、苯丙氨酸、苏氨酸、色氨酸、缬氨酸10种氨基酸。在实践中采用鱼肉氨基酸组成指标作为鱼类必需氨基酸需要量能较好地反映鱼类氨基酸需要量,理想的饲料氨基酸模式应该是仔稚鱼的体组成氨基酸模式[6]。与幼成鱼相比,由于不同时期仔稚鱼器官和组织的发育速度不同,从而导致仔稚鱼体的氨基酸组型随发育阶段不同而变化较大。ARAGÃO等[3]的研究结果表明半滑舌鳎仔稚鱼的氨基酸组型在发育过程不断变化,必需氨基酸的需要量同时发生变化,很难制备能够完全满足仔稚鱼各个时期氨基酸需要的平衡饲料。饲料中氨基酸的平衡能提高氨基酸的转化率,促进仔稚鱼的生长以及对蛋白质的利用效率。随着仔稚鱼营养研究的进一步深入,越来越多的研究结果表明仔稚鱼具有较强的调节氨基酸代谢能力。由于传统方法难以推测仔稚鱼的氨基酸需要量,近年来不少科研工作者采用同位素标记的方法来研究仔稚鱼的氨基酸需要量[7-9]。
2.2 黄姑鱼仔稚鱼游离氨基酸变化模式
黄姑鱼仔稚鱼发育阶段的游离氨基酸含量见表2。1日龄的仔稚鱼游离氨基酸含量最高,为12.134 g/100 g;45日龄仔稚鱼的游离氨基酸含量最低,为1.497 g/100 g。随着仔稚鱼的生长,游离氨基酸的含量呈降低趋势,20日龄的黄姑鱼仔稚鱼游离氨基酸含量略有升高,推断可能跟摄食的饵料卤虫有关。随着仔稚鱼发育阶段不同,各种游离氨基酸含量差异比较显著。
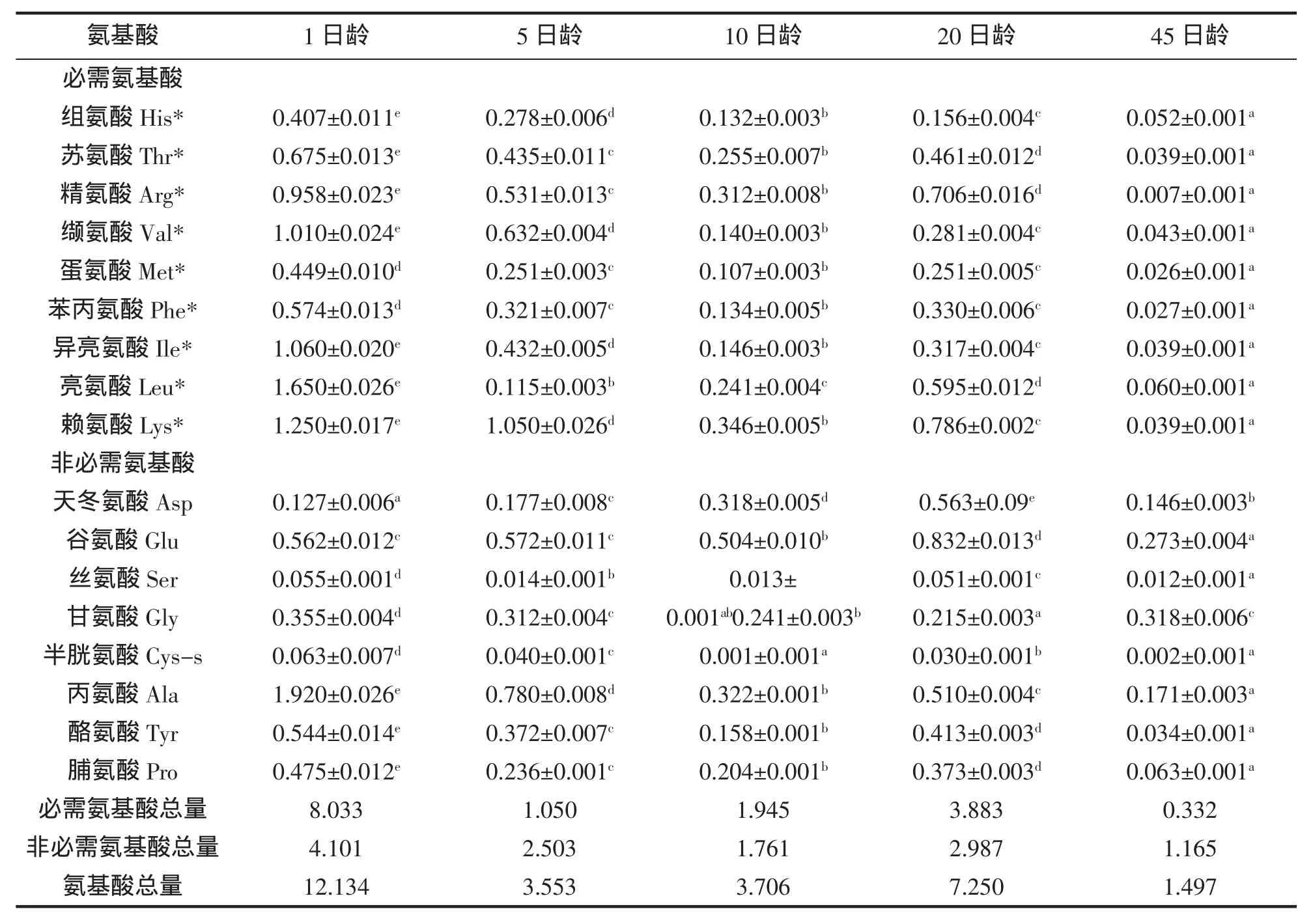
表2 黄姑鱼仔稚鱼游离氨基酸的含量(g/100 g)Tab.2 Contents and compositions of free amino acids of N.albiflora larvae(g/100 g)
游离氨基酸(FAA)既是重要的代谢供能物质,也是鱼体蛋白质生物合成的主要底物。游离氨基酸在海水鱼鱼卵成熟过程及孵化早期发挥着重要的作用,研究发现游离氨基酸可以作为鲑鱼Gadus morhua卵和仔稚鱼发育的能量源[10]。RØNNESTAD等[4]认为海水鱼类的胃在仔稚鱼时期尚未成功分化,导致仔稚鱼摄食的蛋白质无法高效率的变性、降解,而蛋白质的降解产物小分子肽类物质或游离氨基酸相对于蛋白质来说更容易被仔稚鱼吸收和利用,科研工作者已逐渐重视游离氨基酸及小肽的营养作用。将14C标记的游离氨基酸精氨酸、赖氨酸添加到饲料,采用管饲技术饲喂大西洋鲑Hippoglossus hippoglossus仔稚鱼,30 min后发现肠道的平均吸收率高达71%,而排出率仅为6%[11]。海水仔稚鱼摄食生物活饵后,游离氨基酸迅速释放被仔稚鱼吸收利用,因此推测游离氨基酸在鱼类消化系统发育不完善的早期阶段发挥着重要的生理作用。研究证实,饲料中蛋白的可溶性以及肽的构型会极大程度地影响仔鱼的生长[12]。游离氨基酸中的甘氨酸、丙氨酸和精氨酸可作为仔稚鱼的诱食剂[13]。在仔稚鱼饲料中添加过量的游离氨基酸,其效果往往会适得其反。受限于鱼体体内有限的转运载体,大量的游离氨基酸不能被吸收利用,而是通过鳃、泌尿系统等途径排出体外,不会被用于蛋白质合成以促进生长。
2.3 黄姑鱼仔稚鱼脂肪酸组成
黄姑鱼仔稚鱼体脂肪酸的变化模式见表3。黄姑鱼仔稚鱼发育过程的主要脂肪酸为:16:0、18:0、16:1、18:1和DHA,其总量占脂肪酸总量的70%左右。仔稚鱼必需的脂肪酸DHA、EPA、ARA在仔稚鱼的发育过程中含量变化均较为显著,但均处于较高的含量水平。饲料脂肪酸组成直接影响到养殖对象脂肪酸组成和含量,由于不同日龄仔稚鱼摄食不同的饵料,而不同饵料的脂肪酸组成不同,从而造成不同日龄仔稚鱼的脂肪酸组成差异较大。

表3 黄姑鱼仔稚鱼脂肪酸组成(占总脂肪酸的质量百分比)Tab.3 Contents and compositions of fatty acids of the N.albiflora larvae(weight percentage of total fatty acids)
脂类是鱼类胚胎发育过程中重要的代谢能源,同时为海洋鱼类提供必需脂肪酸。对海水鱼鱼卵的脂肪酸组成分析发现,DHA和EPA在总脂肪酸中所占比重非常高,并且这种高水平一直持续于胚胎发育的全过程中,说明这两种脂肪酸在胚胎发育的过程中发挥着重要的作用。特别是n-3系列高度不饱和脂肪酸HUFA能影响水产动物亲体的繁殖力、受精率以及仔鱼生长和存活率[14-16]。n-3HUFA如DHA、EPA是海水仔稚鱼的必需脂肪酸,必须从饲料中获得[17-18]。n-6HUFA如ARA的作用也越来越得到重视,ARA对海水仔稚鱼的生长、渗透压调节、存活率、鱼体脂肪酸组成、繁殖、变态过程、体色、免疫力等方面同样发挥着重要的影响[19]。仔稚鱼脂肪酸的研究方向由分析单独的脂肪酸营养成分向研究脂肪酸整体营养成分发展,考虑各种营养成分合适的配比,RAINUZZO等[20]发现DHA和EPA的比例平衡对于维持生物膜的流动性极为重要,一旦两者比例失衡,尤其当EPA高而DHA低时,会使磷脂结构的组成不平衡,从而导致仔稚鱼不能正常生长。海水鱼卵中脂类的含量和组成相当于仔、稚鱼的脂类需要,故对于开始外源性摄食的仔鱼而言,理想饵料的脂肪酸组型应是与卵或卵黄囊仔鱼的脂肪酸组型相近[21-22]。饲料脂肪酸组成直接影响到养殖对象脂肪酸组成已被大量的文献报道所证实。由于本研究中不同日龄的仔稚鱼摄食的饵料脂肪酸组成不同,这也是造成鱼体脂肪酸组成差异的直接原因。
3 结论
黄姑鱼仔稚鱼发育过程中,由于各器官和组织的发育速度不同,不同饵料之间的氨基酸组型存在差异,导致黄姑鱼仔稚鱼的氨基酸组型是不断变化的。必需氨基酸中的精氨酸、缬氨酸、亮氨酸、异亮氨酸、赖氨酸5种氨基酸的含量最高。1日龄的黄姑鱼仔稚鱼的游离氨基酸含量最高,随后游离氨基酸的含量呈降低趋势。黄姑鱼仔稚鱼的主要脂肪酸为:16:0、18:0、16:1、18:1和DHA。仔稚鱼必需的脂肪酸DHA、EPA、ARA均处于较高的含量。
[1]雷霁霖,陈 超,徐延康,等.黄姑鱼工厂化育苗技术研究[J].海洋科学,1992,11(6):5-10.
[2]楼 宝,史会来,毛国民,等.黄姑鱼全人工繁育及大规格苗种培育技术研究[J].现代渔业信息,2011,26(3):20-23.
[3]ARAGÃO C,CONCEICÃO L E C,FYHN H,et al.Estimated amino acid requirements during early ontogeny in fish with different life styles:gilthead seabream(Sparus aurata)and Senegalese sole(Solea senegalensis)[J].Aquaculture,2004,242:589-605.
[4]RφNNESTAD I,THORSEN A,FINN R N.Fish larval nutrition:recent advances in amino acid metabolism[J].Aquaculture,1999,177:201-216.
[5]DABROWSKI K.Ontogenetical aspects of nutritional requirements in fish[J].Comp Biochem Physiol,1986,85:639-655.
[6]MAMBRINI M,KAUSHIK S J.Indispensable amino acid requirements of fish:correspondence between quantitative data and amino acid profiles of tissue proteins[J].Journal of Applied Ichthyology,1995,11:240-247.
[7]R?NNESTAD I,ROJAS-GARCA C R,TONHEIM S,et al.In vivo studies of digestion and nutrient assimilation in marine fish larvae[J].Aquaculture,2001,201:161-175.
[8]HOVDE S C,VIDAL M C,OPSTAD I,et al.Design and synthesis of 14C-labeelled proteins as tools for protein digestion studies in fish larvae[J].Aquaculture Nutrition,2005,11:395-401.
[9]LE VAY L,GAMBOA-DELGADO J.Naturally-occurring stable isotopes as direct measures of larval feeding efficiency,nutrient incorporation and turnover[J].Aquaculture,2011,315:95-103.
[10]FYHN H J,SERIGSTAD B.Free amino acids as energy substrate in developing eggs and larvae of the cod Gadus morhua[J].Marine Biology,1987,296:335-341.
[11]APPLEBAUM S L,RφNNESTAD I.Absorption,assimilation and catabolism of individual free amino acids by larval Atlantic halibut(Hippoglossus hippoglossus)[J].Aquaculture,2004,230:313-322.
[12]CARVALHO A P,SA R,OLIVA TELES A,et al.Solubility and peptide profile affect the utilization of dietary protein by common carp(Cyprinus carpio)during early larval stages[J].Aquaculture,2004,234:319-333.
[13]薛 敏,解绶启,崔奕波,等.鱼类促摄食物质研究进展[J].水生生物学报,2003,27(6):639-643.
[14]IZQUIERDO M S,SOCORRO J,ARANTZAMENDI L,et al.Recent advances in lipid nutrition in fish larvae[J].Fish Physiology and Biochemistry,2000,22:97-107.
[15]KOVEN W M,TANDLER A,KISSIL G W,et al.The effect of dietary n-3 highly unsaturated fatty acids on growth,survival and swim bladder development in Sparus aurata larvae[J].Aquaculture,1990,91:131-141.
[16]SALHI M,IZQUIERDO M S,HERNÁNDEZ-CRUZ C M,et al.Effect of lipid and n-3 HUFA levels in microdiets on growth survival and fatty acid composition of larval gilthead seabream(Sparus aurata)[J].Aquaculture,1994,124:275-282.
[17]刘镜恪.海鱼早期阶段必需脂肪酸和磷脂的研究现状与展望[J].海洋水产研究,2002,23(2):58-64.
[18]IZQUIERDO M S.Essential fatty acid requirements of cultured marine fish larvae[J].Aquaculture Nutrition,1996,2:183-191.
[19]KOVEN W,ANHOLT R V,LUTZKY S,et al.The effect of dietary arachidonic acid on growth,survival,and cortisol levels in different-age gilthead seabream larvae(Sparus auratus)exposed to handling or daily salinity change[J].Aquaculture,2003,228:307-320.
[20]RAINUZZO J R,REITAN K I,OLSEN Y.The significance of lipids at early stages of marine fish:A review[J].Aquaculture,1997,155:103-115.
[21]SARGENT J R,BELL J G,MCEVOY L A,et al.Recent development s in the essential fatty acid nutrition of fish[J].Aquaculture,1999,177:191-199.
[22]RAINUZZO J R,REITAN K I,OLSEN Y.The significance of lipids at early stages of marine fish:A review[J].Aquaculture,1997,155:103-115.

