奶牛不同发育时期乳腺组织IGF-I及其受体的表达与定位
崔英俊,李庆章
(东北农业大学 乳品科学教育部重点实验室,哈尔滨150030)
0 引 言
胰岛素样生长因子家族(Insulin-like growth factor family)是乳腺生长发育的重要调节因子。成熟IGF-I由70个氨基酸残基组成,相对分子质量约7.5 ku,是生长激素 (Growth factor,GH) 依赖的碱性单链蛋白[1]。IGF-I主要由垂体GH刺激肝产生,GH也可以刺激乳腺分泌IGF-I,并通过IGF-I对乳腺发育起作用。IGFI作于乳腺上皮细胞上的IGF-IR从而介导细胞的生存和增殖[2-3],IGF-I缺失时乳腺不发育[4]。目前国内外对胰岛素样生长因子家族成员的研究多以啮齿类动物为研究对象,且多局限于RNA水平。本研究旨在阐述IGF-I及其受体IGF-IR在奶牛乳腺发育、泌乳及退化过程中表达定位的动态变化,揭示IGF-I及其受体表达变化与乳腺发育及泌乳功能的关系。
1 实 验
1.1 实验动物与样品采集
本研究以健康荷斯坦奶牛为实验动物,购自黑龙江省畜牧业科技园区。所选用的奶牛生理状态均正常,没有疾病记录,泌乳期奶牛乳腺健康,产奶量正常。奶牛舍饲,舍温18℃,通风干燥,采光良好,自由采食饮水。
实验动物按照青春期(Virgin,V)、妊娠期(Pregnancy,P)、泌乳期(Lactation,L)、退化期(Involution,I)4个时期共12个时点进行取样。分别为:青春期12个月(V12m)、青春期14个月(V14m);妊娠期2个月(P2m)、妊娠期4个月(P4m)、妊娠期6个月(P6m);围产前期(产前7日,Peripartum);泌乳期第7日(L7d),泌乳期第50日(L50d),泌乳期第140日(L140d),泌乳期第280日(L280d);退化期第3日(I3d),退化期第30日(I30d)。 每个采样时点选取3头奶牛做平行实验,每次试验至少重复3次。在预定取样时点,乳房中部消毒,按常规手术切取少量乳腺组织块,获取组织样本。获取的组织样本在30 min内于液氮速冻,保存于-80℃低温冰箱备用。
1.2 主要试剂
兔抗IGF-I多克隆抗体 (H-70)(sc-9013), 兔抗IGF-I Rβ多克隆抗体(3027),鼠抗β-actin抗体(C-14)(sc-47778),FITC-羊抗兔IgG(sc-2012),HRP-鸡抗兔IgG,HRP-鸡抗鼠IgG,正常山羊血清封闭液,DAPI (4,6-联脒-2-苯基吲哚),TritonX-100,DABCO(1,4-重氮基双环[2,2,2]辛烷),BCA蛋白浓度测定试剂盒,RIPA蛋白裂解液 (P0013B),ECL超敏化学发光液,Tricine(三[羟甲基]甲基甘氨酸)。其他试剂均为市售分析纯试剂。
1.3 方法
1.3.1 免疫荧光检测
厚度8 m的冰冻切片复温后置于预冷丙酮,4℃固定10 min,PBS漂洗3次。体积分数10%的山羊血清 37℃封闭2 h,再加入一抗(1:50)(阴性对照加等量PBS),4 ℃过夜。次日PBS漂洗3 次,FITC-羊抗兔IgG(1∶100)37 ℃孵育30 min,PBS漂洗3次。 DAPI(10 mg/L)染液室温染核5 min,PBS漂洗3次,DABCO封片。激光扫描共聚焦显微镜 (Laser Scanning Confocal Microscopy,LSCM)进行扫描拍照(400×)。
1.3.2 蛋白提取及Western blotting分析
称取100 mg奶牛乳腺组织样本剪碎后,于玻璃匀浆器中加入1 mLRIPA蛋白裂解液(PMSF终浓度为1 mmol/L),冰上匀浆;充分裂解后,4 ℃,12 000 r/min离心5 min,取上清,即为总蛋白;用BCA蛋白浓度测定试剂盒测定蛋白浓度。
蛋白样品调至等浓度,与2×上样缓冲液1:1混合,煮沸10 min,冷却后50 μg/孔上样,分别用8%SDS聚丙烯酰胺凝胶电泳 (SDS-PAGE)分离IGF-IRβ,用16%Tricine-SDS-PAGE分离IGF-I,电泳结束后用半干转移电泳法将蛋白转至硝酸纤维素膜 (NC膜)。TBS洗涤NC膜10 min;将其放入适量50 g/L(质量浓度)脱脂乳封闭液(TBS/T配制)中,37℃孵育1.5 h,一抗(兔抗IGF-I多克隆抗体1∶1000稀释、兔抗IGF-I Rβ多克隆抗体1∶1000稀释,鼠抗β-actin抗体,1∶500稀释)4℃孵育过夜。TBS/T洗膜3次,每次5 min,二抗(HRP-山羊抗兔IgG 1∶10 000稀释、HRP-鸡抗鼠IgG 1∶1 000稀释)孵育,室温1 h,洗膜后用ECL超敏发光液孵育,X射线胶片压片、显影、定影,透射扫描仪扫描X光片。
1.3.3 数据处理和统计分析
Western blotting结果用Bandscan 5.0软件分析。所得数据均以平均数±标准差表示,同一样本不同处理的结果用SPSS 16.0统计分析软件进行t检验,多组数据之间应用Duncan检验。P<0.05为统计学差异有显著性。
2 结 果
2.1 乳腺IGF-I及IGF-IR的定位
青春期奶牛乳腺发育的主要特征是导管发育。在发育良好的脂肪组织周围可见小团的导管。在导管腔上线状排列着一个两层上皮组织,它由近似方形的腔分泌细胞组成;导管腔上还有一个由肌上皮细胞组成的基底层。在导管间,围绕着导管上皮有一个3~4层的疏松结缔组织。IGF-I定位于青春期乳腺导管腔上皮细胞以及基质中(图1a)。IGF-IR显示了与IGF-I类似的定位(图1f)。
妊娠2个月时奶牛乳腺内导管分支大量增殖,腺泡芽大量形成;妊娠4个月至妊娠6个月,乳腺腺泡大小不一、形态各异,腺泡腔逐步扩大;围产期时大量的小叶腺泡发育完全,小叶间和腺叶间的结缔组织隔膜都伸长和变薄。IGF-I在围产期(图1c)、IGF-IR在妊娠期6个月表达较弱;在妊娠期的其他检测时点,IGFI与IGF-IR均定位于妊娠期乳腺导管腔上皮细胞、乳腺腺泡上皮细胞,以及基质中(图1b,图1 g~h)。
泌乳期乳腺小叶由大量具有张开腔结构的腺泡组成,这些腔状结构间被结缔组织分隔。在泌乳期,IGF-I与IGF-IR均定位于泌乳期乳腺腺泡上皮细胞以及基质中(图1d,图1i)。
退化30d,IGF-I与IGF-IR均微弱定位于小叶间基质(图1e,图1j)。
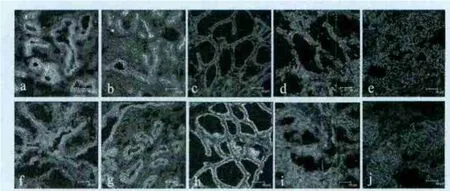
图1 奶牛不同发育时期乳腺IGF-I及IGF-IR的定位
2.2 乳腺IGF-I及IGF-IR的蛋白表达变化
奶牛不同发育时期乳腺IGF-I及IGF-IR的蛋白表达变化分别如图2和图3所示。

图2 奶牛不同发育时期乳腺IGF-I蛋白表达变化

图3 奶牛不同发育时期乳腺IGF-IR蛋白表达变化
将Western blotting结果扫描,用Bandscan5.0软件进行灰度统计和分析,奶牛不同发育时期乳腺IGF-I及IGF-IR蛋白的相对表达量如图4所示。
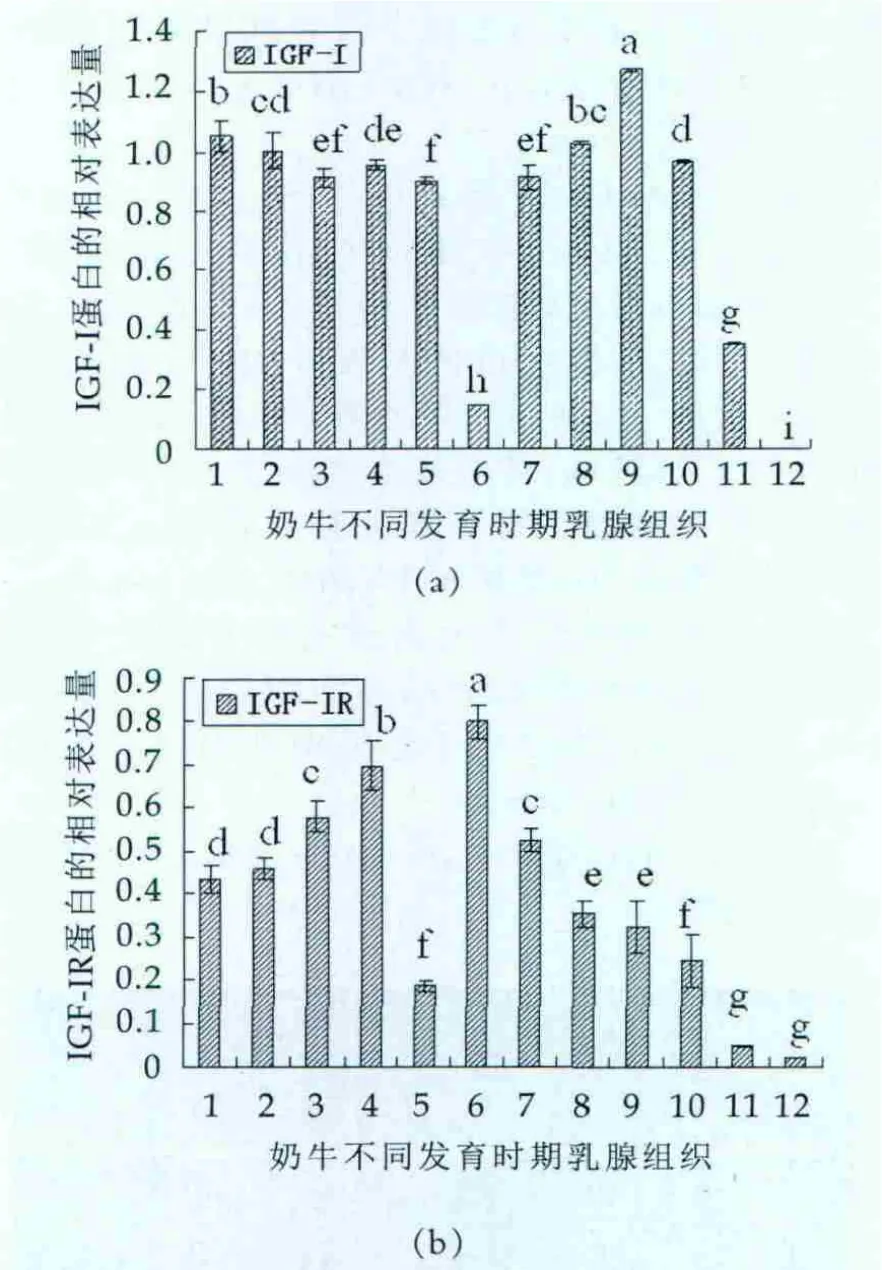
图4 奶牛不同发育时期乳腺IGF-I及IGF-IR蛋白的相对表达量
IGF-I在V12m时蛋白表达量较高,随后在V14m表达量显著下降(P<0.05);进入妊娠期,随乳腺发育IGF-I表达量持续下降,至围产前期达到最低值(P<0.05); 在泌乳期初期L7d,IGF-I表达量显著高于围产期(P<0.05),随后在泌乳期各检测时点IGF-I表达量持续升高,在L140d达到最大值(P<0.05),然后在L280d显著下降(P<0.05);进入退化期,IGF-I表达量继续下降,在I30d检测不到其蛋白表达(图4a)。
在青春期时IGF-IR蛋白表达量没有显著性差异(P>0.05);在妊娠初期(P2m)和中期(P4m),IGF-IR表达量显著升高(P<0.05),随后在P6m表达量突然显著下降(P<0.05);在围产前期IGF-IR表达量有一个显著且突然的升高,并达到最大值(P<0.05);进入泌乳期,IGF-IR表达量保持持续而显著的下降(P<0.05),这种下降一直维持到退化期;在退化期的2个检测时点,IGF-IR表达量持续下降但并无显著性差异(P>0.05),在I30达到最小值(图4b)。
3 讨 论
在乳腺中IGF-I由与乳腺相关联的基质细胞(如成纤维细胞以及脂肪细胞)合成,脂肪细胞对IGF-I的释放可被葡萄糖和脂肪酸调节[5]。IGF-I的主要生理学作用是刺激出生后身体生长[6],调节全身蛋白合成,调节组织周围的葡萄糖摄取和脂质代谢,以及细胞增殖[7-8]。在乳腺组织中,IGF-I与乳腺发育有关,能促进乳腺上皮细胞增殖,抑制其凋亡[9-10]。在泌乳晚期,IGF-I可能维持乳腺细胞数量,而不是直接刺激乳合成[11-13]。本研究结果表明,IGF-I蛋白表达量在泌乳期各检测时点持续升高,在L140d达到最大值,然后在L280d显著下降;这说明在乳汁形成及乳汁分泌过程中,局部IGF-I作用强。在泌乳晚期IGF-I蛋白表达下降,则可能是乳腺即将进入退化期内在调控的结果。
在小鼠青春期以及妊娠期诱导的乳腺发育过程中,IGF-IR在整个乳腺上皮组织表达。IGF-IR也在正常人乳腺组织表达[14-15]。IGF-IR对于正常青春期乳腺导管分枝以及末端乳芽增殖不可缺少[16]。Rowzee等(2009)研究结果表明,小鼠乳腺上皮细胞中的IGF-IR mRNA表达在妊娠早期达到峰值并在妊娠晚期下降[17],这与本研究中青春期及妊娠期IGF-IR的蛋白表达规律基本一致。有研究表明IGFs的存在对分化有抑制作用。因此妊娠末期乳腺上皮细胞中IGF-IR下降,可能与减慢生长,给细胞分化多提供一些机会有关。
牛乳腺组织在泌乳期基本都是由上皮细胞组成[18],因此IGF-IR在泌乳期表达量随乳生成呈现变化可能是上皮细胞数量改变的结果。本研究结果表明,进入泌乳期IGF-IR蛋白表达量持续下降;结合本研究泌乳期IGF-I蛋白表达先升后降的结果,说明在奶牛乳腺中IGF-I与IGF-IR结合并发挥作用时,可能还涉及其他的调控方式。
在奶牛不同发育时期,IGF-I和IGF-IR在奶牛乳腺中定位的一致性及其特异性表达规律,预示二者结合并参与了奶牛乳腺发育及泌乳的调控。IGF家族还有许多重要成员,各自具有复杂的生理功能。因此,奶牛不同发育时期乳腺中其他IGF家族成员的蛋白表达规律及彼此间的相互作用还有待深入研究。
[2]HADSELL D L,BONNETTE S G,LEE A V.Genetic Manipulation of the IGF-I Axis to Regulate Mammary Gland Development and Function[J].J Dairy Sci,2002(2):365-377.
[3]MARSHMAN E,STREULI C H.Insulin-like Growth Factors and Insulin-like Growth Factor Binding Protein in Mammary Gland Function[J].Breast Cancer Res,2002(4):231-239.
[4]KLEINBERG D L,WOOD T L,FURTH P A,et al.Growth Hormone and Insulin-like Growth Factor-I in the Transition From Normal Mammary Development to Preneoplastic Mammary Lesions[J].Endocr Rev,2009(1):51-74.
[5]D'ESPOSITO V,PASSARETTIF,HAMMARSTEDT A,etal.Adipocyte-released Insulin-like Growth Factor-1 is Regulated by Glucose and Fatty Acids and Controls Breast?Cancer Cell Growth in Vitro[J].Diabetologia,2012(10):2811-2822.
[6]LIU J P,BAKER J,PERKINS A S,et al.Mice Carrying Null Mutations of the Genes Encoding Insulin-like Growth Factor I(IGF-I)and Type I IGF Receptor(Igf1r)[J].Cell,1993(75):59-72.
[7]SJOGREN K,WALLENIUS K,LIU J L,et al.Liver-derived IGF-I is of Importance for Normal Carbohydrate and Lipid Metabolism[J].Diabetes,2001(50):1539-1545.
[8]YAKAR S,LIU J L,FERNANDEZ A M,et al.Liver-specific IGF-1 Gene Deletion Leads to Muscle Insulin Insensitivity[J].Diabetes,2001(5):1110-1118.
[9]GAJEWSKA M,ZIELNIOK K,DEBSKI B,et al.IGF-I Retards Proper Development of Acinar Structures Formed by Bovine?Mammary Epithelial Cells Via Sustained Activation of Akt Kinase[J].Domest Anim Endocrinol,2013(3):111-121.
[10]VALENTINIS B,REISS K,BASERGA R.Insulin-like Growth Factor-I-mediated Survival From Anoikis:Role of Cell Aggregation and Focal Adhesion Kinase[J].J Cell Physiol,1998(176):648-657.
[11]BURRIN D G,FIOROTTO M L,HADSELL D L.Transgenic Hypersecretion of Des(1-3)Human Insulin-like Growth Factor I in Mouse Milk Has Limited Effects on the Gastrointestinal Tract in Suckling Pups[J].J.Nutr,1999(129):51-56.
[12]WOLF E,JEHLE P M,WEBER M M,et al.Human Insulin-like Growth Factor I (IGF-I)Produced in the Mammary Glands of Transgenic Rabbits:Yield,Receptor Binding,Mitogenicactivity,and Effects on IGF-binding Proteins[J].Endocrinology,1997(138):307-313.
[13]HADSELL D L,ALEXEENKO T,KLEMINTIDIS Y K,et al.Inability of Overexpressed Des(1-3)hIGF-I to Inhibit Forced Mammary Gland Involution is Associated With Decreased Abundance of IGF Signaling Molecules[J].Endocrinology,2001(142):1479-1488.
[14]CARBONI J M,LEE A V,HADSELL D L,et al.Tumor Development by Transgenic Expression of a Constitutively Active Insulin-like Growth Factor I receptor[J].Cancer Res,2005(65):3781-3787.
[15]JONES R A,CAMPBELL C I,GUNTHER E J,et al.Transgenic Overexpression of IGF-IR Disrupts Mammary Ductal Morphogenesis and Induces Tumor Formation[J].Oncogene,2007(26):1636-1644.
[16]BONNETTE S G,HADSELL D L.Targeted Disruption of the IGFI Receptor Gene Decreases Cellular Proliferation in Mammary Terminal End Buds[J].Endocrinology,2001(142):4937-4945.
[17]ROWZEE A M,LUDWIG D L,WOOD T L.Insulin-like Growth Factor Type 1 Receptor and Insulin Receptor Isoform Expression and Signaling in Mammary Epithelial Cells[J].Endocrinology,2009(8):3611-3619.
[18]BAUMRUCKER C R,ERONDU N E.Insulin-like Growth Factor(IGF)System in the Bovine Mammary Gland and Milk[J].J Mammary Gland Biol Neoplasia.2000(1):53-64.

