利用复式PCR检测牛奶中掺杂的大豆源性成分
韩镌竹,苏崴艺,李欣南
(辽宁省兽药饲料畜产品质量安全检测中心,沈阳110016)
0 引 言
随着社会经济的高速发展人民生活水平日益提高,牛奶已经成为人们餐桌上必不可少的食物之一,随之产生的经济效益也越来越高。一些不法商贩为谋取暴利,在牛奶中违法添加有毒有害物质,掺假造假现象严重,牛奶的质量安全问题已经成为国内外研究的热点与重点[1-4]。由于大豆价格低廉,蛋白含量高,通用蛋白测定方法难以从牛奶中区分开[5],在牛奶中掺入大豆已成为掺假的主要手段之一。目前牛奶中掺杂植物蛋白的研究很少,有研究羊奶中掺杂的牛奶[6];荧光PCR方法实时检测牛奶中掺杂大豆成分[7]的实验等,但是复式PCR还是一个比较崭新的领域。复式PCR具有敏感、特异、快速等特点,检测大批样本效率较传统方法高数倍,成本低,可以更加准确的检测出牛奶中掺杂的大豆源性物质。
1 仪器与材料
1.1 仪器
CF16RX高速低温冷冻离心机,TC-512PCR仪,DYY-6C型电泳仪,170-8170型紫外凝胶成像系统,AL 104-IC电子天平。
1.2 试剂与材料
基因组DNA提取试剂盒,TritonX-100、异硫氰酸胍(分析纯),牛奶、豆浆粉(市售);试验所用引物均为南京金斯瑞生物科技有限公司合成,序列如表1所示。
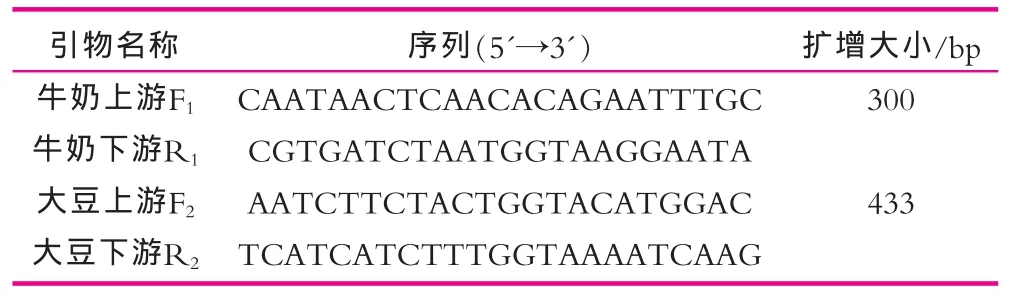
表1 引物序列
2 方 法
2.1 不同体积分数豆浆的牛奶的配制(是按照质量分数配置的豆浆牛奶)
准确称取3.0 g豆浆粉溶于30 mL温开水中,制成豆浆溶液,分别配制体积分数为3%,4%,5%,10%豆浆的牛奶。
2.2 牛奶和大豆的基因组DNA提取方法
2.2.1 热解法提取基因组DNA
分别取2.1制备样品10 mL于50 mL离心管中,4℃,4 000 r/mim离心10 mim,用棉签擦去管壁上的乳蛋白和乳脂,重复离心擦拭步骤3次。加入10 mL的PBS(8.0g NaCl+0.2g KCl+1.44g Na2HPO4+0.24 g KH2PO4定容至1 000 mL)重新悬浮,轻轻震荡,重复离心擦拭步骤一次。
分别取200 μL上述样品于1.5 mL的Eppendorf管中,加入440 μL TEN(1mL浓度1 mol/L的Tris+0.2 mL浓度0.5 mol/L的EDTA+0.5844 g的NaCl定容至100 mL)和60 μL 0.2 mol/L NaOH,剧烈振荡,直到沉淀完全悬浮,取600 μL上述裂解液置于1.5 mL Eppend orf管中,95℃水浴8 min,冷却后离心取上清液。加入等体积的氯仿/异戊醇(24∶1),混匀,4 ℃,12 000 r/min,离心10 min,取上清液。加入3 μL RNaseA,37℃水浴30 min。加入0.8倍体积异丙醇,-20℃沉淀30 min,70%乙醇洗涤沉淀,室温干燥10 min,加入30 μL TE(121.14 mg+37.224 mg EDTA,加HCl调pH至8.0,定容至100 mL)溶解,-20℃保存备用。
2.2.2 异硫氰酸胍法提取基因组DNA
从离心管中分别取200 μL 2.1制备样品于1.5 mL Eppendorf管中,加入400 μL异硫氰酸胍裂解液,混匀,室温放置10 min,加入等体积的酚/氯仿/异戊醇(25∶24∶1),充分混匀,12 000 r/min离心10 min。 取上清,加入0.8倍体积异丙醇,-20℃沉淀30 min,12 000 r/min离心10 min,弃上清,用体积分数为70%乙醇洗涤沉淀,室温干燥20 min,加入30 μL TE溶解,-20 ℃保存备用。
2.2.3 基因组DNA提取试剂盒法
用棉签沾取样品于2 mL离心管中,加入400 μL的Buffer GR。 加入20 μL Proteinase K和400 μL Buffer GL,立即涡旋震荡15 s,充分混匀,56℃水浴10 min,短暂离心,使管壁上的溶液收集到管底。
将上步所得溶液和沉淀分两次加入到已装入收集管的吸附柱中,一次最多不超过700 μL。8 000 r/min离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。向吸附柱中加入500 μL Buffer GW1,8 000 r/min离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。向吸附柱中加入500 μL Buffer GW2,14 000 r/min离心3 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
14 000 r/min离心1 min,倒掉收集管中的废液。将吸附柱置于室温数分钟,干燥处理。将吸附柱置于一个1.5 mL的新离心管中,向吸附柱的中间部位悬空加入50 μL Buffer GE, 室温放置2~5 min,8 000 r/min离心1 min,收集DNA溶液,-20℃保存。
2.2.4 热解-异硫氰酸胍联用法提取基因组DNA
取10 mL 2.1制备样品于离心管中,4℃,4 000 r/mim离心10 min,用棉签擦去管壁上的乳蛋白和乳脂,重复离心擦拭步骤三次。加入10 mLPBS重新悬浮,轻轻震荡,重复离心擦拭步骤一次。
分别取200 μL样品于1.5 mL Eppendorf管中,加入400 μL异硫氰酸胍裂解液,混匀,室温放置10 min,加入等体积的酚/氯仿/异戊醇(25∶24∶1),充分混匀,12 000 r/min离心10 min。取上清,加入0.8倍体积异丙醇,-20 ℃沉淀30 min,12 000 r/min离心10 min,弃上清,70%乙醇洗涤沉淀,室温干燥20 min,加入30 μL TE溶解,-20℃保存备用。
2.3 复式PCR反应及检测
20 μL反应体系中含10 μL 2×Taq PCR Master Mix,引物( 浓度为20 μmol/L)0.5 μL, 模板2 μL, 双蒸水至20 μL。 反应条件:95℃预变性3 min;94℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s;25个循环;72 ℃再延伸5 min。 取10 μL PCR 产物,2.0%琼脂糖凝胶110 V电泳40 min,凝胶成像系统记录结果。
3 实验结果
3.1 热解法提取结果
采用热解法提取样品中基因组DNA,结果经2.0%琼脂糖凝胶电泳,如图1中所示。由图1可以看出,泳道1在300 bp左右出现一条目的条带,由此可以证明已提取牛奶基因组;而泳道2、3、4号上均没有出现300 bp和433 bp目的条带,说明没有提取出相应的基因组,推测是大豆的存在干扰了牛奶基因组的检测。由此可见,该方法不适于对牛奶和大豆基因组DNA的提取。

图1 热解法凝胶电泳结果
3.2 异硫氰酸胍法提取结果
图2为异硫氰酸胍法扩增产物凝胶电泳结果。由图2中可以看出,大豆基因组提取效果良好,但牛奶基因组提取量不足,甚至无法检出。
3.3 试剂盒法提取结果
图3为试剂盒法扩增产物凝胶电泳结果。由图3可以看出,牛奶和大豆基因组均未提出,说明该方法不适用于提取牛奶和大豆基因组提取。
3.4 热解-异硫氰酸胍联用法提取结果
图4为热解-异硫氰酸胍联用法扩增产物凝胶电泳结果。由图4可以看出,该方法对牛奶和大豆的基因组提取效果都非常好,随着大豆浓度的递增各扩增带逐渐增强,检出限为3%豆浆掺入量,针对豆浆掺入量大于5%以上才能达到盈利的目的[8],本方法可完全达到检测要求。

图2 异硫氰酸胍法电泳结果

图3 试剂盒法凝胶电泳结果

图4 热解-异硫氰酸胍联用法凝胶电泳结果
3.5 实际样品测定
用本方法对20份牛奶进行了检测,按2.2.4中方法操作,制备样品,在2.3条件下进样PCR,电泳。各样品中均未检出大豆源性物质,说明测定的20份牛奶品质较好。
4 讨 论
4.1 复式PCR方法的确定
复式PCR是在传统PCR基础上同时扩增两种DNA片段,能同时检测出两种物质的存在。复式PCR是对传统的PCR技术进行改进,建立并完善PCR步骤,通过正交试验设计,对退火温度、琼脂糖凝胶浓度和电泳电压3个因素进行3水平的优化,最终确定最佳的条件,进一步确定检测的可能性。因此,本实验建立的复式PCR检测系统,易于操作、稳定性好、准确性高、适于推广,可用于牛奶中掺杂大豆源性成分的检测。
4.2 牛奶与豆浆基因组提取效果
如图4中泳道3,4,5,6所示:433 bp处目的条带明显比300 bp产物含量高,表明该法提取大豆的基因组含量比牛奶高。分析这一现象的原因,主要是异硫氰酸胍的作用,相关文献表明异硫氰酸胍法主要是针对大豆基因组DNA提取的。因此,当使用该法同时提取牛奶和大豆基因组时,牛奶的基因组提取量要少于大豆的基因组提取量。
4.3 基因组提取方法的选择
本研究主要研究采用热解法、异硫氰酸胍法、基因组DNA提取试剂盒法及热解法-异硫氰酸胍联合法四种方法提取牛奶和大豆中基因组DNA,设计引物,通过复试PCR方法获取目的基因片段,比较四种方法对于牛奶中掺有大豆源提取基因组DNA的灵敏度。结果发现,热解法仅可提取少许牛奶基因组,异硫氰酸胍法则只能提取大豆基因组,而基因组DNA提取试剂盒法则没有提取出牛奶和大豆基因组。分析原因可能是牛奶和大豆是两种不同来源的蛋白质,大豆是属于植物源性蛋白;牛奶是属于动物源性蛋白,并且脂肪含量极高。热解法是针对动物源性蛋白提取的方法,异硫氰酸胍法无法去除乳蛋白和乳脂,针对这种情况,本研究采用热解法-异硫氰酸胍联合法,与其他三种方法比较,该法能够有效的提取牛奶及其掺杂的大豆源成分的基因组DNA,结果准确,方便操作。
[1]RODRIGUES N P,GIVISIEZ P E,QUEIROGA R C.Milk adulteration:Detection of bovine milk in bulk goat milk produced by smallholders in northeastern Brazil by a duplex PCR assay[J].J.Dairy Sci.,2012,95(5):2749-2752.
[2]李喆,王诗哲,吴也平.牛奶掺假检验试纸的研制-碱,食盐检测试纸[J].高师理科学刊,2004,24(2):38-40.
[3]KAROUI R,DUFOUR E,PILLONEL L,et al.Fluorescence and infrared spectroscopies:a tool for the determination of the geographic origin of Emmental cheeses manufactured during summer[J].Le Lait,2004,84(4):359-374.
[4]丁伟,黄素珍,李绪英.牛奶掺假快速检测方法的研究[J].山西农业大学学报,1994,14(1):4-7.
[5]GB/T 5009.5-1985食品中蛋白质的测定方法:凯氏定氮法[P].北京:中国标准出版社,1985.
[6]RODRIGUES N P,GIVISIEZ P E,QUEIROGA R C.Milk adulteration:Detection of bovine milk in bulk goat milk produced by smallholders in northeastern Brazil by a duplex PCR assay[J].Journal of dairy science.2012,95(5):2749-2752.
[7]岳巧云,陈定虎,伍朝晖,等.实时荧光PCR在鉴别奶粉中掺入大豆成分的应用研究[J].食品科学,2009,30(12):190-193.

