以Triton X-100处理重组E.coli制备重组人SOD 包涵体
刘建荣,顾雅君
(1.河北大学 生物技术研究中心,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002;3.河北大学 生命科学学院,河北 保定 071002)
破碎重组大肠杆菌(E.coli)提取包涵体蛋白,实验室中普遍使用超声破菌法[1-4],但处理量较小.工业上大规模生产时多采用机械法[5-6],如高压匀浆法[7]和珠磨法[8],但需配套使用相应的仪器设备,并且价格昂贵.化学渗透破菌法常用于胞内可溶性蛋白的释放[7].非离子表面活性剂Triton X-100对疏水性物质具有很强的亲和力,作用于细胞时可以改变细胞的通透性,使内含物得以释放.为降低成本,简化操作,本实验对采用Triton X-100处理重组E.coli释放并制备重组人超氧化物歧化酶rhSOD(recombinant human SOD)包涵体进行初探,并对提取的包涵体进行了体外复性.
1 材料与方法
1.1 材料与仪器
菌种为含重组质粒pTK-rhSOD的大肠杆菌DH5α(本研究室构建).氧化型(GSSG)和还原型谷胱甘肽(GSH)(TaKaRa公司),β-巯基乙醇(β-ME)(Serva公司),三羟甲基氨基甲烷(Tris)(Amresco公司,进口分装),Triton X-100(上海生物工程公司),邻苯三酚和尿素等均为国产分析纯试剂.Model 250/2.5型电泳仪(Bio-Rad公司),WFJ 2100型可见分光光度计(尤尼克上海仪器有限公司),WD-9413B 凝胶成像分析系统(北京六一仪器厂).
1.2 方法
1.2.1 种子液、摇瓶发酵培养及表达产物的检测
参照文献[9]进行.
1.2.2 TritonX-100处理重组E.coli及包涵体的纯化(Triton法)
取100mL 发 酵 液 菌 体 按 体 积 比10:1悬 浮 于10 mL 破 菌 缓 冲 液 中(0.05 mol/L Tris·HCl,0.15mol/L NaCl,体 积 分 数0.5% 的Triton X-100,pH 7.5),以 旋 涡 振 荡 器 混 匀,室 温 静 置 过 夜,8 000r/min离心10min,沉淀为包涵体粗提物.用洗涤缓冲液(含0.5mol/L 尿素的破菌缓冲液)将粗提物洗涤2次后,离心后的沉淀再以0.05mol/L Tris-HCl(含0.15mol/L NaCl,pH7.5)缓冲液洗涤1次,得TritonX-100处理的纯化包涵体.
1.2.3 超声波破碎重组E.coli和包涵体的纯化(超声法)
另取100mL发酵液菌体按体积比10:1悬浮于10mL 的0.05mol/L Tris-HCl(含0.15mol/L NaCl,pH7.5)缓冲液中,冰水浴下超声(功率80W)处理10min,离心得超声破菌包涵体粗提物.洗涤过程同上,得超声波处理的纯化包涵体,用作对照.
1.2.4 包涵体的变性溶解
分别以4mL溶解缓冲液(0.05mol/L Tris·HCl,8mol/L 尿素,0.1mol/Lβ-巯基乙醇,0.15mol/L NaCl,pH 7.5)溶解上述2种方法制备的包涵体,室温静置过夜,8 000r/min离心30min去沉淀,上清液即为包涵体溶解液,留待复性.
1.2.5 包涵体的复性
采用透析法复性rhSOD 包涵体.将上述2种方法制备的包涵体溶解液平行进行如下操作:
1)透析:将包涵体溶解液装入透析袋,先对100mL 透析缓冲液Ⅰ(0.05mol/L Tris·HCl,1mol/L 尿素,2mmol/L GSH,0.5mmol/L GSSG,pH 7.5)于4 ℃透析24h后(期间数次摇动透析液),透析样品于8 000r/min离心30 min,沉淀留样行SDS-PAGE;将上清液装入透析袋继续对100 mL 透析缓冲液Ⅱ(0.05mol/L Tris·HCl,0.1mol/L尿素,pH 7.5)于4 ℃透析24h(期间数次摇动透析液),透析样品同上离心后,沉淀留样电泳,上清液测定蛋白含量.
2)复性:将透析后的离心上清液以透析缓冲液Ⅱ稀释为0.5mg/mL,补加终浓度为50μmol/L 的Cu2+和5μmol/L的Zn2+,于4 ℃静置复性,分别于2,4,6,8,24,48h取样测定活性和蛋白浓度.样品在复性一段时间后若有沉淀物析出,取样于8 000r/min离心10min,测上清液蛋白含量及活性,计算单位活力及比活,沉淀留样电泳.
1.2.6 分析方法
考马斯亮蓝染色法(Bradford法)测定蛋白质浓度,终止剂改进的邻苯三酚自氧化法(终止剂法)[10]测定rhSOD 活性,纯化的包涵体、透析和复性期间产生的沉淀物和复性样品纯度分析采用120g/L SDS-PAGE,WD-9413B凝胶成像分析系统扫描凝胶,以蛋白含量分析软件gel-pro 32测定目的蛋白纯度.
2 结果与分析
2.1 表达产物和纯化包涵体的电泳分析
对菌体表达产物和纯化包涵体的SDS-PAGE分析结果见图1.rhSOD 包涵体的表达量约占菌体总蛋白的30%左右,以Triton X-100处理(以下简称Triton法)得到的包涵体纯度(泳道3)低于超声破菌法(以下简称超声法,泳道2),但经8mol/L尿素溶解且离心后,Triton法的(泳道5)却与超声法(泳道4)相近,均为65%左右.这是由于Triton法制备的包涵体经8mol/L尿素变性溶解后的离心沉淀物中含有大量不被尿素所溶解的杂蛋白的去除所致(泳道7).

图1 纯化rhSOD包涵体的SDS-PAGE图谱Fig.1 SDS-PAGE analysis of purified rhSOD inclusion body
2.2 包涵体的复性
包涵体复性结果如表1所示.随着复性时间的延长,单位活力逐渐增加,6h后基本稳定,超过24h后略有下降.复性过程中随着蛋白的析出,复性液蛋白含量随复性时间延长而降低,但比活却呈现增加趋势.复性48h时,Triton法和超声法所得样品比活接近,均达2 800U/mg蛋白以上.
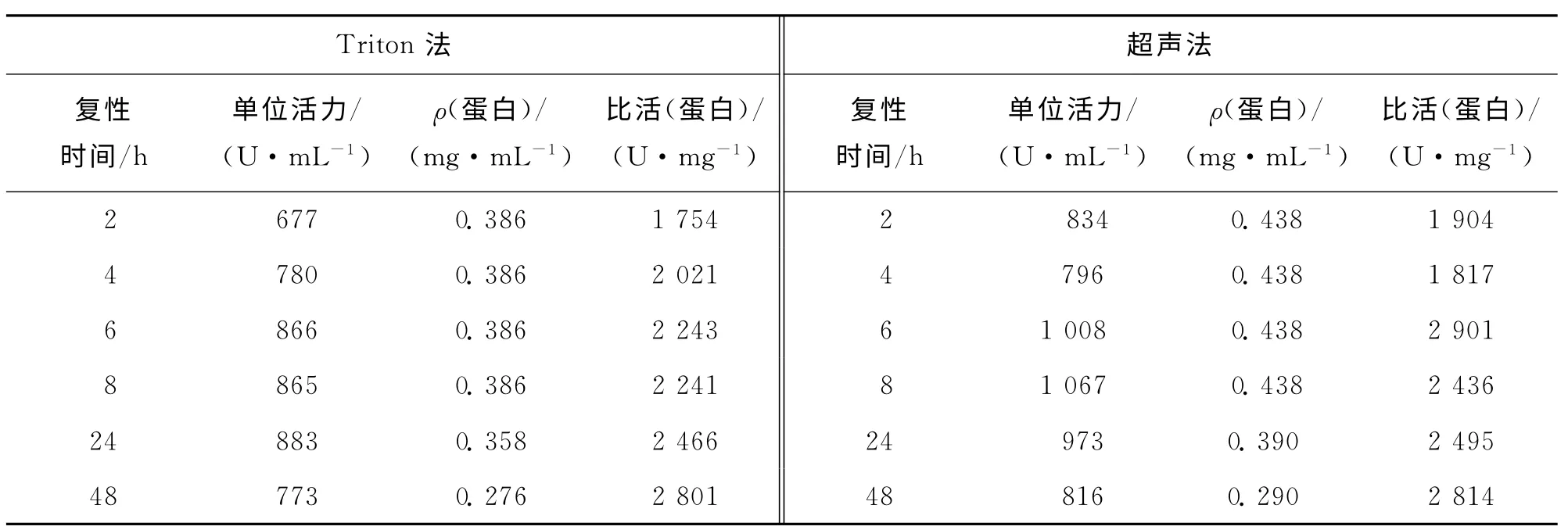
表1 rhSOD包涵体的复性结果Tab.1 Result of renaturation of rhSOD inclusion body
2.3 对透析和复性过程中析出沉淀物的检测及复性rhSOD 纯度检测
包涵体溶解液在透析和随后的复性过程中,一些蛋白会呈絮状聚集析出,对这些沉淀和复性rhSOD 的电泳结果如图2所示.2次透析产生的沉淀中虽含有rhSOD,但与析出的杂蛋白比例相比,rhSOD 只占较少部分,多数为杂蛋白.在复性过程中仍有杂蛋白继续析出,且布满整个泳道,但目的蛋白rhSOD 却没有析出.分别使用Triton 法和超声法制备的rhSOD 包涵体,不论在透析还是复性过程中,杂蛋白析出量始终前者大于后者.因此,Triton 法最终所得到的目的蛋白纯度与超声法相近,2种方法均达90% 以上.
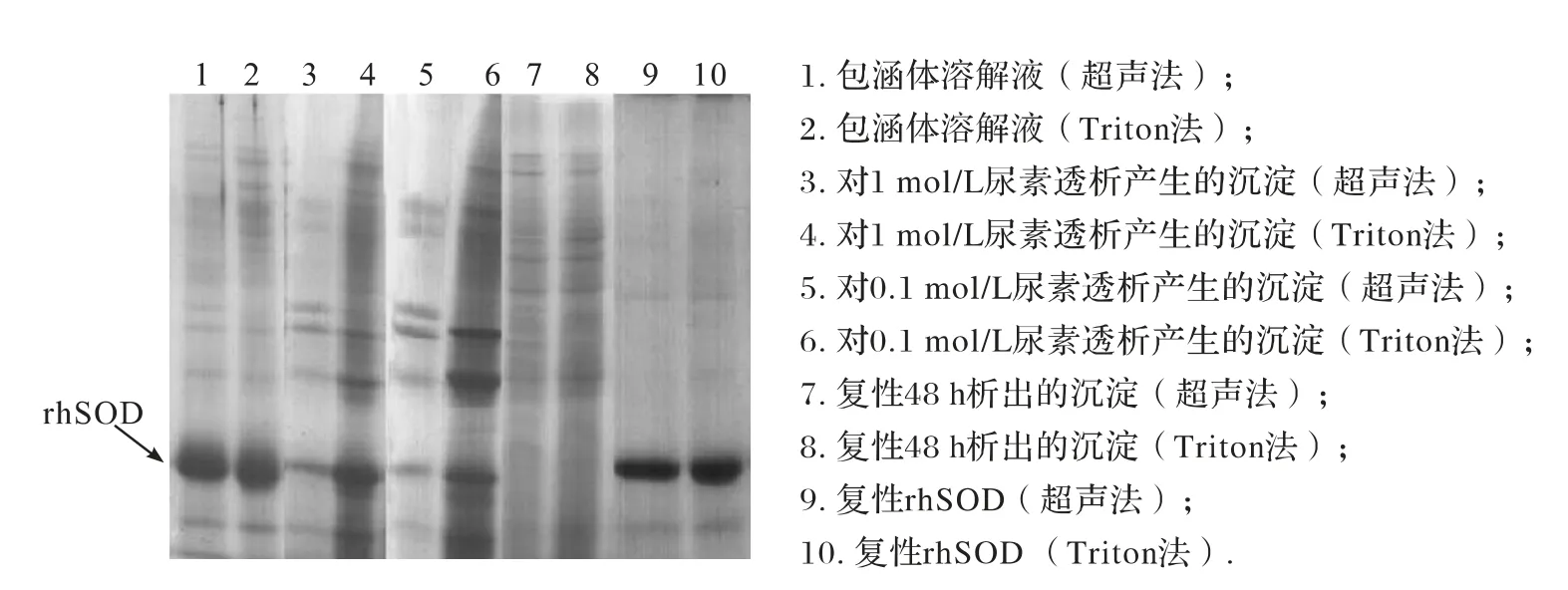
图2 包涵体溶解液透析和复性过程中析出的沉淀物和复性rhSOD的SDS-PAGE图谱Fig.2 SDS-PAGE analysis of renaturaed rhSOD and precipitate separated from dialysis and renaturation
3 讨论
本实验以Triton X-100处理重组E.coli提取制备rhSOD 包涵体,最终包涵体溶解液纯度与实验室常规使用的超声破菌法相近,其中关键一步是,包涵体以含8mol/L尿素的溶解缓冲液变性溶解后,充分放置,离心去除的杂质中含有大量未溶解的杂蛋白(图1,泳道7),对包涵体溶解液纯度的提高起到重要作用.实验中还发现,溶解后的包涵体溶解液在对1mol/L尤其0.1mol/L尿素透析时,以及在补加Cu2+和Zn2+复性过程中,均有蛋白沉淀析出.经电泳检测,除少量目的蛋白析出外,杂蛋白占有的比例远大于目的蛋白.因此,在单位活力不变的情况下使比活再次得到提高.
复性后的rhSOD 纯度达90%以上,比活为2 801U/mg蛋白,原因可能是一部分包涵体在复性过程中,Cu2+没有结合于酶活性中心而不能表现出活性,但却以可溶性的折叠中间体状态与复性的rhSOD 共存.对复性rhSOD 以金属螯合亲和层析可使其进一步纯化和复性[11].
采用Triton法处理重组E.coli提取的rhSOD 包涵体,经体外复性后比活与超声法相近.与机械破菌法相比,以Triton X-100处理重组E.coli提取制备包涵体的方法无需使用昂贵特殊仪器设备破碎菌体,简单实用,成本低廉,非常易于放大规模生产.
[1] 张拓宇,董海龙,董晓燕.渗透剂与人工伴侣耦合辅助苹果酸脱氢酶包涵体的复性[J].化工学报,2008,59(4):988-994.ZHANG Tuoyu,DONG Hailong,DONG Xiaoyan.Cooperation of osmolytes and artificial chaperone on malate dehydrogenase refolding[J].Journal of Chemical Industry and Engineering,2008,59(4):988-994.
[2] 陈宇萍,乔媛媛,解鹏,等.抗RBC/HBsAg ds-diabody包涵体复性条件的优化[J].中国生物制品学杂志,2010,23(9):1005-1008.CHEN Yuping,QIAO Yuanyuan,XIE Peng,et al.Optimization of condition for refolding of Anti-RBC/HBsAg ds-diabody inclusion body[J].Chin J Biologicals September,2010,23(9):1005-1008.
[3] 马明飞,李树金,金凤燮,等.人参皂苷葡萄糖苷酶基因在大肠杆菌中的表达及包涵体的变复性[J].大连工业大学学报,2012,31(1):8-11.MA Mingfei,LI Shujin,JIN Fengxie,et al.Expression of ginsenoside glucosidase gene in E.coli and renaturation of inclusion body[J].Journal of Dalian Polytechnic University,2012,31(1):8-11.
[4] 付元芳,卢曾军,曹轶梅,等.口蹄疫病毒非结构蛋白3A、3B和2C 基因的表达及产物纯化与活性检测[J].微生物学报,2008,48(6):790-795.FU Yuanfang,LU Zengjun,CAO Yimei,et al.Purification and reactivity of foot-and-mouth disease virus non-structural dprotein 3A,3Band 2Cexpressed in E.coli[J].Acta Microbiologica Sinica,2008,48(6):790-795.
[5] 修志龙,姜炜,苏志国.细胞破碎技术的研究进展和发展方向[J].化工进展,1994(1):15-21.XIU Zhilong,JIANG Wei,SU Zhiguo.Achievement and future trends on disintegration of microbial cells[J].Chemical Industry and Engineering Progress,1994(1):15-21.
[6] 梁蕊芳,徐龙,岳明强.细胞破碎技术应用研究进展[J].内蒙古农业科技,2013(1):113-114.LIANG Ruifang,XU Long,YUE Mingqiang.Summarize of cell disruption technique and application[J].Inner Mongolia Agricultural Science and Technology,2013(1):113-114.
[7] 吴蕾,洪建辉,甘一如,等.高压匀浆破碎释放重组大肠杆菌提取包涵体过程的研究[J].高校化学工程学报,2001,15(2):191-194.WU Lei,HONG Jianhui,GAN Yiru,et al.Study on recombinant E.Coli by disruption in a high pressure homogenizer[J].Journal of Chemical Engineering of Chinese Universities,2001,15(2):191-194.
[8] 童海宝.珠磨匀浆细胞破碎技术[J].精细与专用化妆品,2001,21:24-25.TONG Haibao.Technology of refining cell disruption with bead grinding[J].Fine and Specialty Chemicals,2001,21:24-25.
[9] 刘建荣,赵晓瑜,步得志,等.重组人超氧化物歧化酶包涵体的复性和纯化[J].中国医药工业杂志,2008,39(6):417-420.LIU Jianrong,ZHAO Xiaoyu,BU Dezhi,et al.Renaturation and purification of inclusion body of recombinant human superoxide dismutase[J].Chinese Journal of Pharmaceuticals,2008,39(6):417-420.
[10] 静天玉,赵晓瑜.用终止剂改进超氧化物歧化酶邻苯三酚测活法[J].生物化学与生物物理进展,1995,22(1):84-86.JING Tianyu,ZHAO Xiaoyu.The improved pyrogallol method by using terminating agent for superoxide dismutase measurement[J].Progress in Biochemistry and Biophysics,1995,22(1):84-86.
[11] 刘建荣,刘建国,赵晓瑜,等.金属螯合亲和层析纯化和复性重组人铜锌超氧化物歧化酶[J].生物工程学报,2005,21(6):993-997.LIU Jianrong,LIU Jianguo,ZHAO Xiaoyu,et al.Purification and renaturation of recombinant human Cu,Zn-SOD by metal chelating affinity chromatography[J].Chinese Journal of Biotechnology,2005,21(6):993-997.

