云南牛肝菌的内生真菌分离、鉴定和ITS序列特征研究
岳万松,熊 勇,2,陈毅坚,2,*
(1.云南民族大学化学与生物技术学院,云南昆明 650500;2.国家民委—教育部共建民族药资源化学重点实验室,云南昆明 650500)
牛肝菌科(Boletaceae)是担子菌亚门伞菌目的重要一科。云南是野生食用菌的王国,目前已知牛肝菌有224种,食用菌144种,分别占全国总数的62%和72%。牛肝菌含有多糖、生物碱、甾醇类化合物、酸类化合物等活性物质,可用于治疗腰腿疼痛、手足麻木、四肢抽搐等疾病,还具有抗流感病毒、防治感冒的作用[1]。在云南产量多、味道鲜美、又具经济价值的有4种:小美牛肝菌(地方名见手青)[Boletus speciosus Frost]、铜色牛肝菌(地方名黑牛肝)[Boletus aereus]、黄皮疣柄牛肝菌(地方名黄牛肝、黄癞头)[Leccinum crocipodium]、美味牛肝菌(地方名白牛肝)[Boletus edulis][2]。至今,牛肝菌除个别种据报道在实验室条件下栽培成功[3-6],绝大多数种类尚不能通过人工栽培形成子实体[7-8]。目前有关野生食用牛肝菌的研究主要集中在其营养成分分析[9-10]和化学成分分析[11-12],此外,多篇文献[13-15]对牛肝菌活性物质多糖的免疫、抗肿瘤及抗氧化作用进行了研究分析。
内生真菌定殖于健康的生物组织内,种类繁多,分布广泛[16]。近年来,内生真菌的代谢产物的研究倍受关注,大量具有抗菌、抗癌、杀虫等活性的次生代谢产物从内生真菌中分离出来[17-19],内生真菌已经成为开发活性物质资源库。目前国内外对大型真菌的内生真菌方面的研究甚少,仍需进一步研究。本文以产自云南的牛肝菌不同种为材料,分离、纯化其内生真菌并进行形态特征研究,再结合rDNA ITS序列分析进行分子鉴定,确定内生菌株的种属归类,旨在为牛肝菌内生真菌资源的开发利用提供研究基础资料。
1 材料与方法
1.1 材料与仪器
牛肝菌 实验用新鲜牛肝菌子实体小美牛肝菌(地方名见手青)、铜色牛肝菌(地方名黑牛肝)、黄皮疣柄牛肝菌(地方名黄牛肝、黄癞头)、美味牛肝菌(地方名白牛肝),均于2013年8~9月分别购自云南省玉溪市和曲靖市集贸市场,新鲜子实体用保鲜袋包装带回实验室,24h内完成内生真菌的分离;引物ITS4、ITS5和 DNA MarKer 北京博迈德生物;2×Power Taq PCR MasterMix 北京百泰克;分离培养基 配制根据参考文献[20]完成;固体培养基Ⅱ KH2PO40.5g,MgSO40.25g,酒石酸铵 1g,麦芽糖 0.25g,维生素B1 0.5mL(40μg/L),葡萄糖 10g,琼脂粉 10g,蒸馏水500mL(pH6.0),121℃,灭菌 20min 后备用;液体培养基Ⅱ 配方同上,勿加琼脂粉。
Eppedorf 5331 PCR仪 德国;GENE GENIUS凝胶成像系统 美国;DYY-GB电泳仪、DYCP-31DN电泳槽 北京六一。
1.2 实验方法
1.2.1 牛肝菌内生真菌的分离纯化培养 取新鲜的牛肝菌子实体,自来水冲洗数次,去除表面杂质,无菌水冲洗3遍,75%乙醇漂洗3min,再用无菌水冲洗3~5次。用无菌解剖刀将牛肝菌子实体的表皮去掉,将内部的组织切割成0.5cm左右的小块,接种于培养基中,28℃恒温培养5~7d。待组织小块周围有内生真菌长出后,挑取少许菌丝培养物,纯化培养后,部分转接至固体培养基Ⅱ斜面上保存备用;另一部分转接至液体培养基Ⅱ里(培养条件为:150r/min,28℃恒温培养3~4d),每12h观察菌种生长情况,最后用无菌滤纸过滤得到菌丝体,存于-70℃冰箱里待用。
1.2.2 牛肝菌内生真菌菌落特征和显微特征观察 将分离纯化得到的牛肝菌内生真菌菌株于培养基Ⅱ平板上三点种植和插片培养5~7d,菌落长出后用于观察,插片置于显微镜下观察显微形态特征,对菌株进行初步鉴定。
1.2.3 牛肝菌内生真菌分子鉴定
1.2.3.1 DNA提取 将分离的牛肝菌内生真菌液体培养获得的菌丝体用于提取DNA,总DNA提取方法参照 CTAB-SDS 法[21-22]并加以改良,用琼脂糖凝胶电泳检测样品DNA质量。
1.2.3.2 PCR 扩 增、测 序 ITS 通 用 引 物 (ITS4:TCCTCCGCTTATTGATATGC;ITS5:GGAAGTAAAA GTCGTA-ACAAGG)[23],50μL 反应体系包括:25μL 2 ×Power Taq PCR Mixture,引物各2μL,5μL DNA 模板,16μL ddH2O;反应条件:预变性 94℃ 5min,94℃30s,52℃ 30s,72℃ 30s,35 次循环,72℃ 10min,4℃保存。扩增产物用1.5%琼脂糖凝胶电泳分离,采用Bio-Rad凝胶成像系统观察结果。
1.2.3.3 PCR 产物的纯化、测序及系统发育树的构建PCR产物用多功能DNA纯化回收试剂盒回收,送昆明硕阳科技有限公司测序。测序结果DNAMAN进行拼接,MEGA 5.13分析相关数据,构建发育树,同时将得到的序列提交GenBank数据库,并通过在线Blast工具从NCBI下载GenBank等数据库内已知同源序列多条作为参考序列,用 MEGA 5.13中的Kimura-2-parameter(K2P)模型,邻接(neighborjoining method,N-J)法构建聚类图。并应用 DNA STAR和RNAVIZ2.0预测其二级结构。
2 结果与分析
2.1 牛肝菌内生真菌的形态特征
从4种新鲜牛肝菌子实体内部组织块中分离培养获得5株内生真菌纯菌株,编号为YX1-6、YX1-7、QJ3-6、QJ3-7、QJ3-8,5 株内生真菌的菌落特征和显微特征见图1,特征描述记录和初步鉴定结果见表1(鉴定结果参考中国科学院微生物研究所编写的《常见与常用真菌》完成[24])
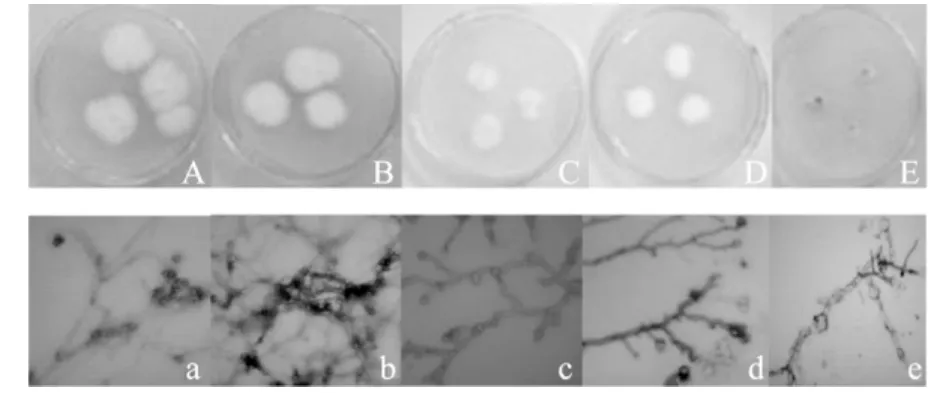
图1 牛肝菌内生真菌 YX1-6、YX1-7、QJ3-6、QJ3-7、QJ3-8在培养基Ⅱ上的生长特征Fig.1 Morphology and hyphal structure of YX1-6,YX1-7,QJ3-6,QJ3-7 and QJ3-8 isolated from boletus
2.2 不同牛肝菌内生真菌菌株ITS序列PCR扩增结果
分离获得的牛肝菌5株内生真菌的PCR扩增结果见图2。
从图2可见,5株菌序列长度约在430~630bp之间,PCR产物均出现比Marker清晰明显的条带,说明实验所提的DNA质量较好。
2.3 牛肝菌内生真菌rDNA ITS序列NJ树构建及分析
分离到的内生真菌分成5组:YX1-6、YX1-7、QJ3-6、QJ3-7和 QJ3-8 分别各为 1 组,做序列相似性比对并构建系统发育树以NCBI中的ITS序列为聚类外群,采用N-J法对不同牛肝菌内生真菌进行分析并构建遗传关系树,自举检测1000次。所构建的系统树见(图3)。

表1 牛肝菌内生真菌特征记录和初步鉴定结果Table 1 The preliminary identification results endophytic fungi from boletus
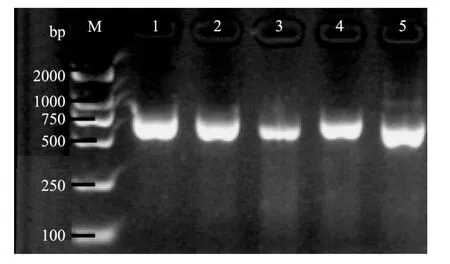
图2 5株牛肝菌内生真菌菌株ITS-PCR扩增电泳图Fig.2 Amplification profile of electrophoretogram ITS-PCR of 5 strains of boletus endophyte
通过在线BLAST工具从NCBI数据库内下载已知的多条相似序列作为参考序列,比较它们的相似性,并用 MEGA 5.13 中的 Kimura-2-parameter(K2P)模型,邻接(neighbor-joining method,N-J)法构建发育树(见图3),NJ发育树分析结果表明:YX1-6与NCBI数据库里的多株Trametes hirsuta形成自检支持率为99%的一个分支,它们亲缘关系较近,且BLAST比对结果显示:YX1-6与Trametes hirsuta相似性都很高,为99%,鉴定为毛栓菌(Trametes hirsuta)。NJ发育树分析结果表明:YX1-7与NCBI库里的多株Chaetomium aureum形成自检支持率为99%的一个大分支,二者亲缘关系很近,且BLAST比对结果显示:YX1-7与多株Chaetomium aureum相似性较高,为99%,鉴定为金色毛壳菌(Chaetomium aureum)。NJ发育树分析结果表明:QJ3-6菌株与Candida sp(DQ104728)、Candida sp(KF057545)、Candida sp(KF057544)等假丝酵母属菌株形成自检支持率为100%的一个分支,它们的亲缘关系较近,且BLAST比对结果显示:QJ3-6菌株与多株Candida sp相似性高达99%,鉴定为假丝酵母属真菌(Candida sp)。NJ发育树分析结果表明:QJ3-7菌株与多株Mortierella sp形成自检支持率为100%的一个分支,亲缘关系较近,且 BLAST比对结果显示:QJ3-7菌株与Mortierella sp(KC180749)相似性高达100%,鉴定为被孢霉属菌株。NJ发育树分析结果表明:菌株QJ3-8与Eurotium amstelodami多株菌株形成自检支持率为96%的一个分支,亲缘关系较近,且BLAST比对结果显示:QJ3-8与Eurotium amstelodami(AF455470)、Eurotium amstelodami(HQ728257)和Eurotium rubrum(AF455528)等多株散囊菌属菌株的的相似性都高达100%,鉴定为散囊属真菌。
2.4 牛肝菌内生真菌及其NCBI数据库相似种ITS rRNA二级结构比较
利用DNA STAR和RNAVIZ2.0预测并比较牛肝菌内生真菌及其NCBI数据库相似种的二级结构,牛肝菌内生真菌及其NCBI数据库相似种编号分别为YX1-6和Trametes hirsuta(JN048768、YX1-7和Chaetomium aureum(HQ607894)、QJ3-6 和Candidasp(DQ104728)、Mortierellasp(FJ810149)、Eurotium amstelodami(HQ728257),5株牛肝菌内生真菌及其NCBI数据库相似种ITS rRNA二级结构异同点见表2。
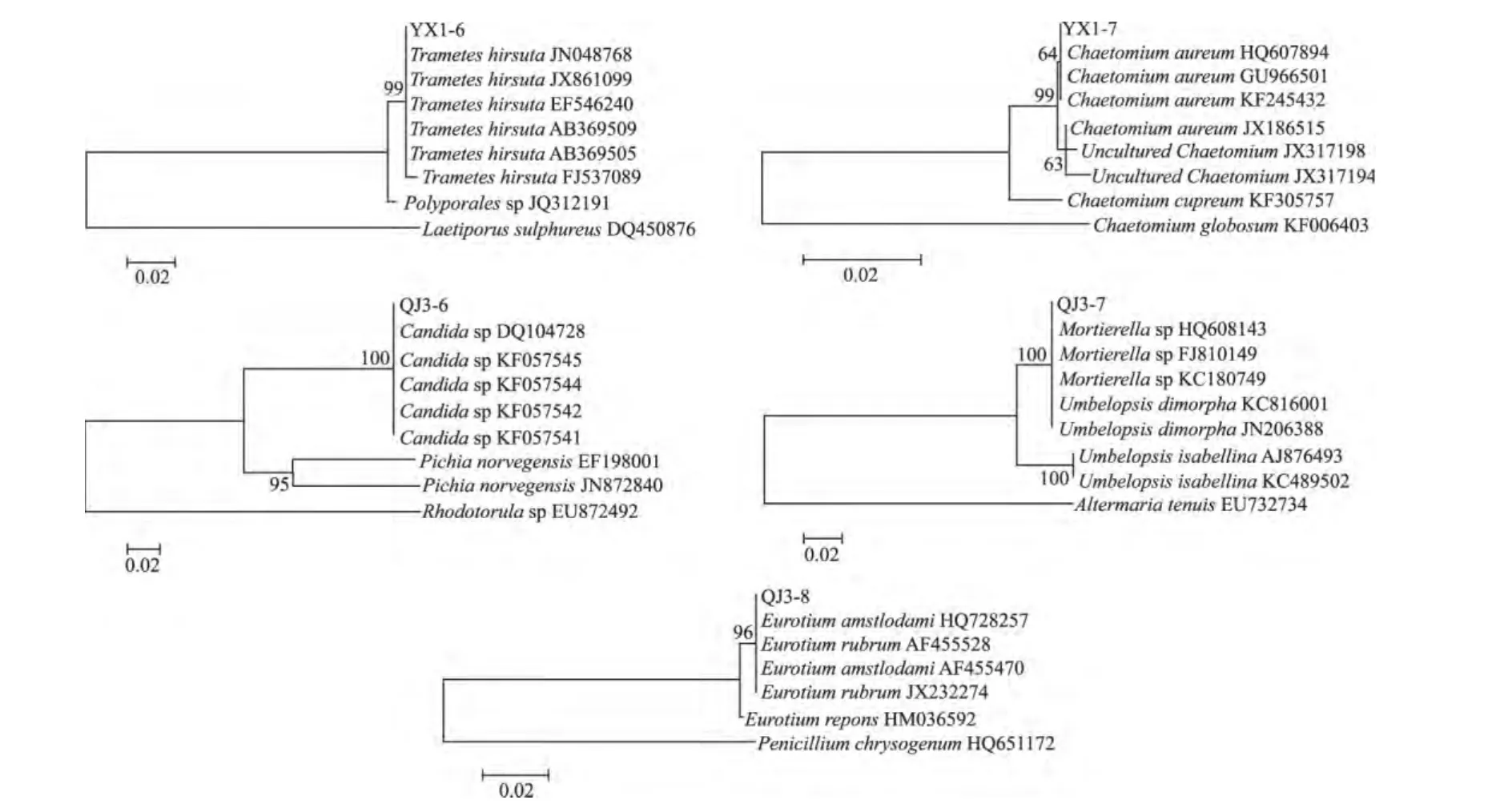
图3 根据rDNA ITS基因序列构建的牛肝菌内生真菌与参考类群间的系统发育树Fig.3 Phylogenetic tree of boletus endophyte based on rDNA ITS and reference taxa

表2 牛肝菌内生真菌及其NCBI数据库相似种ITS rRNA二级结构比较Table 2 Contrast and analysis of ITS ribosomal RNA secondary structure ofboletus endophyte and their similar species in NCBI database
3 结论和讨论
本文的实验研究,从云南牛肝菌4个种的新鲜子实体中分得5株内生真菌,用经典分类方法和分子生物学方法鉴定为:YX1-6为毛栓菌(Trametes hirsuta),YX1-7为金色毛壳菌(Chaetomium aureum),QJ3-6 为假丝酵母属真菌(Candidasp.),QJ3-7 为被孢霉属真菌(Mortierellasp.),QJ3-8 为散囊菌属真菌(Eurotiumsp.),从分类结果可见不同种的牛肝菌的内生真菌也不同,显示了内生真菌的多样性特征。
进一步用DNA STAR和RNAVIZ2.0分析软件预测了它们的二级结构,用于分析研究其分类地位。分析结果显示各分离菌株及其相似种的ITS序列二级结构均为一个中心环及多个螺旋区构成,每个螺旋上又有或多或少的大小不一的茎、环结构,说明牛肝菌内生真菌既具有结构上的共性,又具有鲜明的个性差异。
真菌种类繁多,形态复杂,因此需要采用形态、结构、生理生化等表型方面的特征和各种分子生物学手段进行分类鉴定。该论文对牛肝菌内生真菌的分类鉴定,在形态结构和分子水平上都进行了研究,所得结果一致并可相互印证,可见对内生真菌分类研究,采用综合性手段的必要性和可靠性。
[1]黄自来.中国食用菌百科[M].北京:中国农业出版社,1993:56-59.
[2]王海坤,李涛,赵丹丹,等.两株滇产广义美味牛肝菌的分离培养及其分子鉴定[J].云南植物研究,2007,29(5):559-562.
[3] McLaughlin DJ.Environmentalcontroloffruitbody development in Boletus rubellus in axenic culture[J].Mycologia,1970,62:307-331.
[4]Pantidou M,Watling R.Fruit-bodies of Boletus amarellus in pure-culture[J].Notes from the Royal Botanic Garden,1973,32:439-443.
[5]Yamanaka K,Namba K,Tajiri A.Fruit body formation of Boletus reticulatus in pure culture[J].Mycoscience,2000,41:189-191.
[6]Ohta A,Fujiwara N.Fruit- body production ofan ectomycorrhizal fungus in genus Boletus in pure culture[J].Mycoscience,2003,44:295-300.
[7]黄年来.中国大型真菌原色图谱[M].北京:中国农业出版社,1998.
[8]吴晓刚.牛肝菌的分离培养及磷酸盐转运蛋白基因的克隆[D].昆明:云南大学,2012.
[9]朱萍,郭永红,丁晓雯,等.四种鲜牛肝菌成分分析[J].中国食用菌,2006,25(4):44-45.
[10]冮洁,李学伟,金怀刚.美味牛肝菌菌丝体与子实体蛋白质营养价值的评价[J].食品科学,2013,34(3):253-255.
[11]沈杰.远东疣柄牛肝菌的化学成分[D].杨凌:西北农林科技大学,2003.
[12]刘佳,殷忠,高敏,等.野生牛肝菌化学成分分析及遗传毒性研究[J].微量元素与健康研究,2007,24(3),3-4.
[13]李志洲.美味牛肝菌多糖的抗氧化性[J].食品与发酵工业,2007,33(4),49-51.
[14]李娜.泰山美味牛肝菌多糖提取纯化及功能研究[D].泰安:山东农业大学,2008.
[15]唐薇,鲁新成.美味牛肝菌多糖的生物活性及其抗S-180肿瘤的效应[J].西南师范大学学报:自然科学版,1999,24(4):478-481.
[16]Petrini O.Fungal endophytes of tree leaves[C]//Andrews J H,Hirano S S eds.Microbial ecology of leaves.New York:Springer-Verlag,1991:179-197.
[17]Strobel G,Stierle A,Stierle D.Taxomyces andreanae:a proposed new taxon for a bulbilliferous by phomycete associated with pacific yew(Taxus brevifolia)[J].Mycotaxon,1993,38(3):214.
[18]黄忠京,杨瑞云,白丽娟,等.南海红树林内生真菌ZSUH26生物碱类代谢产物的研究[J].化学研究与应用,2009,21(11):1566-1570.
[19]Harper J K,Ford E J,Strobel G A,et al.Pestacin:a 1,3-dihydro isobenzofuran from Pestalotiopsis microspora possessing antioxidant and antimycotic activities[J].Tetrahedron,2003,59:2471-2476.
[20]刘琼波,苏开美,白永顺,等.美味牛肝菌的菌种分离培养实验初探[J].食用菌,2007(4):25-26.
[21]曾大兴.适于RAPD分析的真菌DNA提取方法[J].生物技术,2003,13(2):2.
[22]江树勋,邵碧英,陈文炳,等.15种常见食(药)用菌的3种总DNA提取方法比较研究[J].食品科学,2004,25(5):37.
[23]WhiteTJ,Bruns TD,Lee SB,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A].In:Innis MA,Gelfand DH,SninskyJJ eds,PCR Protocols:A Guide to Methods and Applications[M].NewYorks:Academic Press,1990:315-321.
[24]中国科学院微生物研究所《常见与常用真菌》编写组.常见与常用真菌[M].北京:科学出版社,1978.

