蜂王浆主蛋白提取工艺优化及质量分析
于张颖,肖 发,柳丹丹,翟 量,沈立荣
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
蜂王浆是工蜂咽下腺、上颚腺和脑后腺分泌的供蜜蜂幼虫和蜂王食用的浆状物,是决定蜜蜂幼虫成为工蜂还是蜂王的关键因素[1],对人体具有抗疲劳[2]、抗衰老[3]、免疫调节[4]等保健功能,作为营养保健品、药品、化妆品在国内外广泛应用[5]。最新研究表明,占王浆总蛋白的82%~90%的主蛋白(Major Royal Jelly Proteins,简写MRJPs)是蜂王浆中最重要的活性成分,是代表蜂王浆质量和新鲜度的标志[1]。但目前国内外市场的蜂王浆产品均为蜂王浆原浆或冻干粉加工品,很有必要对MRJPs进行新产品的研究开发。
近年来国内外已先后开展了离心[6]、碱提酸沉[7]、盐提酸沉[7]、柱层析[8-10]等分离 MRJPs 的研究探索,但碱提酸沉、盐提酸沉存在有机溶剂污染、影响蛋白活性、副产物浪费等问题,柱层析则存在工艺复杂、成本偏高的问题,而离心分离具有操作简便、对蛋白活性影响小、王浆酸和多糖等其它活性成分可回收利用的优点。为此,我们开展了MRJPs离心分离和副产物回收利用及产物质量分析研究,为蜂王浆深加工提供科学依据。
1 材料与方法
1.1 材料与仪器
鲜王浆 杭州碧于天保健品有限公司提供;Bradford蛋白定量试剂盒 上海杰瑞生物科技有限公司;中等分子质量蛋白质标准、TMB显色液试剂盒 上海泽衡生物科技有限公司;HRP-羊抗兔抗体 北京庄盟国际生物基因科技有限公;MRJP1多克隆抗体 采用本实验室重组表达的MRJP1免疫大白兔得到[11]。
pH计 赛德瑞斯公司;5804R型冷冻离心机艾本德中国有限公司;CP70MX超速离心机 日本Hitachi公司;752型紫外可见分光光度计 北京普析通用仪器有限责任公司;FD-1-50真空冷冻干燥机 南京以马内利仪器设备有限公司;蛋白电泳仪 美国Bio-Rad公司;2300自动凯氏定氮仪 福斯赛诺分析仪器(苏州)有限公司。
1.2 实验方法
1.2.1 MRJPs提取 称取适量鲜王浆,按一定液料比(2~10mL/g)加入适当浓度的 NaCl溶液(0.3~0.7mol/L),混匀,调节 pH(5~9),4℃充分搅拌一段时间(2~10h)后,4℃、12000r/min 离心 30min,取上清液即为MRJPs溶液,将MRJPs溶液和含糖分、王浆酸的沉淀分别冷冻干燥备用[6]。
用凯氏定氮法测定鲜王浆中蛋白质含量(参考GB 9697-2008)[12],Bradford 法(BSA 为标准蛋白)测定提取上清液中可溶性蛋白MRJPs含量[13]。
MRJPs提取率(%)=上清液中蛋白质量/所用鲜王浆中蛋白质量×100
1.2.2 MRJPs提取工艺的优化 通过单因素实验考察液料比、pH、抽提时间、离子强度对鲜王浆中MRJPs提取率的影响。液料比选择 2、4、6、8、10mL/g五个水平,pH 选择5、6、7、8、9 五个水平,抽提时间选择2、4、6、8、10h 五个水平,离子强度(NaCl浓度)选择0.3、0.4、0.5、0.6、0.7mol/L 五个水平,以 MRJPs提取率为考察指标。在此基础上选择适当水平进行了四因素三水平正交实验(表1),以优化MRJPs的提取工艺。
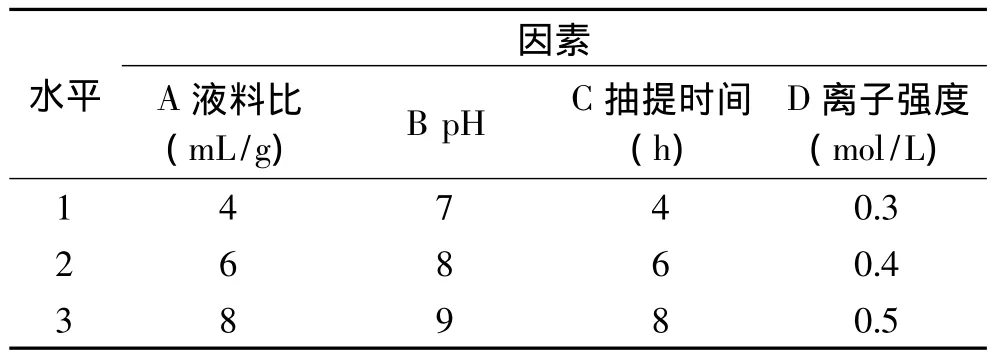
表1 正交实验因素水平表Table 1 Factors and levels for orthogonal design
1.2.3 SDS-PAGE电泳分析 参考《分子克隆·第三版》[14],对提取所得蛋白进行 SDS-PAGE 电泳,采用12%分离胶,考马斯亮蓝法染色,对结果拍照分析。
1.2.4 MRJP1提取分离 参考Salazar-Olivo L A等人的方法[6]改进:称取适量鲜王浆,用等质量超纯水稀释混匀,充分抽提6h;混合液在245000×g、4℃条件下离心5h,出现分层现象后,将中间层取出,用2倍质量超纯水将中间层溶解,室温下抽提1h,混匀;将该液在30000×g、6℃下离心30min,取上清;上清液在245000×g、6℃下离心5h,取沉淀,此沉淀即为MRJP1蛋白,-20℃保存。
1.2.5 ELISA法检测MRJPs纯度 我们前期研究已证实,MRJP1与MRJPs家族其它成员具有很高的同源性,MRJP1多克隆抗体可与MRJPs家族其它蛋白产生交叉反应[15],因此本实验中以大肠杆菌中重组表达的MRJP1制备的多克隆抗体为一抗,以MRJP1为标准蛋白,采用间接ELISA法测定提取产物冻干粉中MRJPs蛋白含量。
1.2.5.1 标准曲线的建立 参考文献[16],将MRJP1溶于 CBS缓冲液(0.05mol/L,pH=9.6)中,配成10μg/mL的溶液,倍比稀释后加样于96孔板中,4℃包被过夜。PBST(0.05%)洗涤,5%脱脂牛奶37℃封闭1.5h。PBST洗涤,MRJPs全蛋白多克隆抗体(一抗,1∶5000稀释)37℃孵育1h。PBST洗涤,HRP标记的羊抗兔抗体(二抗,1∶5000稀释)37℃孵育0.5h。PBST洗涤,TMB显色液室温反应15min后加入2mmol/L H2SO4终止显色反应。立即于酶联免疫检测仪上测定450nm及630nm处吸光值。以OD450~OD630为纵坐标,MRJP1浓度为横坐标绘制标准曲线。
1.2.5.2 MRJPs定量分析 同法测定最佳提取条件下MRJPs提取液冻干粉(配成15μg/mL溶液)的MRJPs含量。
1.2.6 MRJPs冻干粉中水分和王浆酸测定 参照GB 9697-2008[12]测定 MRJPs冻干粉中水分和王浆酸的含量。
1.2.7 鲜王浆及MRJPs提取副产物中王浆酸和总糖测定 取鲜王浆及MRJPs提取副产物沉淀的冻干物,参照 GB 9697-2008[12],采用分光光度法测定总糖含量,采用液相色谱法测定王浆酸含量,二者回收率的计算方法为:
王浆酸回收率(%)=沉淀中王浆酸质量/所用鲜王浆中王浆酸质量×100
总糖回收率(%)=沉淀中总糖质量/所用鲜王浆中总糖质量×100
1.3 数据统计及分析
所有实验均作三组平行,所得数据用DPS软件进行统计分析,结果用平均值±标准差表示。
2 结果与分析
2.1 单因素实验
2.1.1 液料比对MRJPs提取率的影响 在pH=7,抽提时间6h,离子强度0.5mol/L条件下,由图1可知,液料比在2~10mL/g范围内,液料比越高,MRJPs提取率越高。其中,在2~4mL/g及8~10mL/g范围内,MRJPs提取率随液料比增高而增长较快;在4~8mL/g范围内,MRJPs提取率随液料比增高而增长缓慢。考虑到生产过程中加水过多会带来额外的脱水成本,选择4、6、8mL/g作为正交实验的三个水平。
2.1.2 pH对MRJPs提取率的影响 由图2可知,在液料比6mL/g,抽提时间6h,离子强度0.5mol/L条件下,当pH在5~6范围内时,MRJPs提取率随pH增高而快速增长;当pH在6~7范围内时,MRJPs提取率随pH增高而较快增长;当pH在7~8范围内时,MRJPs提取率随pH增高而略有增高;当pH在8~9范围内时,MRJPs提取率随pH增高而缓慢下降。根据提取率大小选择pH7、8、9进行正交实验。
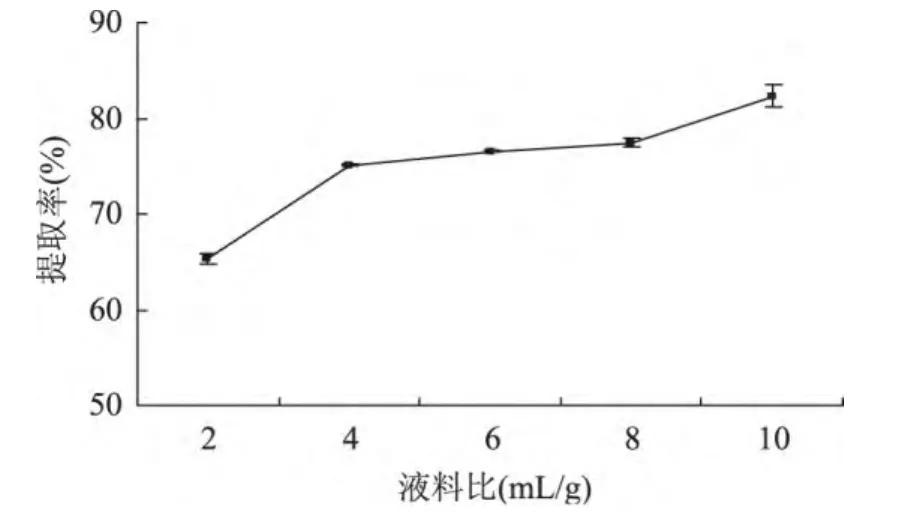
图1 液料比对MRJPs提取率的影响Fig.1 Effect of the ratio of solution to sample on MRJPs extraction rate
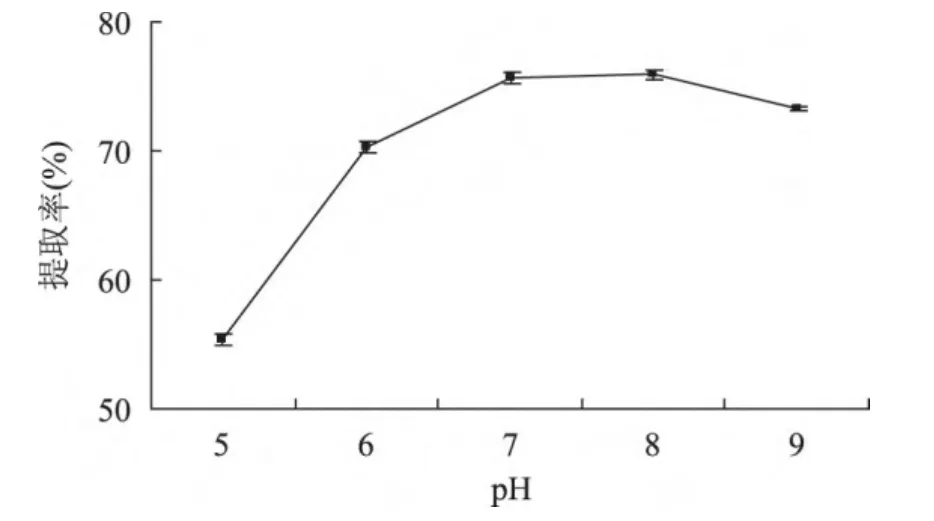
图2 pH对MRJPs提取率的影响Fig.2 Effects of pH values on MRJPs extraction rate
2.1.3 抽提时间对MRJPs提取率的影响 在液料比6mL/g,pH=7,离子强度0.5mol/L条件下,抽提时间在2~10h范围内,MRJPs提取率随抽提时间延长而提高。在2~4h范围内,MRJPs提取率随抽提时间延长而快速提高;在4~10h范围内,MRJPs提取率随抽提时间延长而缓慢提高。其结果见图3。综合考虑生产效率的影响,选用4、6、8h三个水平进行正交实验。
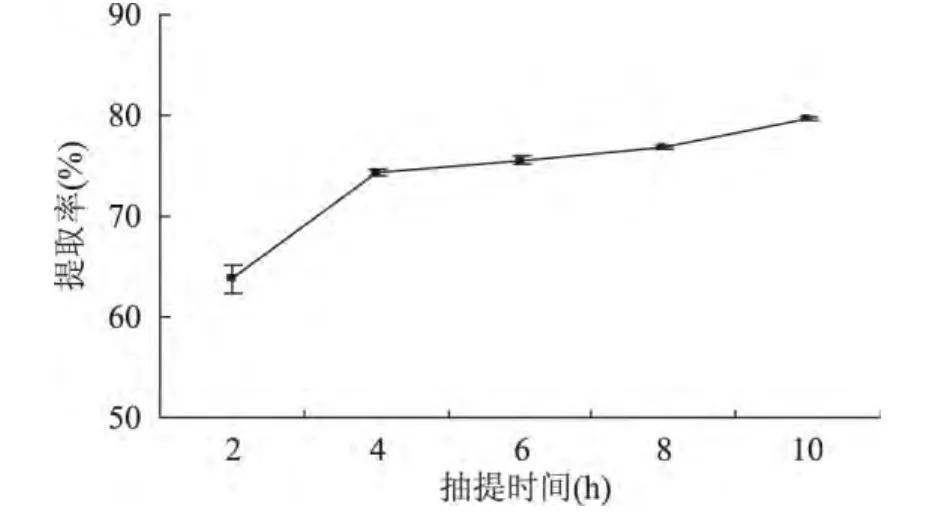
图3 抽提时间对MRJPs提取率的影响Fig.3 Effect of extracting time on MRJPs extraction rate
2.1.4 离子强度对MRJPs提取率的影响 由图4可见,在液料比6mL/g,pH=7,抽提时间6h条件下,离子强度为0.3~0.6mol/L时,随着离子强度的增大,MRJPs提取率随之提高;离子强度为0.6~0.7mol/L时,MRJPs提取率随离子强度的增大而降低。综合考虑提取率及脱盐带来的成本,选择离子强度0.3、0.4、0.5mol/L进行正交实验。
2.2 正交实验
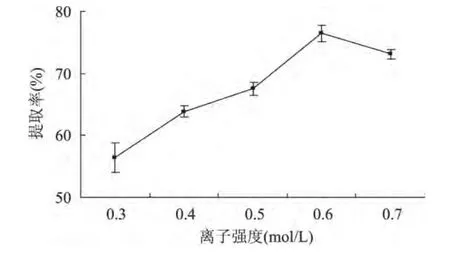
图4 离子强度对MRJPs提取率的影响Fig.4 Effect of ionic strength on MRJPs extraction rate
以MRJPs提取率为指标进行实验并对结果进行极差和方差分析。由表2和表3可知,影响MRJPs提取率的因素依次为:离子强度>pH>抽提时间>液料比,但影响均不显著(p>0.05)。由表2可知,最佳条件组合为A3B2C3D3,即液料比8mL/g,pH8,抽提时间8h,离子强度0.5mol/L。按此优化工艺作进一步验证,结果MRJPs提取率达81.14%。

表2 正交实验结果Table 2 Analysis of orthogonal experiment results
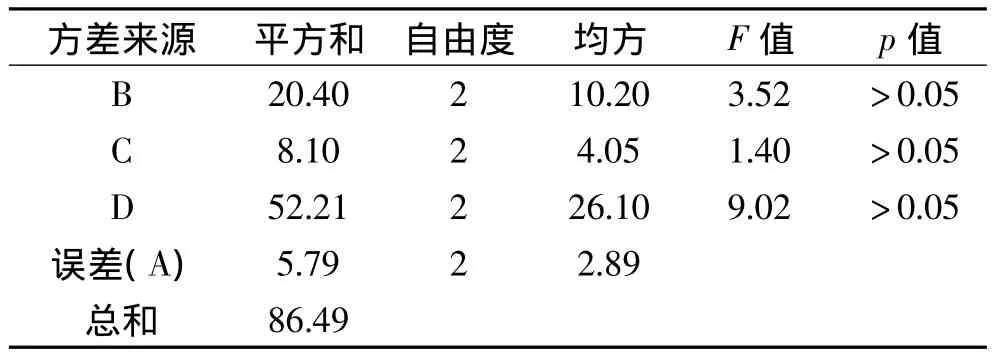
表3 方差分析结果Table 3 Result of variance analysis
2.3 SDS-PAGE电泳检测
根据MRJPs蛋白SDS-PAGE电泳图(图5)中的蛋白标准估计,MRJPs标蛋白条带主要分布范围在42.1~97.4ku,其中以分子量为57ku的条带最明显,与Kamakura等报道的MRJP1分子量一致[2]。同时,MRJP1的纯化产物也显示为分子量为57ku单一蛋白条带,也符合已报道的 MRJP1蛋白特征[2],说明MRJP1提取得到了单一蛋白。
2.4 MRJPs纯度分析
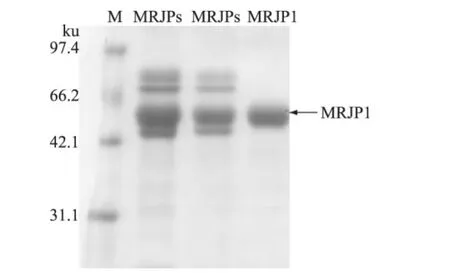
图5 MRJPs和MRJP1 SDS-PAGE电泳图Fig.5 SDS-PAGE analysis of MRJPs and MRJP1泳道M:蛋白质Marker。
MRJP1标准曲线如图6,得到MRJP1与吸光度间的回归方程:y=0.1100x+0.1239(R2=0.998,式中y为吸光度,x为MRJPs含量),将所测MRJPs冻干粉的吸光度(OD450-OD630=1.306±0.110)代入该式,换算得含MRJPs冻干粉纯度为71.7%。
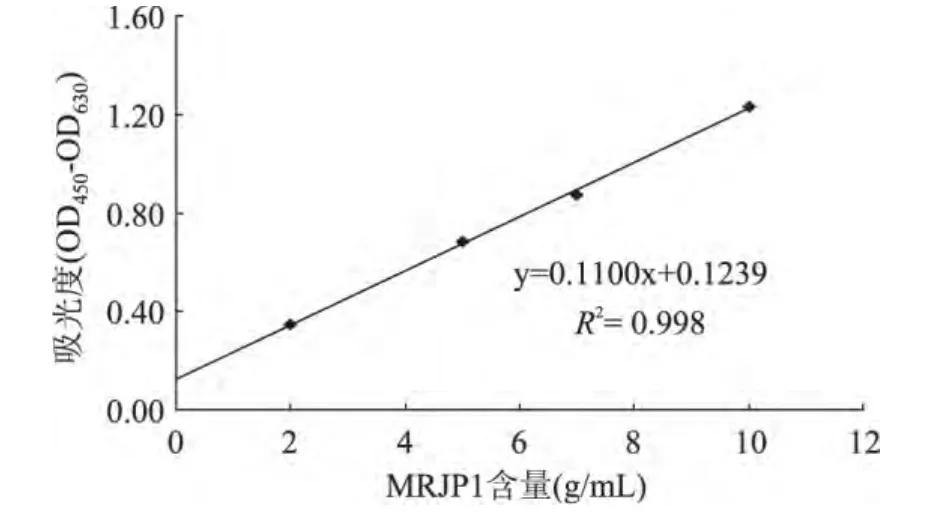
图6 MRJP1标准曲线Fig.6 Standard curve of MRJP1
2.5 MRJPs冻干粉中水分和王浆酸含量分析
按照GB 9697-2008测得MRJPs提取物冻干粉含水分0.005%,王浆酸0.55%。
2.6 MRJPs提取副产物中王浆酸及总糖分析
鲜王浆及最佳条件下提取MRJPs产生的沉淀冻干物中王浆酸及总糖含量见表5。经换算得副产物质量为原料的2.68%,其中王浆酸和总糖回收率分别为2.91%和1.26%。

表4 鲜王浆和副产物中王浆酸及总糖分析结果Table 4 Analysis of 10-HDA and total sugar in fresh royal jelly and by-product
3 结论与讨论
蓝瑞阳等[7]报道的蜂王浆蛋白的盐提酸沉法收率为83.62%,碱提酸沉法收率为75.17%,但该报道没有做纯度测定。本研究通过正交实验,得到了离心提取王浆主蛋白MRJPs的最佳工艺:液料比8mL/g,pH8,抽提8h,离子强度0.5mol/L。在此条件下,MRJPs提取率达到81.14%,产物纯度达到71.7%。同时实现了副产物王浆酸和总糖的回收,使蜂王浆活性产物得到充分利用。此外,采用自制重组表达MRJP1多克隆抗体,通过ELISA法检测了所提取MRJPs的纯度,为蜂王浆深加工和质量控制提供了科学依据。
[1]柳丹丹,肖发,杨晓丽,等.蜜蜂蜂王不同于工蜂的关键因素-蜂王浆主蛋白 1[J].食品工业科技,2012,33(12):371-375.
[2]Kamakura M,Suenobu N,Fukushima M.Fifty-seven-kDa protein in royal jelly enhances proliferation of primary cultured rat hepatocytes and increases albumin production in the absence of serum[J].Biochem Biophys Res Comm,2001,282(4):865-874.
[3]Kamakura M.Royalactin induces queen differentiation in honeybees[J].Nature,2011,473(7348):478-483.
[4]Okamoto I,Taniguchi Y,Kunikata T,et al.Major royal jelly protein 3 modulates immune responsesin vitroandin vivo[J].Life Sciences,2003,73(16):2029-2045.
[5]沈立荣,张璨文,丁美会,等.蜂王浆的营养保健功能及分子机理研究进展[J].中国农业科技导报,2009,11(4):41-47.
[6]Salazar-Olivo L A,Paz-Gonzales V.Screening of biological activities present in honeybee(Apis mellifera)royal jelly[J].Toxicologyin Vitro,2005,19(5):645-651.
[7]蓝瑞阳,朱威,季文静,等.蜂王浆蛋白提取工艺研究[J].蜜蜂杂志,2008,3:18-20.
[8]Schmitzova J,Klaudiny J,Albert S,et al.A family of mayor royal jelly proteins of honeybee Apis mellifera L.[J].Cell Mol Life Science,1998,54(9):1020-1030.
[9]Bilikova K,Hanes J,Nordhoff E,et al.Apisimin,a new serine-valine-rich peptide from honeybee(Apis melliferaL.)royal jelly:purification and molecular characterization[J].FEBS Letters,2002,528(1-3):125-129.
[10]Sano O,Kunikata T,Kohno K,et al.Characterizaton of royal jelly proteins in both Africanized and European honeybees(Apis mellifera.)by two- dimensional gel electrophoresis[J].J Agric Food Chem,2004,52(1):15-20.
[11]张瓅文,丁美会,张伟光,等.中华蜜蜂Acc MRJP1基因克隆及在大肠杆菌中的表达[J].浙江大学学报:农业与生命科学版,2010,36(2):119-124.
[12]GB 9697-2008《蜂王浆》[S].
[13]Kruger N J.The Bradford method for protein quantitation[J].Methods in Molecular Biology,1994,32:9-15.
[14]J.萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南(第三版)[M].北京:科学出版社,2002:1713-1720.
[15]柳丹丹.王浆主蛋白MRJP-1分离测定及对细胞的促生长作用研究[D].杭州:浙江大学,2013.
[16]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法——基本原理及其在食品化学污染物检测中的应用[M].北京:科学出版社,2011.

